Введение
Акне – это распространенное воспалительное заболевание кожи. Важную роль в развитии дерматоза играет взаимодействие между микробами кожи и иммунитетом хозяина, при этом у пациентов с акне обнаруживаются возмущенный микробный состав и активность. Расширенный метагеномный анализ показал, что кожная микробиота у пациентов с и без акне различается на уровне вирулентно-специфической линии [1]. В патогенезе акне кроме увеличения продукции секрета сальных желез, фолликулярного гиперкератоза и колонизации микроорганизмов развивается воспалительный процесс в области сально-волосяного фолликула. Триггером воспаления могут быть бактерии Cutibacterium acnes, которые посредством активации Toll-like-рецепторов, рецепторов протеаз (PAR-2), индукции дефензинов (антимикробных пептидов) стимулируют секрецию следующих цитокинов: интерлейкина-1 (ИЛ-1), -8, -12 и фактора некроза опухоли-α, приводят к аккумуляции в коже воспалительных клеток и нарушению десквамации кератиноцитов в области протоков сальных желез [2]. В то же время образование комедонов и развитие воспаления могут происходить и в стерильных условиях. Формирование акне в асептической среде является результатом активации пероксидаз липидами кожного сала или развития воспаления по рефлекторному механизму при выделении нейропептидов нервными окончаниями на фоне стресса [3].
Акне также имеет тесные связи с желудочно-кишечным трактом, и многие утверждают, что микробиота кишечника может быть вовлечена в патогенный процесс. Например, было выдвинуто предположение, согласно которому эмоции стресса (депрессия и тревога) усугубляют акне, изменяя микробиоту кишечника и увеличивая его проницаемость, потенциально способствуя воспалению кожи [1].
Только несколько исследователей изучали кишечную флору пациентов с акне. Первое такое исследование проведено в 1955 г., в котором сравнивали присутствие потенциально патогенных бактерий у 10 пациентов с акне с таковым у лиц без акне [4]. Примечательно, что виды Bacteroides, которые увеличиваются в условиях стресса, часто выделялись у пациентов с акне. В российском исследовании сообщалось, что пациенты с акне демонстрируют заметно отличающуюся кишечную флору по сравнению с контролем без акне [5]. В исследовании Y. Den et al. [6] пациенты с акне демонстрировали более низкое разнообразие кишечной микробиоты и более высокое соотношение Bacteroidetes к Firmicutes, что является энтеротипом западной диеты. Много доказательств указывают на то, что западная диета с низким содержанием клетчатки и высоким содержанием жиров вызывает фундаментальные изменения в кишечной микробиоте, cпособствуя метаболическим и воспалительным заболеваниям кожи [7]. Считается, что это стимулирует повышенную цитоплазматическую экспрессию метаболического фактора транскрипции форкхед-бокса (FoxO1) – датчика состояния питания клеток. FoxO1 запускает в конечном счете млекопитающую мишень рапамицинового комплекса-1 (mTORC1), управляющего метаболизмом и пролиферацией клеток для опосредованной гиперпролиферации сальных желез, липогенеза и гиперплазии акроинфундибулярных кератиноцитов, тем самым способствуя развитию акне [2, 8].
Хотя еще не полностью известен механизм, с помощью которого микробиота кишечника влияет на гомеостаз кожи, по-видимому, происходит модулирующее влияние на системный иммунитет [9]. Кроме того, данные свидетельствуют о том, что кишечная флора может влиять на кожу более непосредственно, транспортируя кишечную микробиоту [1, 9, 10]. При нарушении барьера кишечная микробиота и ее метаболиты быстро попадают в кровоток, накапливаются в коже и нарушают микробный баланс [9].
Адапален – метаболит ретиноида, действующего на патологический механизм развития акне. В результате действия адапалена 0,1% происходит снижение «сцепленности» эпителиальных клеток в устье сально-волосяного фолликула и уменьшение образования микрокомедонов. Адапален оказывает противовоспалительное действие in vivo и in vitro, воздействуя на факторы воспаления путем ингибирования миграции лейкоцитов в очаге воспаления, угнетает хемотактический и хемокинетический ответы полиморфноядерных лейкоцитов человека и подавляет метаболизм арахидоновой кислоты до медиаторов воспаления и экспрессию Toll-подобных рецепторов [11].
Метронидазол представляет собой синтетическое противомикробное средство широкого спектра действия из группы имидазолов. Препарат активен в отношении анаэробных бактерий. Механизм лечебного действия топического метронидазола полностью не изучен. При местном применении этот препарат эффективен в лечении вульгарных акне [7]. Метронидазол 1% обладает антиоксидантной активностью. Установлено, что он значительно снижает продукцию нейтрофильными лейкоцитами активных соединений кислорода, гидроксильных радикалов и пероксида водорода, которые являются потенциальным оксидантом, способным вызывать повреждение тканей в месте воспаления. Кроме того, спектр действия метронидазола включает Bacteroides spp. (в т.ч. Bacteroides fragilis, Bacteroides distasonis, Bacteroides ovatus, Bacteroides thetaiotaomicron, Bacteroides vulgatus), которые нарушают микробный баланс кожи пациентов с акне в условиях стресса [12].
Комбинация топических ретиноидов, обладающих комедонолитическим и противовоспалительным действиями, и метронидазола для наружного применения может быть эффективной в терапии акне легкой и средней степеней тяжести [2, 12, 13].
Цель исследования: изучение клинической эффективности, безопасности и переносимости геля для наружного применения Метрогил А (комбинация адаполена 0,1% и метронидазола 1%) в терапии больных акне средней степени тяжести.
Методы
На кафедре дерматовенерологии и косметологии ФГБОУ ВО ОмГМУ Минздрава РФ, на клинической базе БУЗОО ККВД проведено прямое открытое неконтролируемое исследование. Под наблюдением находились 30 пациентов (18 женщин и 12 мужчин) в возрасте от 18 до 42 лет с клинически установленным диагнозом «акне средней степени тяжести». Средний возраст больных составил 22,6±4,28 года, средняя продолжительность заболеванием акне в исследуемой популяции – 3,03±1,54 года (диапазон – 2–5 лет). Пациенты (n=30) наносили гель Метрогил А тонким слоем на пораженные угревой сыпью участки лица 1 раз в сутки перед сном на чистую сухую кожу. Все пациенты предоставили письменное информированное согласие на участие в исследовании.
Критерии исключения: возраст до 18 лет, беременность, период грудного вскармливания, другие заболевания дерматологического профиля, наличие системных аутоимунных заболеваний, лечение акне другими системными и топическими препаратами, индивидуальная гиперчувствительность к адаполену и метронидазолу.
Общая продолжительность наблюдения составила 8 недель, включила первичный клинический и контрольный осмотры на 4-й и 8-й неделях лечения. Число воспалительных и невоспалительных поражений, наличие эритемы и любых возможных осложнений/ побочных эффектов оценивалось и документировалось при каждом посещении квалифицированным дерматологом. При последнем посещении пациенты проходили опрос об их удовлетворенности лечением.
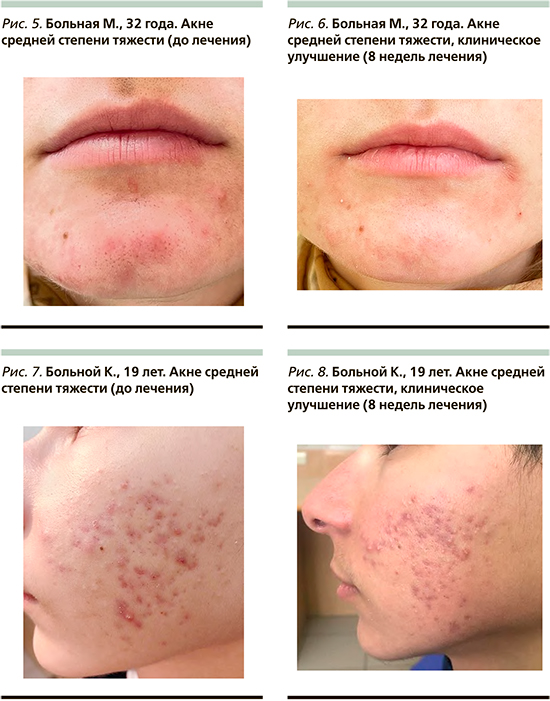
У всех (n=30) пациентов диагностирована средняя степень тяжести акне: расширенные поры, сальный блеск, наличие комедонов открытого и закрытого типов, более 20 папуло-пустулезных элементов (классификация акне по степени тяжести G. Plewig, A.M. Kligman, 2004), явления стойкой эритемы и поствоспалительной пигментации (рис. 1, 2, 5, 7). При клиническом осмотре патологического процесса оценивались критерии клинической эффективности: уменьшение признаков воспаления, регресс элементов, уменьшение явлений фолликулярного гиперкератоза.

Для оценки клинической эффективности терапии на завершающем этапе (через 8 недель) использовали следующие критерии:
- клиническое выздоровление – полный регресс первичных элементов сыпи на коже;
- значительное клиническое улучшение – уменьшение числа воспалительных и невоспалительных элементов сыпи на коже не менее чем на 75% по сравнению с исходными данными;
- клиническое улучшение – снижение числа воспалительных и невоспалительных элементов сыпи на коже не менее чем на 25% и не более чем на 75% по сравнению с исходным состоянием;
- отсутствие эффекта – уменьшение числа воспалительных и невоспалительных элементов сыпи на коже менее чем на 25% по сравнению с исходными данными;
- ухудшение – отрицательная динамика со стороны кожного процесса по сравнению с исходным состоянием.
Результаты
В результате проведенной терапии у всех (n=30) больных на 8-й неделе отмечена положительная динамика кожного процесса (рис. 1). У 8 (27%) пациентов достигнуто значительное клиническое улучшение (рис. 2, 4), у 22 (73%) – клиническое улучшение (рис. 6, 8). Побочных эффектов, требующих отмены препарата, за отчетный период выявлено не было. Побочными эффектами терапии были легкое жжение у 12 (40%) пациентов и умеренная сухость кожи у 22 (73%). Данные проявления легко купировались применением профессиональной дерматокосметики, что позволило всем пациентам завершить период исследования. По окончании терапии у большинства (n=28) пациентов наблюдались остаточные явления в виде поствоспалительной пигментации (рис. 3), что потребовало дополнительной терапии препаратами, блокирующими активность тирозиназы, например, на основе азелаиновой кислоты. При последнем посещении 96% пациентов заявили, что они удовлетворены результатами лечения.
Обсуждение
В настоящем исследовании показано, что комбинация метронидазола с адапаленом является эффективным и безопасным топическим средством для лечения акне. Существует лишь ограниченное число исследований, в которых изучалось влияние местного применения метронидазола пациентами с акне и результаты были переменными [12].
С. acnes традиционно считается устойчивым к метронидазолу микроорганизмом [12, 14]. В основе терапевтического эффекта метронидазола могут лежать механизмы, отличные от микробицидного действия, такие как противовоспалительное, иммуносупрессивное и противозудное, а также ингибирование генерации свободных радикалов нейтрофилами человека [15].
Тем не менее развитие устойчивых штаммов всегда вызывает беспокойство и использование терапевтических схем, которые включают препараты с дополнительными, но различными механизмами действия, служит возможной стратегией в этом отношении [12, 16].
Выводы
Данные проведенного исследования указывают на высокий профиль безопасности и переносимости геля Метрогил А.
Полученные клинические результаты свидетельствуют, что комбинация адапалена 0,1% и метронидазола 1% эффективна в терапии больных акне средней степени тяжести.
Побочные эффекты терапии в виде жжения и сухости кожи купировались сочетанным применением профессиональной дерматокосметики, а с целью коррекции поствоспалительной пигментации к лечению необходимо добавлять препараты, ингибирующие активность тирозиназы.



