Введение
Аденомиоз характеризуется инвазией функциональных или эктопических желез эндометрия и стромы в миометрий в сочетании с локальной гиперплазией или без нее [1, 2]. Несмотря на совершенствование хирургических методов лечения и возможности медикаментозной терапии, распространенность аденомиоза не имеет тенденции к уменьшению, в т.ч. со стороны женщин репродуктивного возраста, и, по данным ряда авторов, составляет от 20 до 70% [2—5]. Широкий диапазон выявляемости заболевания обусловлен прежде всего различиями в возрастных группах и в используемых методах диагностики.
Для диагностики аденомиоза предложено достаточно много различных методов: магнитно-резонансная томография (МРТ), ультразвуковое исследование (УЗИ), лапароскопия, гистероскопия, гистеросальпингография. Гистологическое исследование миометрия, полученного при мультифокальной биопсии миометрия или после аденомиомэктомии, гистерэктомии, служит окончательным подтверждением диагноза. МРТ обладает высоким пространственным разрешением в отсутствие ионизирующего излучения и вносит существенный вклад в диагностику аденомиоза [6]. Кроме того, МРТ органов малого таза позволяет оценивать на Т2-взвешенных изображениях смежные органы и различные слои матки, в т.ч. переходную зону (Junctional Zone, JZ), увеличение которой является одним из диагностических критериев выявления аденомиоза [7]. Однако наличие ряда недостатков МРТ (высокая стоимость, невозможность выполнения исследования в тот же день, когда пациентка обращается на прием к гинекологу, наличие противопоказаний у некоторых больных) ограничивает широкое использование данного метода. Несомненно, УЗИ органов малого таза является первой линией диагностического поиска при постановке диагноза аденомиоза, используется в рутинной клинической практике, считается доступным и неинвазивным методом. Однако существующие и часто встречающиеся гипер- и гиподиагностика аденомиоза при проведении стандартной методики УЗИ обусловливают разработку комбинированного подхода с использованием дополнительных возможностей УЗИ, позволяющего своевременно и правильно устанавливать диагноз, что особенно ценно на начальных стадиях развития заболевания у пациенток, не реализовавших репродуктивной функции.
Современные способы ультразвуковой диагностики аденомиоза основаны на рекомендованных консенсусом MUSA критериях [8], при этом их дополнение собственной разработанной методикой дает более точные результаты и снижает гипердиагностику аденомиоза [9, 10]. В случае выполнения обычного УЗИ в 2-мерном режиме, основанного на различных критериях неоднородности миометрия, вероятность гипердиагностики аденомиоза возрастает. Желание унифицировать ультразвуковые критерии позволило нам создать единые стандарты последовательной диагностики заболевания, что повышает вероятность правильной постановки диагноза и исключает проблемы гипердиагностики патологического процесса. Во время проведения комплексного УЗИ максимальный акцент был сделан нами на тщательном описании всех особенностей и выявленных структур миометрия, переходной зоны, дополняли данное исследование оценкой васкуляризации и эластографией с последовательной оценкой всех критериев по баллам (см. таблицу). На заключительном этапе производили подсчет баллов с последующим заключением о наличии или отсутствии аденомиоза, а также его степени выраженности.
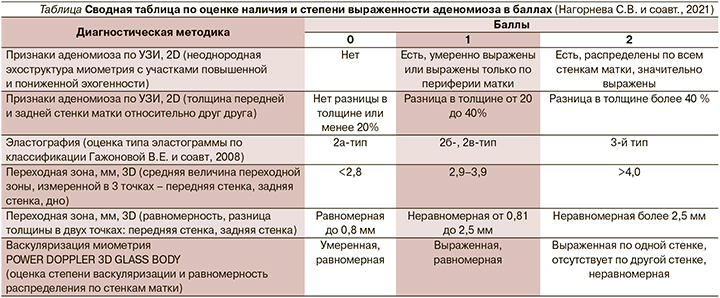
- 0-2 балла - отсутствие аденомиоза;
- 3-4 балла - аденомиоз, начальная форма, умеренно выражен;
- 5-12 баллов - аденомиоз, выражен.
Клинический случай
Для наглядной демонстрации применения предложенной методики представлен следующий клинический случай.
Пациентка С. 36 лет обратилась с жалобами на боли внизу живота, усиливающиеся при менструации, обильные менструальные кровотечения, периодические межменструальные кровянистые выделения. Вторичное бесплодие в течение 3 лет.
Менархе c 13 лет, менструальный цикл регулярный через 30-32 дня по 7-8 дней, менструации болезненные, обильные.
В анамнезе - первичное бесплодие в течение 3 лет, 2010 г. - наружный генитальный эндометриоз (НГЭ). Эндометриоидная киста правого яичника. Лапароскопическая коагуляция очагов эндометриоза, цистэктомия справа, хромогидротубация - маточные трубы проходимы. После лапароскопии получала агонисты ГнРГ по схеме 1 раз в 28 дней (№ 6), после окончания лечения через 3 месяца самостоятельно наступила беременность, закончилась срочными родами в 2012 г.
С 2013 по декабрь 2016 г. пациентка получала комбинированный оральный контрацептив (КОК), содержавший 30 мкг этинилэстрадиола и 2 мг диеногеста.
Предоставлены данные УЗИ, выполненного по месту жительства в 2017 г.: матка шаровидная размером 68*58* 69 мм, миометрий неоднородный, эндометрий соответствует фазе менструального цикла. В правом яичнике функциональная киста c ровными контурами размером 30*23 мм. Левый яичник — 31*24 мм, содержит 5—6 фолликулов размером 4—5 мм.
В марте 2020 г. обратилась с жалобами на обильные, болезненные менструации, боли в нижних отделах живота, не связанные с менструальным циклом.
Результаты гормонального обследования (на 5-й день менструального цикла): ФСГ - 13,0 МЕ/л (1,8-11,3 МЕ/л), ЛГ - 6,1 (1,1-8,7) МЕ/л, АМГ - 0,96 (1,0-4,5) нг/мл, ТТГ - 1,6 (0,243,5) мМЕ/л, пролактин - 580 (70-566) мМЕ/л, прогестерон - 14,5 нмоль/л (на 20-й день менструального цикла).
По результатам клинического анализа крови выявлено снижение уровня гемоглобина до 106 (120-140) г/л, эритроцитов 3,1*1012 (3,7-4,7*1012), гематокрита 30,0 (34,3-46,6) %, остальные показатели в пределах нормальных референсных значений.
При обращении на консультацию в НИИАГ и Р им. Д.О. Отта УЗИ выполнено с учетом рекомендаций консенсуса MUSA, дополненное собственной разработанной методикой диагностики аденомиоза.
УЗИ на 21-й день менструального цикла:
Матка в anteflexioversio, 69*60*70 мм (объем - 150,7 см3), увеличена в размерах, шаровидной формы. Контур ровный. Стенки матки асимметричные (73%) - 2 балла (рис. 1а). Толщина передней стенки - 10,6 мм, задней стенки - 40,6 мм. Миометрий диффузнонеоднородной эхоструктры с множеством мелких гипоэхогенных включений и гиперэхогенных веретенообразных линейных включений, расположенных преимущественно по задней стенке матки, - 2 балла (рис. 1а).

В толще задней стенки ближе к дну в 3-мерном режиме определялось гипоэхогенное образование без четких границ размером 21*18 мм, тип 4 по классификации FIGO (рис. 1б). Переходная зона визуализировалась отчетливо при 3D-реконструкции полости матки и составила 5,6-4,6-3,1 (4,43) мм - 2 балла, асимметричная 2,5 мм - 1 балл (рис. 1в). При оценки общей васкуляризации матки в 2D-сигналов получить практически не удалось, с применением методики 3D-Power Doppler Glass Body удалось визуализировать выраженную васкуляризацию вдоль передней стенки матки и значительно сниженную вдоль передней стенки - 2 балла (рис. 1г). К образованию в дне матки подходил единичный сосуд, проходящий его насквозь (рис. 1д). По эластографии тело матки картировалось зеленым цветом с массой синего (тип 2в) - 1 балл (рис. 1е). Образование в дне матки значимо не отличалось по окраске от окружающих тканей.
Эндометрий - 8 мм секреторного типа, васкуляризация эндометрия отсутствует, патологические образования не определяются. Полость матки не деформирована, без содержимого.
Правый яичник размером 28*16* 18 мм, V - 4,20 см3 обычных размеров, расположен типично, содержит 2-3 фолликула диаметром 5-6 мм, расположенных диффузно. Строма обычной эхогенности в достаточном объеме.
Левый яичник размером 32*21* 20 мм, V — 7,0 см3 обычных размеров, фиксирован у дна матки, содержит 3-4 фолликула диаметром 5-6 мм, расположенных диффузно. Строма обычной эхогенности в достаточном объеме.
Свободная жидкость в малом тазу не определяется.
Заключение по результатам УЗИ: аденомиоз, 10 баллов, диффузно-узловая форма.
Клинический диагноз:
Аденомиоз. Аномальные маточные кровотечения по типу обильных менструальных кровотечений. PALM-A (аденомиоз). Овуляторная дисфункция. Нормогонадотропная нормопролактинемическая недостаточность яичников. Недостаточность лютеиновой фазы. Сниженный овариальный резерв. Вторичная железодефицитная анемия легкой степени.
Бесплодие вторичное (3 года). Отягощенный гинекологический анамнез (2010, НГЭ III степени. Цистэктомия эндометриоидной кисты правого яичника. Комбинированное лечение НГЭ).
Представленная комплексная методика ультразвуковой диагностики аденомиоза обеспечивает наиболее точную диагностику заболевания при меньших материальных затратах и позволяет избегать применения инвазивных методов. Балльная система комплексной оценки аденомиоза позволяет независимо оценивать миометрий по каждому критерию, суммировать баллы, следовательно, объективно и более достоверно оценивать наличие и степень выраженности аденомиоза. Методика проста в использовании и может применяться специалистами ультразвуковой диагностики для понятного и унифицированного подхода. Также представленный алгоритм позволяет диагностировать начальные формы развития аденомиоза для своевременного назначения медикаментозной терапии, профилактики прогрессирования процесса и возникновения клинических проявлений заболевания.
Поскольку аденомиоз рассматривается как хроническое прогрессирующее заболевание, подходы к ведению пациенток обусловливают разработку персонифицированного плана ведения с использованием по показаниям медикаментозного и/или хирургического лечения [11]. Выбор терапии зависит от возраста женщины, репродуктивных планов и клинических симптомов. Несмотря на массу опубликованных исследований, посвященных медикаментозному или хирургическому лечению аденомиоза, в настоящее время не существует единой тактики. Выбор того или иного метода индивидуален и зависит от ряда факторов. Хирургический подход включает гистерэктомию и аденомиомэктомию, имеет ряд дискуссионных аспектов и недостатков [12, 13]. Консервативные варианты хирургического лечения включают аблацию эндометрия, что также является дискуссионным вопросом при данном заболевании, гистероскопическую резекцию эндометрия и аденомиом, лапароскопическую резекцию аденомиоза, высокоинтенсивное сфокусированное УЗИ и эмболизацию маточных артерий [14]. Однако убедительных доказательств, обосновывающих эффективность консервативных вариантов хирургического лечения аденомиоза, все еще недостаточно.
Медикаментозная терапия аденомиоза (гормональные и негормональные методы лечения) применяется в первую очередь для купирования болевого синдрома и аномальных маточных кровотечений, улучшения исходов фертильности. Основываясь на постулате, что аденомиоз является гормональнозависимым заболеванием, в терапии используют препараты, механизм действия которых заключается либо в антигонадотропном влиянии, что приводит к подавлению овуляции, либо непосредственно в воздействии на рецепторы половых стероидных гормонов или ферментов, обнаруженных в очагах поражения. Гормональная терапия включает прогестагены, антигестагены, агонисты гонадотропинрилизинг гормона (аГнРГ), антагонисты ГнРГ, комбинированные контрацептивы, левоноргестрелвыделяющую внутриматочную систему (ЛНГ-ВМС), даназол и нигибиторы ароматазы.
К основным патогенетически обоснованным гормономодулирующим препаратам для лечения аденомиоза, следует отнести аГнРГ, диеногест, ЛНГ-ВМС. Использование нестероидных противовоспалительных средств и КОК направлено в основном на купирование клинических проявлений заболевания (болевого синдрома).
Применение аГнРГ показано к лечению аденомиоз-ассоциированного бесплодия с целью уменьшения объема матки, повышения шансов на наступление как спонтанной беременности, так и в качестве этапа лечения перед процедурами ЭКО [15]. Отмечена более высокая частота наступления беременности у женщин в криопротоколе после предварительного лечения аГнРГ [16]. Напротив, использование аГнРГ для купирования болевого синдрома и кровотечения следует рассматривать только для краткосрочного лечения в связи с ограниченной длительностью курсовой терапии.
Использование прогестинов обосновывается наличием антипролиферативного и противовоспалительного эффектов препарата, децидуализацией, а затем атрофией эндометрия [17]. Возможность длительного применения, хорошая переносимость и высокая эффективность приводят к купированию клинических проявлений, тем самым повышая качество жизни пациенток. Среди прогестинов для лечения эндометриоза диеногест 2 мг занимает лидирующие позиции. Соединение представляет собой прогестаген 4-го поколения, производное 19-нортестостерона, за счет потери этинильного радикала обладает значимой антиандрогенной активностью. При пероральном приеме отличается хорошей переносимостью, высокой биодоступностью (>90%) и минимальным влиянием на метаболизм. Недавно рандомизированное двойное слепое многоцентровое плацебо-контролируемое исследование диеногеста 2 мг, ежедневно назначаемого в течение 16 недель женщинам с аденомиозом, показало значительное снижение болевого синдрома в группе пациенток, получавших лечение данным прогестагеном [18]. Результаты также были подтверждены при длительном лечении, демонстрирующем хорошую переносимость, уменьшение боли и более высокие показатели качества жизни [19]. Наш опыт применения диеногеста 2 мг у 62 больных аденомиозом в течение 6-68 месяцев продемонстрировал хорошую переносимость и метаболическую нейтральность при его долговременном использовании [20]. При этом снижение интенсивности болевого синдрома отмечено у 53,4% пациенток, у 31% - полное его устранение. На фоне приема диеногеста объем матки уменьшился у 70,7% пациенток с аденомиозом.
В приведенном ранее клиническом примере с учетом наличия аденомиоза с клиническими проявлениями у пациентки с бесплодием, сниженным овариальным резервом и комбинированным лечением НГЭ решено провести терапию прогестагенами (диеногест 2 мг) в течение 6 месяцев. За время наблюдения не было отмечено существенных побочных эффектов. Переносимость препарата хорошая, через 1,5 месяца от начала приема диеногеста наблюдались скудные кровянистые выделения в течение 7 дней, купировались самостоятельно, препарат пациентка на тот период не отменяла. Через 6 месяцев применения диеногеста 2 мг для оценки состояния миометрия на фоне проведенной терапии выполнено повторное УЗИ с применением тех же критериев, описанных выше. Поскольку на фоне лечения менструальная реакция у пациентки отсутствовала, исследование может быть выполнено в любой день.
УЗИ в динамике через 6 месяцев на фоне лечения диеногестом 2 мг
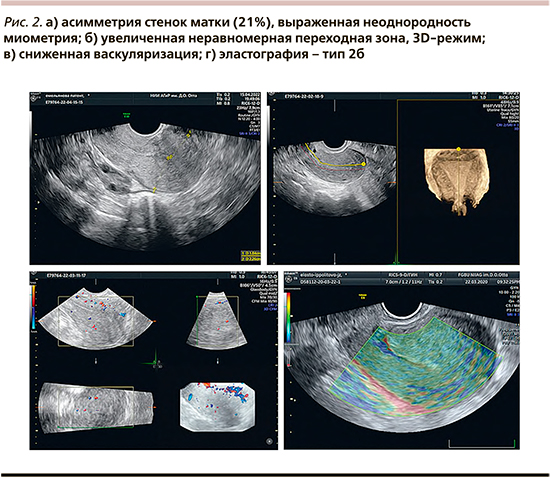
Матка в anteflexio, 65x56x63 мм (объем — 119,2 см3) шаровидной формы, контур ровный. Стенки матки умеренно асимметричные (21%) - 1 балл (рис. 2а). Толщина передней стенки - 18,4 мм, задней стенки - 22,6 мм. Миометрий умеренно диффузно-неоднородной эхоструктуры со множеством мелких гипоэхогенных и гиперэхогенных включений - 1 балл (рис. 2а). Образование в дне матки визуализировать не удается. Переходная зона визуализировалась с трудом, при 3D-реконструкции полости матки составила 1,2-1,0 - 1 балл, симметричность оценить не удается (рис. 2б). При оценке общей васкуляризации матки в 3D Power Doppler Glass Body васкуляризация миометрия была равномерно снижена - не оценивали по баллам (рис. 2в). По эластографии тело матки картировалось зеленым цветом с умеренным количеством синего (тип 2б) - 1 балл (рис. 2г). Участок, где до лечения визуализировали узел аденомиоза, не различался при эластографии по окраске от окружающих тканей.
Эндометрий - 2,2 мм, гиперэхогенный, васкуляризация эндометрия отсутствует, патологические образования не определяются. Полость матки не деформирована без содержимого.
Правый яичник размером 27x15x 18 мм, V - 3,79 см3, расположен типично, содержит 1 фолликул диаметром 4 мм. Строма обычной эхогенности в достаточном объеме.
Левый яичник размером 26x14x 20 мм, V - 3,78 см3, фиксирован у дна матки, фолликулярный аппарат не выражен. Строма обычной эхогенности в достаточном объеме.
Свободная жидкость в малом тазу не определяется.
Заключение по результатам УЗИ: аденомиоз, 4 балла, диффузная форма.
Имеется положительная динамика на фоне лечения аденомиоза на основании клинических проявлений и данных комплексной ультразвуковой оценки миометрия.
Согласно нашим наблюдениям, на фоне лечения аденомиоза диеногестом 2 мг (более 3 месяцев), васкуляризация миометрия значительно снижается, что происходит за счет не выраженности аденомиоза, а гормонального воздействия в процессе лечения. Это затрудняет правильную оценку миометрия, в связи с чем этот критерий на фоне лечения предлагаем не учитывать. По той же причине трудно визуализировать переходную зону, она становится близкой по эхогенности к миометрию, без четких границ, а эндометрий практически отсутствует. Кроме того, мы обратили внимание, что полость матки при реконструкции в 3-мерном режиме у пациенток с выраженным аденомиозом перед началом лечения, как правило, деформирована (рис. 1в), имеет причудливую форму, а после лечения имеет четкую треугольную форму (рис. 2б). С учетом высокой информативности всех критериев, описанных ранее и применяемых для диагностики аденомиоза, возможно проводить динамику изменений и делать выводы об эффективности лечения. В частности, данный клинический пример демонстрирует изменение практически всех ультразвуковых критериев возможных к оценке на фоне лечения, а именно — уменьшение размеров матки, объема (на 31,5 см3, что соответствует 20,9%) и асимметрии стенок матки, снижение неоднородности и уменьшение васкуляризации миометрия; изменение эластографии.
В случае проведения УЗИ впервые по предложенной методике у пациенток, уже находившихся на терапии диеногестом 2 мг, а также агонистами ГнРГ, исходную выраженность процесса оценить достаточно затруднительно, т.к. в каждом отдельно взятом случае ответ на терапию и, соответственно, изменения, происходящие в миометрии, различны и дают различную динамику. В таком случае наиболее информативные характеристики для оценки аденомиоза на фоне медикаментозной терапии — это эхоструктура миометрия, форма матки, симметричность стенок, форма полости матки и эластография.
Возвращаясь к нашему клиническому случаю, после отмены диеногеста 2 мг у пациентки с аденомиозом вторая беременность наступила самостоятельно, протекала с явлениями угрожающего выкидыша при сроке 7/8 и 15/16 недель беременности с госпитализацией в гинекологический стационар и назначением сохраняющей терапии. Беременность закончилась вторыми срочными родами через естественные родовые пути и рождением здорового мальчика массой 3600 г, длиной 51 см.
Заключение
Таким образом, за последнее десятилетие был достигнут значительный прогресс в понимании патогенеза, диагностики и лечении внутреннего эндометриоза. Аденомиоз стал клинической единицей, а не просто гистологическим диагнозом, и его можно идентифицировать с помощью неинвазивных методов визуализации. Тем не менее попрежнему существует острая необходимость в единообразном и общем профиле диагностических критериев и системе отчетности как в визуализации, так и в гистологии, чтобы идентифицировать все клинические и визуализирующие фенотипы аденомиоза. Предложенный нами новый метод комплексной ультразвуковой оценки состояния миометрия создан на основании комбинированного анализа информативных диагностических критериев. Метод доступен и удобен в использовании в рутинной практике, позволяет точно и своевременно устанавливать диагноз, степень выраженности заболевания, проводить дифференциальную диагностику с миомой матки при необходимости, а также оценивать динамику изменений миометрия на фоне проводимой терапии.
Использование патогенетически обоснованной и эффективной медикаментозной терапии аденомиоза, а также индивидуальный подход позволяют устранять клинические проявления заболевания, повышать фертильность и улучшать исходы беременности.
Финансирование. Исследование выполнено в рамках НИР поисковых научных исследований НИОКТР: АААА-А20-120060990051-3.


