Введение
Остеоартрит (ОА) – одна из наиболее частых причин хронического болевого синдрома наряду с болью в нижней части спины и головной болью. Число пациентов, страдающих ОА, постоянно увеличивается в связи со старением населения и нарастанием распространенности ожирения. Боль, обусловленная тяжестью ОА, приводит не только к инвалидизации пациента, ухудшению качества жизни, но и к уменьшает ее продолжительности, являясь значимым предиктором риска смерти [1].
Пациенты с ОА используют различные обезболивающие средства и методы, среди которых несомненным лидером остаются нестероидные противовоспалительные препараты (НПВП). Однако, несмотря на проводимое лечение, от 27 до 61% больных продолжают испытывать хроническую боль (ХБ) и не удовлетворены терапией [2].
Особенности болевого синдрома при остеоартрозе
Основной причиной болевого синдрома при ОА считаются воспалительные и дегенеративные изменения в суставе и околосуставных тканях. Однако обследование и наблюдение за пациентами с ОА в ряде случаев свидетельствуют, что интенсивность боли не всегда коррелирует с деструктивными изменениями [3] и оперативное лечение зачастую не избавляет пациента от болевого синдрома. До 44% пациентов после адекватно выполненного эндопротезирования коленного сустава и до 27% – тазобедренного продолжают испытывать боль [4].
Эти факты можно объяснить тем, что болевой синдром при ОА может иметь смешанный характер, включая признаки ноцицептивной боли и боли при центральной сенситизации (ЦС) [5].
ЦС определяют как усиление нервных сигналов в центральной нервной системе, что обеспечивает гиперчувствительность к боли – иными словами, это гипервозбудимость центральных ноцицепторов, в результате которой снижается их порог возбуждения и они сами начинают генерировать болевые импульсы, становясь источником боли [6, 7]. Впервые ЦС при формировании ХБ была описана C. Woolf в 1983 г. [8]. Длительно существующее в суставе воспаление приводит к гиперчувствительности периферических афферентных нейронов, т.е. формируется периферическая сенситизация [9]. При продолжающейся периферической сенситизации в центральной нервной системе происходят нейропластические изменения и возникает ЦС – главный механизм патогенеза хронического болевого синдрома [3, 10].
ЦС сопровождают следующие феномены: прогрессивное нарастание активности нейронов (феномен взвинчивания – wind-up), при котором нейроны становятся более восприимчивыми к повторяющимся стимулам; повышенная чувствительность к боли в интактных тканях, располагающихся далеко от зоны повреждения (вторичная гипералгезия); возрастание амплитуды и продолжительности нейронного ответа; уменьшение порога возбуждения, когда неболевые в норме стимулы активируют ноцицепторы (аллодиния) [11, 12].
Классическим примером ЦС служит фибромиалгия – заболевание, при котором нет ни воспаления, ни поражения суставов [13], а причиной является дисфункция болевой системы. Согласно данным последних исследований, явления ЦС могут встречаться не только при фибромиалгиях, но и при мигрени, боли в шее, тазовой боли, синдроме хронической усталости и др., а также при ревматических заболеваниях [14–17].
В результате хронического воспаления в суставе и его деструкции возбуждаются периферические болевые рецепторы и болевые импульсы по периферическим нервам передаются в задние рога спинного мозга. Они находятся под контролем противоболевых (антиноцицептивных) систем, деятельность которых направлена на модуляцию боли. При условии продолжающегося возбуждения, в данном случае воспаления в суставе, и слабости антиноцицептивных систем возникает ЦС.
По сравнению с ноцицептивной ХБ пациенты с ЦС сообщают о более интенсивном болевом синдроме, большем его влиянии на качество жизни, более выраженном нарушении функциональной активности, депрессии и тревоге [18].
Причины возникновения ЦС до сих пор не установлены, но можно обсуждать генетические и внешние средовые факторы. Если у пациента есть ЦС, то в клинической картине может наблюдаться быстрый переход в ХБ и недостаточный ответ на лечение [19, 20].
ЦС в спинальных и супраспинальных болевых нейронах изменяет клинические характеристики болевого синдрома. Появляются нейропатические симптомы (жжение, покалывание, онемение, прострелы током и др.), которые в отличие от собственно нейропатической боли локализуются в анатомически нелогичных зонах, т.е. топически не соответствуют какому-либо поражению соматосенсорной нервной системы. При ОА ЦС по опроснику Pain DETECT встречается у 28–30% пациентов [21–24], нейропатические характеристики боли при описании своих жалоб используют до 34% больных [25].
Наличие ЦС у пациентов с ОА подтверждается значительно более низким порогом боли на давление по сравнению со здоровой контрольной группой.
В исследовании M. Imamura et al. [26] для определения состояния нервной системы у 62 женщин с ОА коленного сустава оценивались пороги боли на давление в мышцах, связках, сухожилиях и коже нижней конечности. Было показано, что у всех больных ОА отмечались достоверно более низкие пороги боли на давление. Такое снижение коррелировало с высокой интенсивностью боли, низким качеством жизни, низкой функциональной активностью и нетрудоспособностью.
В другой работе L. Arendt-Nielsen et al. [27] производили оценку ЦС при помощи измерения порогов боли на давление (в области сустава и в отдаленной точке) у 48 женщин с ОА коленного сустава и у 24 здоровых женщин. Были выявлены достоверно более низкие пороги боли на давление у больных ОА как в области сустава, так и в отдаленной точке. Была показана обратная корреляция между значениями интенсивности боли и средними показателями порогов боли на давление в отдаленной точке.
Патогенетическая терапия наиболее эффективна при лечении ХБ. Оказывая противовоспалительное действие в области пораженного сустава, НПВП способны уменьшать ноцицептивную импульсацию. Однако их прием сопряжен с высоким риском развития нежелательных явлений со стороны как желудочно-кишечного тракта, так и сердечно-сосудистой системы. Таким образом, пациентам с тяжелой сопутствующей патологией необходим подбор противоболевой терапии с учетом их анамнеза. Ноцицептивные импульсы с периферии играют важную роль в клинической картине ХБ, однако фармакологические средства периферического действия не способны уменьшать ЦС. Только препараты центрального действия могут воздействовать на процессы, вовлеченные в ЦС, поэтому наряду с традиционной терапией пациентам с признаками ЦС следует назначать комплексное лечение, включающее также препараты центрального действия.
Опиоидный анальгетик тапентадол PR
Новый сильнодействующий анальгетик центрального действия тапентадол PR, обладающий двойным механизмом действия, связывается с мю-опиоидными рецепторами, а также ингибирует обратный захват норадреналина (НА) [28].
Мю-рецепторы, самый изученный тип опиоидных рецепторов, локализуются в нервной системе, а также в желудочно-кишечном тракте и других тканях. Среди регулируемых ими функций следует отметить ноцицепцию, дыхание, память, обучение, секрецию нейрогормонов, сократительную активность кишечника и др. При активации опиоидных рецепторов закрываются потенциал-зависимые ионные кальциевые каналы в пресинаптических нейронах и снижается выброс возбуждающих медиаторов, например глутамата, а активация калиевых каналов в постсинаптических нейронах приводит к гиперполяризации мембран, что уменьшает чувствительность нейронов к возбуждающим нейромедиаторам и таким образом уменьшается передача болевых импульсов [29].
НА является ключевым нейротрансмиттером в нисходящих антиноцицептивных путях. Путем ингибирования обратного захвата НА после его высвобождения в синапсах тапентадол увеличивает уровень этого нейротрансмиттера, активируя рецепторы α2. Эта повышенная активация рецепторов приводит к подавлению передачи боли через нейроны второго порядка. Ингибирование обратного захвата НА служит дополнением к воздействию тапентадола на мю-опиоидные рецепторы и усиливает его анальгетическую эффективность [30, 31].
Тапентадол принципиально отличается от своего предшественника трамадола: молекула является активным веществом, у тапентадола нет активных метаболитов, основным механизмом метаболизма является глюкуронизация, тапентадол в 50 раз слабее морфина (трамадол – в 6000 раз), препарат блокирует обратный захват НА, но не серотонина [32, 33].
Тапентадол назначают пациентам с сильной и очень сильной болью. Доза подбирается индивидуально в соответствии с выраженностью болевого синдрома, ранее проводимой терапией (отсутствие эффекта от НПВП) и возможностью наблюдения за пациентом. Тапентадол PR (пролонгированного действия) следует принимать дважды в сутки независимо от приема пищи. Таблетку необходимо принимать внутрь с достаточным количеством жидкости не разжевывая, не разламывая и не растворяя. Пациенты, не принимавшие ранее наркотических анальгетиков, начинают терапию с дозы 50 мг 2 раза в сутки с последующим титрованием при необходимости. Имеющийся опыт свидетельствует, что режим подбора дозы тапентадола с увеличением на 100 мг в сутки каждые 3 дня большинству пациентов оказывается достаточным для достижения адекватного контроля боли [34].
Эффективность тапентадола была исследована на пациентах с болевой формой диабетической полинейропатии [35]. В исследовании приняли участие 588 пациентов с полинейропатией, не удовлетворенных ранее проведенной противоболевой терапией опиоидными или неопиодными анальгетиками в течение 3 месяцев, с сохраняющейся интенсивностью боли минимум 5 баллов по 11-балльной числовой школе оценки боли NRS (Numeric rating Scale for pain). Все больные в течение 3 недель получали тапентадол с титрацией оптимальной индивидуальной дозы до 100–250 мг в сутки. Те пациенты, у которых отмечалось уменьшение интенсивности боли хотя бы на 1 балл (n=395), были далее разделены на две группы. Одна группа пациентов получала плацебо, вторая – оптимальную фиксированную дозу тапентадола в течение 12 недель.
Эффективность тапентадола также изучалась при лечении нейропатического компонента боли у пациентов с ХБ в спине в комбинации с антиконвульсантом прегабалином. Монотерапия тапентадолом в дозе 500 мг/сут (n=152) сравнивалась с комплексной терапией прегабалином 300 мг/сут и тапентадолом 300 мг/сут (n=136). В обеих группах наблюдали выраженное уменьшение показателей нейропатической боли. Вторичная оценка эффективности лечения по шкалам SF-12 и EQ-5D выявила сходную положительную динамику как при монотерапии тапентадолом, так и при комбинированной терапии тапентадолом/прегабалином. Однако случаи тошноты и сонливости отмечались значительно чаще у пациентов на комбинированной терапии [36].
Применение тапентадола PR при остеоартрозе
Эффективность тапентадола PR в лечении пациентов с ОА была оценена в нескольких исследованиях (см. таблицу).
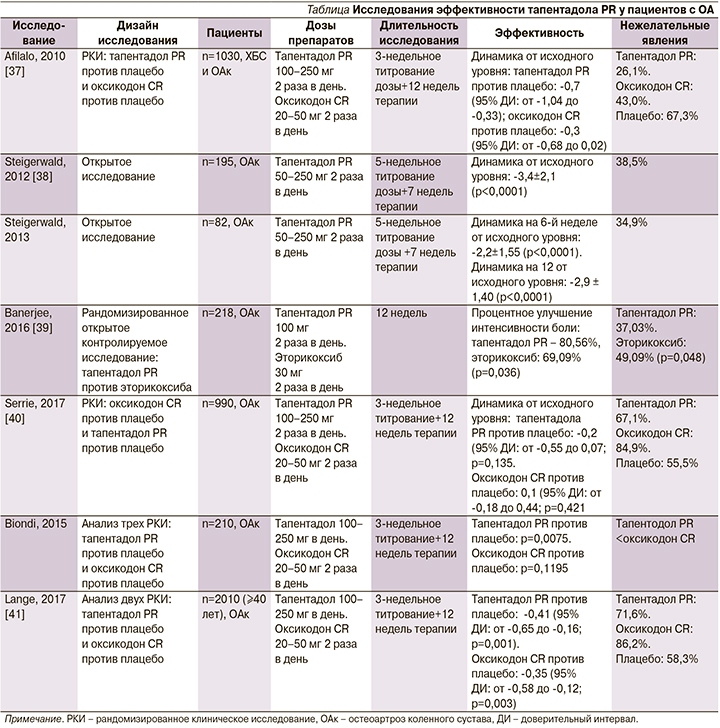
В рандомизированном двойном слепом плацебо-контролируемом многоцентровом исследовании M. Afilalo et al. [37] оценивали сравнительную эффективность тапентадола PR, оксикодона и плацебо для пациентов с ОА в течение 3-недельного периода титрования с последующим 12-недельным периодом терапии и наблюдения. 1030 пациентов с ХБ в колене, обусловленной ОА, были рандомизированы для получения тапентадола 100–250 мг 2 раза в день, оксикодона 20–50 мг 2 раза в день или плацебо. В группе тапентадола отмечен значительно более высокий процент пациентов, достигших уменьшения интенсивности боли на ≥50% (32,0% [110/344]), по сравнению с плацебо (24,3% [82/337]; р=0.027), в то время как в группе оксикодона этот процент был существенно ниже (17,3% [59/342]; р=0,023). Нежелательные побочные явления со стороны желудочно-кишечного тракта отмечены у 26,1% пациентов в группе плацебо, 43,0% – на фоне терапии тапентадолом и у 67,3% больных, получавших оксикодон.
I. Steigerwald et al. [38] изучали эффективность и переносимость тапентадола PR 195 пациентами с выраженной ХБ при ОА, которую ранее купировали с помощью различных НПВП. Период наблюдения включил 5-недельный период титрования тапентадола (50–250 мг 2 раза в день) с последующей 7-недельной терапией. Динамика интенсивности боли от исходного уровня составила -3,4±2,10 (р<0,0001). Нежелательные явления выявлены у 38,5% пациентов.
В сравнительном рандомизированном контролируемом открытом исследовании М. Banerjee et al. [39] пациенты с ОА получали тапентадол PR (100 мг 2 раза в день; n=108) либо эторикоксиб (30 мг 2 раза в день; n=110) в течение 12 недель. Устойчивое улучшение было отмечено в виде снижения интенсивности боли по визуальной аналоговой шкале и индексу WOMAC в обеих группах. Однако в конце исследования в группе, принимавшей тапентадол, большее число пациентов сообщили об удовлетворительном ответе (р=0,036). Нежелательные явления в группе с опиодным анальгетиком отмечались реже, чем с НПВП (37,03 против 49,09%). А. Serrie et al. также провели рандомизированное исследование по оценке эффективности и безопасности тапентадола PR (100–250 мг 2 раза в день) и оксикодона (20–50 мг 2 раза в день) для больных ОА по сравнению с плацебо. В работе, включившей 990 пациентов, установлено, что ни тапентадол, ни оксикодон не привели к значительному снижению интенсивности боли по сравнению с плацебо после 3-недельного титрования и 12 недель лечения. Однако общее состояние здоровья пациентов, получавших тапентадол, было лучше, чем у больных, получавших оксикодон; процент пациентов, завершивших исследование в группе с тапентадолом, было выше, чем с оксикодоном (56 против 42,5%). Также тапентадол продемонстрировал лучший профиль переносимости: отмечена меньшая частота возникновения запоров (17,9 против 35%) и сочетания тошноты/рвоты (23,8 против 46,8%) [40].
Объединенный анализ двух рандомизированных двойных слепых плацебо-контролируемых исследований, проведенных B. Lange et al., позволил предположить, что тапентадол PR превосходит оксикодон в обезболивании и улучшении общего состояния здоровья пациентов с ХБ при ОА средней и высокой степеней тяжести. Оба исследования состояли из 3-недельного титрования и 12-недельной терапии; пациенты были рандомизированы в группы тапентадола PR (100–250 мг 2 раза в день), оксикодона CR (20–50 мг 2 раза в день) и плацебо. Лечение тапентадолом привело к более значительному снижению средней интенсивности боли по сравнению с оксикодоном как после 12 недель лечения (среднее различие -0,41 [95% ДИ: от -0,65 до -0,16]; р=0,001), так и в течение периода поддерживающей терапии (-0,35 [95% ДИ: от -0,58 до -0,12]; р=0,003). Общее состояние пациентов в группе тапентадола по шкале SF-36 и индексу качества жизни EQ-5D также было значительно выше, чем в группе оксикодона (p<0,001). При лечении тапентадолом реже отмечались нежелательные побочные явления (рвота, запоры, тошнота, сонливость и зуд), а также меньше случаев прекращения лечения (42,2 против 64% для оксикодона) [41].
Тапентадол PR также используют для обезболивания после эндопротезирования сустава. C. Hartrick et al. оценили эффективность и переносимость тапентадола и оксикодона со стороны 659 пациентов с ОА коленных суставов, нуждавшихся в оперативном лечении. Значительное снижение интенсивности боли по сравнению с плацебо на 2-е, 5-е и 10-е сутки после операции отмечено при приеме тапентадола в дозе 50 или 75 мг/сут и оксикодона в дозе 10 мг/сут. Частота желудочно-кишечных осложнений была значительно ниже у лиц, принимавших тапентадол в обеих дозировках, по сравнению с оксикодоном. Частота прекращения лечения на фоне терапии тапентадолом в дозе 50 мг составила 18%, в дозе 75 мг – 26%, в группе оксикодона – 35 против 10% в группе плацебо [42].
L. Panella et al. провели сравнение обезболивающего действия и переносимости тапентадола PR 50–150 мг 2 раза в сутки с парацетамолом в дозе 1000 мг/сут у пациентов в реабилитационном периоде после эндопротезирования коленного сустава с интенсивностью боли >6 баллов по NRS. Было показано более быстрое нарастание объема движений, улучшение качества сна и уменьшение интенсивности боли на фоне терапии опиоидным анальгетиком [43].
Важным аспектом выбора опиоидного анальгетика является не только выраженность обезболивающего действия, но и его переносимость. Известно, что при использовании препаратов данной группы нередко возникают нежелательные явления из-за воздействия на мю-опиоидные рецепторы, широко представленные в различных органах и тканях. Среди них выделяют желудочно-кишечные (тошнота, запоры), кардиоваскулярные (артериальная гипертензия), легочные (угнетение дыхания), эндокринные (снижение потенции) и психические эффекты, нежелательное влияние на вождение автомобиля, а также риск злоупотребления. Двойной механизм действия тапентадола в значительной степени снижает риск развития нежелательных явлений, т.к. воздействие препарата на мю-опиоидные рецепты на 40% ниже, чем у остальных опиоидов. Таким образом, выраженное обезболивающее действие и хорошая переносимость – важные преимущества препарата среди других опиоидных анальгетиков.
Риск возникновения лекарственной зависимости – также существенный фактор, ограничивающий использование опиоидных анальгетиков пациентами с хроническим болевым синдромом. В 2012 г. была исследована частота возникновения злоупотребления при лечении пациентов тапентадолом PR, оксикодоном, гидрокодоном и трамадолом, показавшая наиболее редкое развитие зависимости при применении первого из них [44, 45].
Заключение
ОА является широко распространенным заболеванием среди лиц пожилого возраста. Эффективный контроль боли имеет решающее значение в улучшении качества жизни пациентов. Выбор эффективной терапии болевого синдрома при ОА должен определяться как интенсивностью боли, так и ее патогенезом, т.е. лекарственный препарат должен воздействовать как на ноцицептивный механизм, так и на ЦС.
Механизм двойного действия тапентадола позволяет использовать его в качестве патогенетической терапии выраженной боли у пациентов с ОА. Хорошая переносимость и высокая эффективность позволяют рекомендовать тапентадол PR пациентам пожилого возраста для консервативного лечения ОА при наличии противопоказаний или недостаточной эффективности НПВП, а также в качестве терапии постоперационной боли больным, перенесшим эндопротезирование сустава, и в рамках реабилитации.



