Рак шейки матки (РШМ) – наиболее распространенная злокачественная опухоль в мире и вторая по частоте смерти среди женщин. В Европе РШМ ежегодно заболевают около 60 тыс. и от него умирают до 30 тыс. женщин, в России – 18 тыс. и около 6000 соответственно. РШМ – высококурабельное заболевание: на ранних стадиях при небольших изменениях достаточной в первичном лечении является хирургия или лучевая терапия, при местнораспространенном процессе (≥IB2-стадии) с конца 1990-х гг. стандартом лечения становится химиолучевая терапия, а комбинированное лечение с включением неоадъювантной химиотерапии (ХТ) дискутируется до настоящего времени. При рецидивах заболевания и первоначально распространенном опухолевом процессе рассматривается возможность проведения паллиативной лекарственной терапии (ХТ/таргетная терапия/иммунотерапия).
Химиотерапия
Монотерапия
Различные цитостатики продемонстрировали эффективность при распространенном и рецидивирующем РШМ (табл. 1). Однако длительность ответа при их применении, к сожалению, не превышает нескольких месяцев.
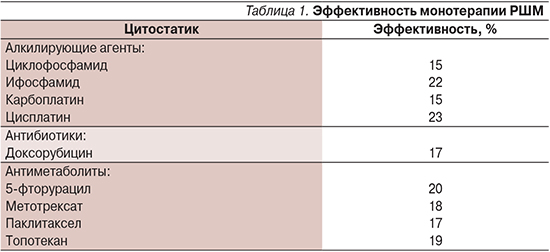
В настоящее время наиболее широко используется режим монотерапии цисплатином в дозе 50 мг/м2 каждый 21-й день. Более высокие дозы ассоциируются с большими миелосупрессией и нефротоксичностью без увеличения беспрогрессивной (БПВ) и общей выживаемости (ОВ) [1].
Полихимиотерапия
В табл. 2 представлены результаты четырех рандомизированных исследований III фазы по сравнению монотерапии цисплатином с дуплетами цисплатина с другими цитостатиками.
В исследовании GOG-169 сравнение проведено между цисплатином 50 мг/м2 и дуплетом цисплатин+паклитаксел 135 мг/м2 каждые 21-й день в течение 6 циклов. Результаты применения дуплета были выше как по БПВ, так и по ОВ. При этом оценка качества жизни после четвертого цикла не выявила существенных различий в двух группах при лучших ответах на комбинированную ХТ.
В оригинальном исследовании GOG-179 было три «рукава»: 1) цисплатин 50 мг/м2 каждый 21-й день; 2) цисплатин 50 мг/м2 в 1-й день+топотекан 0,75 мг/м2 в 1-й и 3-й дни с интервалом 21 день; 3) метотрексат 30 мг/м2 в 1-й, 15-й и 22-й дни+винбластин 3 мг/м2 во 2-й, 15-й и 22-й дни+доксорубицин 30 мг/м2 во 2-й день+цисплатин 70 мг/м2 во 2-й день с интервалом 4 недели (MVAC). Однако режим MVAC был вскоре закрыт из-за четырех летальных исходов. В оставшихся двух группах отмечены значительные преимущества комбинированной ХТ по ОВ, БПВ и общим ответам, но с большим числом случаев миелосупрессии 3-й и 4-й степеней.
Значительный эффект комбинированной ХТ в GOG-169 и GOG-179 лег в основу GOG-204. Пациентки были рандомизированы на 4 дуплета: цисплатин 50 мг/м2 с паклитакселом 135 мг/м2 каждый 21-й лень; c винорельбином 30 мг/м2 в 1-й и 8-й дни с интервалом 21 день; с гемцитабином 1000 мг/м2 в 1-й и 8-й дни с интервалом 21 день; с топотеканом 0,75 мг/м2 в 1–3-й дни с интервалом 21 день. Все четыре платиновых дуплета показали одинаковые результаты по ОВ. Тренды в БПВ, ОВ и общих ответах были лучше при комбинации цисплатин+паклитаксел, но с большим риском нейропатии в данном дуплете [2].
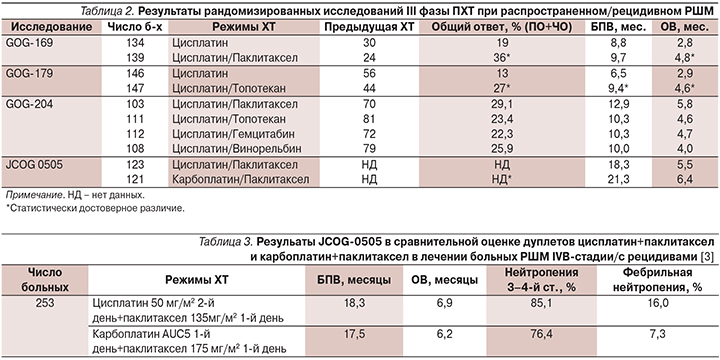
В японском исследовании JCOG-0505 изучалась возможность замещения цисплатина карбоплатином. Обе схемы оказались эквивалентными по БПВ и ОВ [3] (табл. 3).
Таким образом, представленные результаты рандомизированных исследований по паллиативной ХТ РШМ, во-первых, выявили преимущества полихимиотерапии платиновыми дуплетами по сравнению с монотерапией цисплатином; во-вторых, не было получено различий в вариантах дуплетов по продолжительности жизни (с паклитакселом, топотеканом, винорельбином, гемцитабином). Но тенденция к более выраженному объективному ответу и увеличению медианы времени до прогрессирования позволила стать режиму цисплатин+паклитаксел комбинацией выбора для лечения этой категории больных с возможностью замены цисплатина на карбоплатин больным почечной недостаточностью.
Стандартов ХТ 2–3-й линий не существует. Предлагаются режимы: митомицин 7,5 мг/м2 1 раз в 6 недель, иринотекан 125 мг/м2 в 1-й, 8-й, 15-й дни каждые 3 недели, гемцитабин 1000 мг/м2 в 1-й, 8-й, 15-й дни каждые 3 недели, доцетаксел 75 мг/м2 в 1-й день каждые 3 недели, капецитабин 2500 мг/м2 в 1–14-й дни каждые 3 недели [4].
Таргетная терапия
В лечении метастатического РШМ изучаются различные молекулярные таргетные агенты, включая ингибиторы ангиогенеза, тирозинкиназы, эпидермального фактора роста (бевацизумаб, цетуксимаб, гефитиниб, пазопаниб, эрлотиниб, лапатиниб, сунитиниб). Однако на сегодня большинство из них в клинических исследованиях II фазы не продемонстрировали значительной активности за исключением бевацизумаба, который в дальнейшем показал обнадеживающие результаты в рандомизированном исследовании III фазы GOG-240.
Бевацизумаб – гуманизированное моноклональное антитело, прицельно блокирующее сосудистый эндотелиальный фактор роста (VEGF), являющийся ключевым фактором неоангиогенеза, который приводит к росту и метастазированию опухоли.
В клиническое исследованиие II фазы GOG-227C были включены 46 больных РШМ после 2–3-й линий терапии при рецидивах. Частичный ответ был достигнут у 10,9%, стабилизация – у 24% пациенток, медиана БПВ составила 3,4 месяца, что было сопоставимо с результатами исследований GOG по эффективности цитостатиков. Лечение бевацизумабом в дозе 15 мг/кг каждый 21-й день не ассоциировалось с гематологическими осложениями, был зарегистрирован один случай пузырно-влагалищного свища [5]. Второе иссследование II фазы (26 больных) оценивало комбинацию бевацизумаба в том же режиме с цитостатиками: топотеканом 0,75 мг/м2 в 1-й, 2-й дни и цисплатином 50 мг/м2 в 1-й день. Среднее число циклов составило 3 (1–19).
Гематологическая токсичность за счет цитостатиков была значительно выше, что потребовало 78%-ного переливания кровезаменителей; зарегистрированы один ректо-вагинальный и один пузырно-влагалищный свищи. Несмотря на токсичность терапии, общий ответ был достигнут 38% пациенток, медиана БПВ составила 7,1 месяца, ОВ – 13,2 месяца [6].
Отмеченные обнадеживающие результаты применения бевацизумаба в монорежиме и в комбинации с ХТ инициировали рандомизированное исследование III фазы GOG-240, включившее 452 пациентки. Рассматривалось два вопроса: 1) эффективность комбинированной платиновой (цисплатин 50 мг/м2+паклитаксел 135 или 175 мг/м2) и комбинированной неплатиновой терапии (топотекан 0,75 мг/м2 1–3-й дни+паклитаксел 135 мг/м2); 2) эффективность добавления бевацизумаба 15 мг/кг каждый 21-й день к обоим вариантам комбинированной ХТ.
Оценка эффективности двух вариантов ХТ показала несколько лучшие результаты платиновой комбинированной ХТ (цисплатин+паклитаксел) по сравнению с неплатиновой комбинацией (паклитаксел+топотекан).
При оценке эффективности добавления бевацизумаба к общей группе ХТ выявлено статистически значимое увеличение ОВ – с 13,3 до 17,0 (р=0,004) и БПВ – с 5,9 до 8,2 месяца (р=0,002; табл. 4) [7].

Комбинации бевацизумаба с ХТ в целом хорошо переносились больными, но их применение сопровождалось рядом побочных явлений, наиболее частым из которых была артериальная гипертензия (до 25%), а также редкими серьезными осложнениями с летальными исходами в четырех случаях. Однако в группе без бевацизумаба также было зарегистрировано четыре летальных исхода.
В исследовании GOG-240 проведен опрос пациентов в отношении качества жизни (QOL) по анкетам FACT-Cx, который не показал значительного ухудшения качества жизни при добавлении бевацизумаба к ХТ на протяжении лечения.
Таким образом, на основании результатов рандомизированного исследования GOG-240 дуплеты цисплатин 50 мг/м2 в 1-й день+паклитаксел 135 или 175 мг/м2 в 1-й день или топотекан 0,75 мг/м2 в 1-3-й дни+паклитаксел 135 мг/м2 с добавлением бевацизумаба 15 мг/кг каждый 21-й день становятся стандартом в лечении метастатического и рецидивного РШМ. Широкое внедрение в России данного режима стандартной терапии некоторое время было затрудено из-за высокой стоимости бевацизумаба. Ситуация изменилась после появления в России его биоаналога в 2015 г. Стоимость 1 месяца лечения бевацизумабом для больных РШМ при использовании биоаналога снизилась в 4,5 раза: с 273 тыс. в 2015 г. до 60 тыс. руб. в 2017 г. [8].
Иммуномодулирующая терапия
Поскольку практически все раковые заболевания шейки матки и их прогрессирование связаны с высокой частотой заражения вирусом папилломы человека (ВПЧ), можно предположить, что воздействие на вирусные белки может вызывать сильные противоопухолевые иммунные ответы. В нескольких японских исследованиях выявлен положительный эффект по показателям ОВ и БПВ при добавлении к лучевой терапии местнораспространенного РШМ таких иммуномодуляторов, как термически инактивированные Lactobacillus casei и Z-100-экстракт из микобактерий туберкулеза человеческого типа [9–10].
Терапевтические ВПЧ-вакцины
Терапевтическая вакцина против ВПЧ участвует в устранении предшествовавших поражений, создавая клеточно-опосредованный иммунитет против инфицированных ВПЧ-клеток. Задачи данной вакцины: нацелить антиген-представляющие клетки, чтобы вызвать сильный иммунный ответ и убить инфицированные ВПЧ клетки. Действие терапии основано на взаимодействии Т-клеток с белками ВПЧ-E6 и -E7.
Разработка терапевтического препарата базируется на создании векторных вакцин – (бактериальных или вирусных), пептидных и протеиновых, нуклеиновых и клеточных. Препараты с нуклеиновой кислотой включают вакцины на основе ДНК, которые увеличивают популяции дендритных клеток (экспрессирующих антиген) и усиливают экспрессию, обработку и представление антигена в данных клетках, как и вакцины с РНК.
Препятствием для создания эффективной терапевтической вакцины против ВПЧ при РШМ служит отсутствие клинического ответа на любой из существующих курсов лечения. Большинство исследований проведено в отношении выраженной дисплазии шейки матки (HSIL), и эффективность воздействия было трудно оценивать, т.к. основной метод лечения HSIL хирургический, косвенными показателями служили иммунологические и клинические ответы.
Несколько клинических исследований по вакцинотерапии инвазивного РШМ на поздних стадиях пока продемонстрировали скромные, но обнадеживающие результаты, что требует продолжения изучения данного вида терапии [11–16].



