Введение
Контагиозный моллюск – одно из самых распространенных заболеваний кожи и слизистых детей и подростков [1], реже встречающееся у взрослых и протекающее с образованием мелких полушаровидных папул с пупковидным вдавлением в центре. Заболевание обусловлено эпидермотропным вирусом (Molluscum contagiosum virus), который относится к семейству оспенных вирусов (Poxviridae). При исследовании генотипа этого вируса было выявлено четыре типа MCV-1–4, наиболее часто из которых встречается I тип. Последний вызывает 96,6% инфекций. На долю вируса II типа приходятся 3,4% случаев заболеваний, однако не было обнаружено взаимосвязи между типом вируса и морфологией поражения или анатомическим распределением высыпаний [1]. Вирусы III и IV типов встречаются редко и чаще верифицируются у пациентов с иммуннодефицитными состояниями [2].
Контагиозный моллюск редко встречается у детей моложе 1 года, основной же пик заболеваемости приходится на возраст от 2 до 5 лет и связан со случайными прямыми контактами с больными детьми либо передачей инфекции опосредованно через игрушки или предметы обихода. Способ заражения подростков объясняется активностью сексуальных контактов [3, 4]. Мужчины болеют несколько чаще, чем женщины. Распространенность данного заболевания изучена мало, но в последние годы отмечается рост заболеваемости не только в России, но и во многих странах Европы и Америки [5]. При этом выявлено, что у людей с иммуннодефицитными состояниями высыпания более обильные, а заболеваемость гораздо выше. Установлено, что порядка 5–18% всех больных с иммунодефицитом подвержены этому вирусу, а тяжесть инфекции обратно пропорциональна количеству лимфоцитов CD4 [6]. У пациентов с различными хроническими заболеваниями кожи, сопровождающимися сухостью (например, атопический дерматит и экзема), вирус контагиозного моллюска активизируется, иногда вызывая генерализацию процесса [5]. Более развернутая клиническая картина по количеству высыпных элементов, площади пораженной кожи и устойчивости инфекции также отмечается у пациентов, получающих преднизон и метотрексат. Кроме того, описаны случаи активизации вируса в виде диссеминации контагиозного моллюска при лечении экземы, атопического дерматита, витилиго мазью такролимус 1% [7, 8].
Возбудитель передается опосредованным путем через постельное и нательное белье, полотенца, посуду, игрушки, мочалки, при контактных видах спорта, массаже, посещении бассейна, принятии общих ванн, либо прямым контактным способом во время половых контактов взрослых и подростков [1, 9, 10]. Инкубационный период обычно составляет 2–7 недель, но может удлиняться до 6 месяцев. Это связано с тем, что, хотя вирусные частицы первично локализуются в базальном слое, репликация вирусной ДНК и образование новых вирусных частиц не происходят до тех пор, пока не будут задействованы шиповатый и зернистый слои эпидермиса. Вирус контагиозного моллюска не имеет латентного периода и не существует в организме постоянно как вирус герпеса. Для отсутствия формирования стойкого иммунного ответа важно то, что он вырабатывает вирус-специфические белки, которые помогают ему избегать агрессии со стороны иммунной системы. Таким образом, если после излечения у пациента снова появились очаги контагиозного моллюска, значит, он снова вступил в контакт с инфицированным человеком или объектом.
Высыпания можно обнаружить на любом участке кожи, но у детей очаги контагиозного моллюска обычно возникают на груди, руках, туловище, ногах и лице. Множественные элементы также могут развиваться в подмышечных и паховых областях. Крайне редко встречаются единичные элементы на слизистых оболочках губ, век, языка и слизистой рта. У взрослых контагиозный моллюск чаще всего ограничен областями промежности, гениталий, нижней части живота или ягодиц.
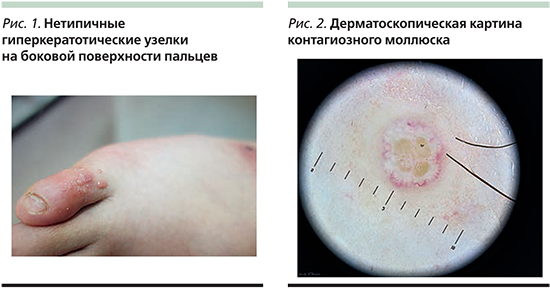
Клинически на неизмененной коже выявляются изолированные полушаровидные с жемчужным блеском узелки величиной от 1–3 до 5–10 мм в диаметре, имеющие цвет нормальной кожи или бледно-розовый, чаще всего располагающиеся группами, но могут встречаться и в виде единичного элемента. В центре некоторых элементов наблюдается пупкообразное вдавление, заполненное роговыми массами. При вскрытии и надавливании из центрального углубления выделяется белесое вещество творожистой консистенции, состоящее из ороговевших клеток эпидермиса и овоидных телец. Как правило, высыпания не беспокоят, но иногда они могут сопровождаться зудом, экзематозной реакцией и за счет травмы начинают появляться новые очаги, что ведет к распространению заболевания. В клинической практике надо также учитывать, что у 10% пациентов с контагиозным моллюском встречаются атипичные высыпания, например, на тыльной или боковой поверхностях стоп и кистей, они чаще всего выглядят как сухие гиперкератотические узелки (рис. 1), а в ряде случаев в нижней трети лица и на шее могут имитировать акнеформные элементы.
Пока элементы существуют на коже, пациент считается заразным для окружающих. Появление выраженной воспалительной реакции отдельных элементов может говорить о последующей элиминации вируса или же о его травматизации и последующем распространении. Как правило, процесс протекает без осложнений заболевания, но иногда могут быть такие, как присоединение бактериальной инфекции (требует назначения антибактериальных препаратов), рубцевание (чаще встречается при постоянной травматизации ряда элементов или после недостаточно корректного удаления элементов), конъюнктивит или кератит (при наличии элементов на лице в области глаз). В последнем случае пациенты могут ощущать боль, отмечать покраснение и отечность, а также болезненность, слезотечение и светочувствительность глаз. Еще одно редкое осложнение контагиозного моллюска – рожистое воспаление – встречается у пациентов, инфицированных вирусом иммунодефицита человека [11]. Диагноз контагиозного моллюска чаще всего устанавливается при простом осмотре кожных покровов, иногда приходится прибегать к дерматоскопии образований, в ряде случаев проводят микроскопию или даже гистологическое исследование элементов.
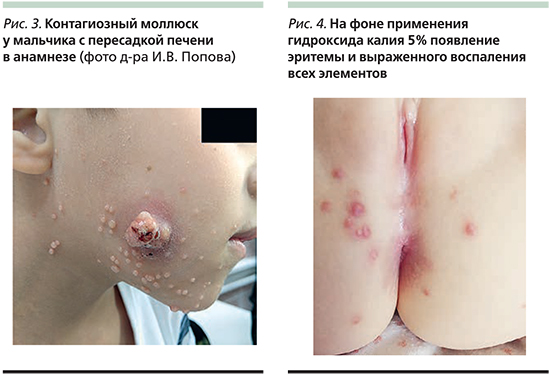
При дерматоскопии контагиозного моллюска можно выявить следующие особенности (рис. 2):
- папула с углублением в центральной области, в которой также могут наблюдаться оранжевые или желтоватые роговые массы;
- гомогенные белесовато-розовые глобулы в центральной области (при сильном нажатии белые);
- множественные линейные или извитые сосуды по периферии очага.
Дифференциальный диагноз проводят с бородавками, папилломами, ветряной оспой, эпидермальной кистой, гиперплазией сальной железы, дерматофибромами, бородавчатым красным плоским лишаем, пиогенной гранулемой, в редких случаях – с раком кожи.
Лечение
Терапевтические возможности лечения контагиозного моллюска включают применение различных наружных средств, механические способы, электрокоагуляцию, крио- или лазерное удаление, пероральные лекарственные средства. Но часто одного сеанса терапии не хватает из-за недостаточной активности препаратов, рецидива или появления новых элементов.
Консервативное лечение с применением различных кремов, мазей, растворов (имиквимод, ретиноиды, 5–10%-ные растворы гидроксида калия и др.) не всегда эффективны и зачастую помогают только при единичных или маленьких вновь появившихся элементах. Спонтанное излечение наблюдается чрезвычайно редко (при единичных элементах) и происходит в период до 18 месяцев после появления, описаны единичные случаи саморазрешения элементов в течение 4 лет.
В большинстве случаев родители детей выбирают выжидательную тактику и не лечат контагиозный моллюск, что чаще всего приводит к распространению элементов и заражению других людей, находящихся в окружении. Выжидательная тактика особенно опасна для людей с различными иммуннодефицитными состояниями, т.к. упущенное время может приводить к масштабному распространению процесса с последующей необходимостью применения общего наркоза для удаления элементов [11]. В некоторых случаях специалисты предлагают при лечении совмещать несколько способов, т.к. не всегда представляется возможным очистить кожу от контагиозного моллюска, применяя только один метод лечения [12].
Наиболее подходящий терапевтический подход во многом зависит от клинической ситуации и распространенности контагиозного моллюска. Для здоровых детей основная цель – ограничить дискомфорт, травматизацию и привести к ограничению распространения. Для взрослых, чаще всего готовых к лечению, эффективны криотерапия, электрокоагуляция или кюретаж отдельных элементов, и они их хорошо переносят.
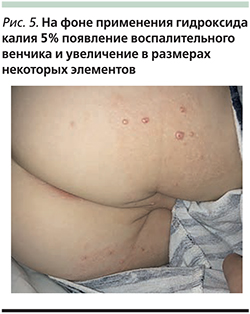
У лиц с ослабленным иммунитетом высыпания при контагиозном моллюске могут быть весьма обширными и трудно поддающимися лечению (рис. 3). Цель может заключаться в лечении самых больших, раздраженных или сливающихся высыпаний. В тяжелых случаях этим пациентам могут потребоваться более агрессивная деструкция лазером, противовирусная терапия или их комбинация [13]. Эффективная антиретровирусная терапия пациентов с синдромом приобретенного иммунодефицита делает терапию контагиозного моллюска намного более эффективной.
Топические препараты, используемые в терапии заболевания, перечислены ниже.
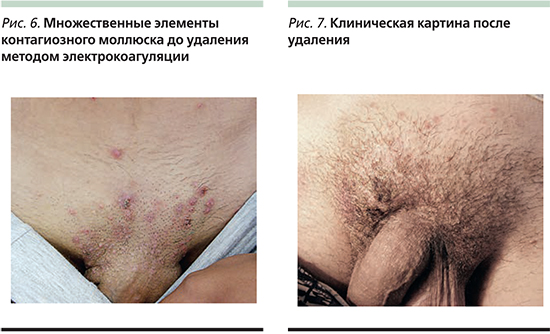
Гидроксид калия (Молютрекс 5%, Молюсдерм 10%) – средство в виде раствора. Применяется местно для лечения контагиозного моллюска, разрушает клетки кожи, инфицированные вирусом, позволяя выработать адекватный иммунный ответ. Раствор наносят 2 раза в день на каждый элемент, добиваясь появления признаков воспаления и разрешения очагов после этого в течение нескольких недель. Обработку прерывают на несколько недель сразу при появлении воспаления (рис. 4, 5). Если при применении в течение 14 дней признаков воспаления нет, стоит делать перерыв и препарат не использовать. К побочным эффектам данных препаратов относят легкое жжение, покраснение, зуд, которые обычно уходят через несколько минут после нанесения лекарства на кожу [14, 15]. В Кокрановской базе данных опубликован обзор результатов исследования, в которых изучалось влияние нескольких наружных, системных и гомеопатических средств [16]. Среди полученных результатов исследователи не обнаружили статистически значимых различий между лечением плацебо и терапией гидроксидом калия или между лечением плацебо и различными гомеопатическими препаратами.
 Подофиллотоксин (Кондилин, Кондилайн Никомед) в России представлен только в жидкой форме, специальная палочка используется для локального нанесения раствора на элементы и дозирования раствора, попадающего на кожу. При нанесении часто появляется дискомфорт, который довольно быстро уходит. Лечение необходимо применять в течение 3 дней подряд, далее сделав перерыв 4 дня. Количество курсов не должно превышать пяти.
Подофиллотоксин (Кондилин, Кондилайн Никомед) в России представлен только в жидкой форме, специальная палочка используется для локального нанесения раствора на элементы и дозирования раствора, попадающего на кожу. При нанесении часто появляется дискомфорт, который довольно быстро уходит. Лечение необходимо применять в течение 3 дней подряд, далее сделав перерыв 4 дня. Количество курсов не должно превышать пяти.
Имиквимод (Алдара, Кераворт, Вартоцид) – это крем, используемый для обработки больших зон или крупных скоплений элементов. Лечебный эффект препарата обусловлен его стимулирующим воздействием на иммунную систему. Крем наносится 3 раза в неделю на ночь, а утром смывается через 6–10 часов. Требуется несколько недель терапии для появления результата. Общие побочные эффекты имиквимода включают шелушение кожи, образование выраженных корок, покраснение и отек, ощущение жжения и зуда, иногда головные боли. Данные осложнения обычно разрешаются в течение 2 недель после прекращения лечения и дополнительной коррекции не требуют. Позднее установлено, что имиквимод не эффективен в виде монотерапии контагиозного моллюска и применяется только в комбинации с другими методами лечения [16–21].
Бензоил пероксид (Базирон АС, Продерм, Десквам, Экларан) – крем или гель. Его наносят тонким слоем на элементы 1 или 2 раза в день после душа или умывания на сухую чистую кожу. Бензоил пероксид может усилить чувствительность к солнечному свету, поэтому следует избегать чрезмерного воздействия солнечного и ультрафиолетового света или использовать солнцезащитный крем. К побочным эффектам бензоил пероксида относят покраснение и сухость, шелушение кожи, жжение и зуд в местах нанесения препарата. Обычно не требуется дополнительных способов лечения, элементы полностью разрешаются самостоятельно после завершения терапии.
Третиноин (Ретин-А, Весаноид, Локацид) доступен в виде жидкости и крема, которые применяются 1 или 2 раза в день на отдельные элементы. Как и в случае с бензоил пероксидом, третиноин может усилить чувствительность кожи к солнечному свету и ультрафиолетовому излучению. Наиболее распространенные побочные эффекты третиноина – это легкое раздражение и жжение кожи. С момента начала лечения до улучшения обычно проходит более 2 недель. В случаях нанесения третиноина на обширные участки кожи он может вызывать выраженную экзематизацию и воспаление окружающей кожи, что, наоборот, может приводить к аутоакуляции (самораспространение).
Кантаридин относится к раздражающим средствам (низкомолекулярный токсин), при нанесении на кожу через 2–5 часов вызывает образование волдырей, пузырьков, и пока они целые, боли не отмечается, после же вскрытия возникают раздражение, жжение, боль. Чаще всего используется в сочетании с имиквимодом.
В ряде исследований показана высокая эффективность такой комбинации. При этом первично назначается нанесение только на несколько элементов, чтобы проверить реакцию пациента на терапию [22, 23]. Кантаридин не одобрен Управлением по контролю за продуктами и лекарствами США, но долгое время американскими дерматологами использовался как безопасный и эффективный препарат [24, 25]. Различные виды кислот (би- и трихлоруксусная, салициловая, молочная, гликолевая) рекомендуют применять только под контролем специалиста, т.к. самостоятельное нанесение нередко приводит к рубцеванию и пигментации (рис. 3), помимо этого во многих исследованиях показано, что эффективны достаточно высокопроцентные растворы кислот – от 15% [26].
Антивирусные препараты для перорального приема (цидофовир, ритонавир). Предположительно противовирусные препараты могут препятствовать репликации вируса контагиозного моллюска. Из-за их дороговизны, длительной схемы лечения и возможных побочных действий их относят к препаратам выбора только для пациентов с ослабленным иммунитетом [27].
В некоторых исследованиях показано, что постепенное удаление контагиозного моллюска возможно путем приема циметидина, говорится о возможности его применения детьми, т.к. он безопасен, безболезнен и хорошо переносится, в то же время данных о его применении при контагиозном моллюске совсем мало, помимо этого препарат предназначен в первую очередь для лечения язвенной болезни желудка и, как предполагается, его действие при инфекции, вызванной контагиозным моллюском, опосредованно за счет влияния на иммунную систему.
В России допустимый возраст применения данного препарата от 14 лет, что делает невозможным его применение в педиатрической практике [28].
Управление по контролю за продуктами и лекарствами США не одобрило ни одного из местных или пероральных средств лечения контагиозного моллюска.
Другие методы лечения всегда должны выполняться квалифицированным специалистом.
Криотерапия включает замораживание очагов жидким азотом для их удаления. Каждый элемент замораживается в течение 5–10 секунд. Некоторые авторы с успехом применяют криодеструкцию для удаления контагиозного моллюска [29]. Обычно требуется несколько сеансов криотерапии, прежде чем все элементы полностью уйдут. А между процедурами рекомендуется делать перерыв не менее 10 дней, чаще – 2–3 недели, поэтому данный метод может увеличить сроки лечения.
Электрокоагуляция (диатермокоагуляция) использует тепло для удаления элементов. Перед удалением применяют местную анестезию в виде аппликаций растворов, кремов или мазей или местных инъекций анестетиками (лидокаин, прокаин или ультракаин). При обширных высыпаниях данный метод, как и любой другой метод деструкции, болезненен даже при применении местного обезболивания (рис. 6, 7).
Механическое удаление проводится острой кюреткой (малой ложкой Фолькмана) или пинцетом с тупыми концами. После выдавливания очаги обрабатывают 5%-ным спиртовым раствором йода. Как и при электрокоагуляции, до удаления используют местную анестезию [30, 31].
Лазерная деструкция – относительно новый тип лечения контагиозного моллюска. Во время и после процедуры может наблюдаться дискомфорт в зоне удаления, жжение, изменение цвета кожи. Обычно эти проявления уходят в течение нескольких недель. Чаще всего одной процедуры оказывается недостаточно [32–36].
Повторное обследование после любого способа терапии рекомендуется проводить через 2–4 недели, и, как правило, требуется повторное лечение. Если элементы плохо поддаются той или иной терапии, рекомендовано рассматривать комбинированную терапию несколькими методами [13]. Рецидивы возникают у 35% пациентов после первого избавления от всех элементов и могут представлять собой реинфекцию, обострение продолжающегося заболевания или новые поражения, возникающие после длительного инкубационного периода.
В результате поисков наиболее действенного лечения контагиозного моллюска в отношении детей проведено проспективное рандомизированное исследование, в котором сравнивались эффективность и побочные эффекты четырех ранее признанных методов лечения контагиозного моллюска у 124 детей [37]. В первой группе применяли кюретаж, во второй – кантаридин, в третей – комбинацию салициловой и молочной кислот, в четвертой – имиквимод. Установлено, что кюретаж – наиболее эффективный метод лечения, имеет самый низкий уровень побочных эффектов, но требует адекватной анестезии. Кантаридин менее эффективен, как правило, хорошо переносится, но имеет умеренные осложнения в виде пузырьковых высыпаний. Комбинация салициловой и молочной кислот вызывает слишком сильное раздражение, поэтому плохо переносится пациентами детского возраста. Имиквимод вообще не показал эффективности в отношении контагиозного моллюска в составе монотерапии и не рекомендован авторами исследования к применению.
Заключение
Исходя из проведенного обзора существующих методов лечения, можно сделать следующие выводы:
- Кюретаж, или механическое удаление контагиозного моллюска, наиболее эффективен для всех возрастных групп пациентов, а при адекватном местном обезболивании хорошо переносится.
- Пациентам с иммунодефицитами рекомендовано применение комбинации методов, чаще это лазерное удаление параллельно с адекватной противовирусной терапией.
- Ни один из методов наружной терапии не показал достоверных результатов по сравнению с плацебо, но может быть использован как пробный вариант, особенно при категоричном отказе самих пациентов и/или их родителей от механического удаления, чтобы не провоцировать появления новых элементов, или же для обработки мелких только появившихся элементов диаметром до 2 мм, пока не имеющих казеозного содержимого.
- Выжидательная тактика не обоснованна, т.к. чаще всего происходит распространение элементов путем аутоакуляции вируса на другие участки кожи за счет травм и трения.



