Введение
В настоящее время важнейшей медицинской проблемой является преэклампсия (ПЭ), которая остается ведущей причиной материнской и перинатальной заболеваемости и смертности во всем мире. Именно ПЭ обусловлено более трети тяжелой акушерской патологии [1].
Несмотря на значительное количество исследований ПЭ, на сегодня не существует ее единой классификации как по факторам, определяющим само понятие ПЭ, так и по срокам развития (ранняя, поздняя). Предшествовавшие классификации ПЭ, как правило, учитывали уровень протеинурии, степень артериальной гипертензии и выраженность отеков (шкалы Виттлингера Г., Слепых А.С., Репиной М.А., Goecke С. в модификации Савельевой Г.М.), при этом тяжесть состояния и наличие соматических заболеваний не анализировались [2]. В связи с этим становятся понятными столь различающиеся статистические показатели. Одни лечебные учреждения, использующие для определения ПЭ клинические рекомендации 2016 г., указывают на частоту ее тяжелых форм (33,4–40,5%), тогда как другие при использовании классической отечественной классификации – только 1,14–6,0% [3]. При этом следует отметить, что в отечественной литературе принято делить ПЭ на раннюю (до 34 недель) и позднюю (после 34-й недели) [4], тогда как в зарубежной литературе принята другая классификация: преждевременная ПЭ (preterm-preeclampsia; делится на ПЭ до 32 недель и с 32 до 37 недель) и ПЭ >37 недель (term-preeclampsia) [5].
Национальный институт здоровья и качества медицинской помощи (National Institute for Health and Clinical Excellence – NICE) сформулировал критерии риска развития ПЭ [6]. Критерии высокого риска: артериальная гипертензия при предыдущих беременностях, сахарный диабет, гипертоническая болезнь, хроническая почечная патология, аутоиммунные заболевания. К критериям умеренного риска относятся индекс массы тела (ИМТ) при первом визите ≥35 кг/м2, зачатие путем ЭКО, указания на наличие ПЭ в семейном анамнезе, возраст ≥40 лет, первая беременность, интервал между беременностями >10 лет [6]. Согласно рекомендациям ряда зарубежных ученых, сегодня для прогноза развития ПЭ наилучшим подходом является оценка совокупности материнских факторов риска [7, 8]. Однако эффективность такого скрининга, по данным NICE, составляет 41% для ПЭ <32 недель, 39% для ПЭ <37 недель и 34% в случаях ПЭ ≥37 недель [6]. При применении скрининга по параметрам Американского колледжа акушерства и гинекологии (ACOG) с более расширенным перечнем материнских факторов риска ПЭ до 32 недель определяется с частотой 94%, до 37 недель – 90%, в сроки ≥37 недель – 89%, но при том, что частота ложноположительных результатов составляет 64,2% [9].
Многочисленные исследования нацелены на изучение различных комбинаций факторов риска ПЭ, способных предсказать степень и тяжесть патологических осложнений. К примеру, сочетание допплеровских значений кровотока в маточных артериях и динамики уровня ангиогенных факторов во втором триместре беременности показали большую прогностическую значимость в отношении развития ПЭ, нежели эти факторы по отдельности [10]. В исследовании F. Crispi et al. [11] доказано, что совместное применение фактора роста плаценты и пульсационного индекса маточной артерии позволяют с 90%-ной чувствительностью и 95%-ной специфичностью прогнозировать раннее развитие ПЭ. Однако в отношении предсказания позднего начала ПЭ чувствительность данного метода составила лишь 11% [11]. Аналогичных работ по изучению ангиогенных факторов для прогноза ПЭ существует немало [12, 13]. Одним из широко используемых сочетаний служит скрининг, основанный на материнских факторах с добавлением сывороточного хорионического гонадотропина человека. Он улучшает прогноз для преждевременной ПЭ, но не для ПЭ после 37 недель [14].
В 2016 г. М. Tan et al. [15] предложили осуществлять скрининг для прогноза ПЭ посредством комбинированного теста (материнские факторы, среднее артериальное давление [МАР], пульсационный индекс маточных артерий, сывороточный плацентарный фактор роста и ассоциированный с беременностью белок А [PAPP-А]) и мини-комбинированного теста (материнские факторы, MAP, РАРР-А). Для ПЭ до и после 37 недель комбинированный и мини-комбинированный тесты имеют предсказательную ценность 75 и 55%, 60 и 50% соответственно. Однако использование комбинированного теста ограничено в связи со сложностью повсеместного определения допплерометрических показателей на практике. С другой стороны, мини-комбинированный тест выгодно отличался доступностью, эффективностью и легкостью применения [15]. Масштабное исследование 35 948 беременных в сроки 11–13 недель с использованием комбинированного теста показало эффективность прогнозирования ПЭ <32, <37 и ≥37 недель с частотой 89, 75 и 47% соответственно при ложноположительных значениях 10% [9]. Таким образом, этот вариант скрининга показал лучшую прогностическую ценность для ранней, но не поздней ПЭ. Последняя встречается значительно чаще, чем ранняя ПЭ, и имеет иные патогенетические факторы развития. В частности, поздняя ПЭ чаще встречается у женщин с низким общим сосудистым сопротивлением, высокими ИМТ и сердечным выбросом. В то же время для ранней ПЭ характерны повышенное сосудистое сопротивление и меньший ИМТ [16].
В ряде исследований утверждается, что ИМТ и МАР cлужат ведущим материнским предиктором развития ПЭ [5, 9]. Показано, что при ИМТ >30 кг/м2 увеличивается частота развития ПЭ по сравнению с пациентками с нормальным весом [17, 18].
В работе I. Cetin et al. [19] показано, что даже незначительные изменения МАР могут служить маркером развития ПЭ.
В другом исследовании обнаружено, что пациентки, у которых развивается ПЭ, имеют более высокие значения систолического артериального давления и MAP до развития клинических симптомов [20]. На основании проспективного мета-анализа, включившего клинические данные 60 тыс. женщин, в т.ч. 3300 случаев ПЭ, показано, что МАР служит более информативным фактором, чем систолическое или диастолическое давление [21].
В отношении биохимических маркеров развития ПЭ следует отметить, что в большей степени они ассоциируются с ранними и более тяжелыми вариантами ПЭ [22, 23]. При этом они не обладают достаточной специфичностью и чувствительностью, чтобы служить самостоятельными прогностическими критериями. Тем не менее использование биомаркеров в комбинации с материнскими факторами может обеспечить лучший прогностический результат по сравнению со скринингом на основе только материнских факторов.
Таким образом, несмотря на значительное количество исследований, предикторы ПЭ, особенно более часто встречающейся поздней ПЭ, остаются недостаточно изученными, что ограничивает возможность прогнозирования и лечения этого грозного осложнения беременности. Оценка мини-комбинированного теста ранее выполнялась согласно зарубежной классификации развития ПЭ. Однако для прогноза ПЭ после 34 недель (поздней, согласно российской классификации) она не проводилась.
Целью настоящего исследования был анализ эффективности мини-комбинированного теста для прогноза поздней ПЭ средней тяжести.
Методы
Для нашего исследования на основе ретроспективного анализа клинических данных 645 женщин, наблюдавшихся в течение всей гестации на базе женской консультации ГБУ РД ЦГБ г. Кизилюрта, отобраны 88 пациенток. Двадцати пяти беременным (первая основная группа) диагностирована ПЭ средней тяжести (МКБ О14,0), развившаяся после 34 недель беременности (поздняя ПЭ). В контрольную группу (вторая группа) методом случайной выборки вошли 63 пациентки без ПЭ. Для максимальной унификации данных в исследовании участвовали пациентки одной национальности (дагестанки) и некурящие. На основе литературных данных для детального изучения в ранние сроки беременности (11–13 недель) были выбраны наиболее прогностически значимые факторы: клинико-анамнестические показатели (возраст, ИМТ, МАР) и биохимический маркер (PAPP-A); MAP (mean arterial pressure – среднее артериальное давление) рассчитывалось по формуле: 2ДАД (диастолическое артериальное давление) +САД (систолическое артериальное давление)/3. PAPP-А определяли методом иммуноферментного анализа тест-системами DELFIA Perkin Elmer (Финляндия).
Статистическая обработка результатов проведена с использованием пакета программ Statistica версии 12.5, EXCEL 2010, MedCalc 15.8, SPSS24.002. В сравниваемых группах для количественных признаков использовали оценку медианы с вычислением 25%-ной и 75%-ной процентилей. При сравнении межгрупповых различий применяли непараметрический критерий Краскала–Уоллиса для независимых выборок и медианный критерий. Использован непараметрический корреляционный анализ с применением критерия Спирмена. Кроме того, применен ROC-анализ (Receiver Operator Characteristic) для классификации признаков и метод «Дерево решений» для отнесения определенных объектов к одному из известных классов, логистический регресс.
Результаты
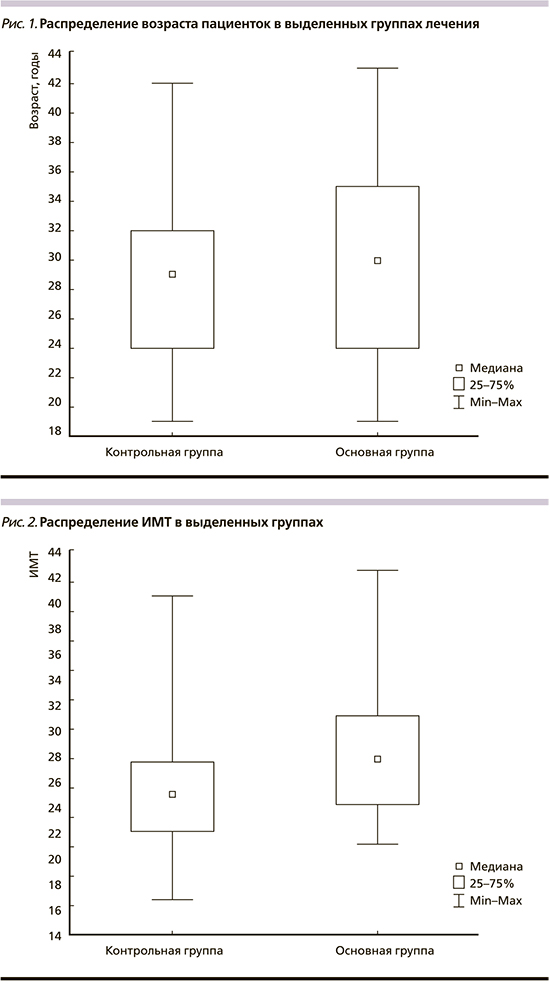
Проведенный анализ клинико-анамнестических показателей выявил, что средний возраст пациенток с ПЭ (основная группа) составил 30 [24–35] лет и был достоверно выше, чем у женщин контрольной группы, – 28 [24–32] лет (р=0,001; рис. 1).
При изучении ИМТ пациенток в 11–13 недель были обнаружены значимые различия между группами. У женщин с ПЭ этот показатель был значимо выше, чем у беременных второй группы: 29 [24–34] против 25 [22–27,5] кг/м2 (р=0,0001; рис. 2). Значения ROC-кривой для ИМТ составили: площадь под кривой – 0,702±0,038 (95% ДИ – 0,628–0,776), специфичность – 65%, чувствительность – 63%.
Следующим фактором, сравнивавшимся у пациенток выделенных групп, было МАР. Анализ полученных данных показал, что МАР у женщин с ПЭ было значимо выше, чем у беременных контрольной группы (р=0,008; рис. 3). У женщин с ПЭ значение показателя составило 84,3 [75–93] мм рт.ст., у пациенток группы контроля – 78,2 [73–83] мм рт.ст. Значения ROC кривой для показателя MAP были: площадь под кривой – 0,692±0,039 (95% ДИ – 0,615–0,769), специфичность – 65%, чувствительность – 61%.
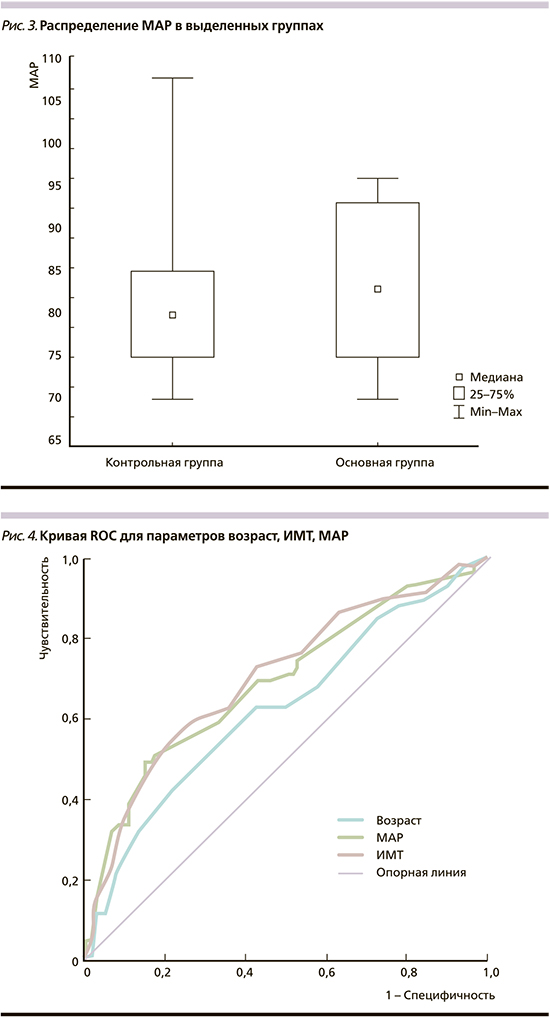
В рамках выполнения задач данного исследования проведен ROC-анализ двух факторов мини-комбинированного теста ИМТ и МАР. Согласно данным ROC-кривой, мы получили точку разделения для ИМТ 24,5 кг/м2 (специфичность – 65%, чувствительность – 63%). Площадь ROC-кривой составила 0,702±0,038 (95% ДИ – 0,62–0,776; р=0,0001; рис. 3). Точка разделения MAP была 80,5 мм рт.ст. (специфичность – 65%, чувствительность – 61%), при этом площадь ROC-кривой равнялась 0,692±0,039 (95% ДИ – 0,615–0,769; р=0,0001; рис. 4).
С целью уточнения прогностической ценности наиболее информативных материнских факторов (ИМТ и MAP) использован метод «Дерево решений». Обнаружено, что ИМТ – это маркер с наивысшей прогностической ценностью. Этому фактору соответствовало наибольшее значение критерия значимости (χ2=0,076), и следовательно, в корневом узле дерева проверялся именно этот параметр. Методом «Дерево решений» показано, что при значении ИМТ >30,5 кг/м2 и МАP >98 мм рт.ст. можно прогнозировать позднюю ПЭ с чувствительностью 69,6% и специфичностью 86% при отношении шансов 14,2 [4,579–44,172].
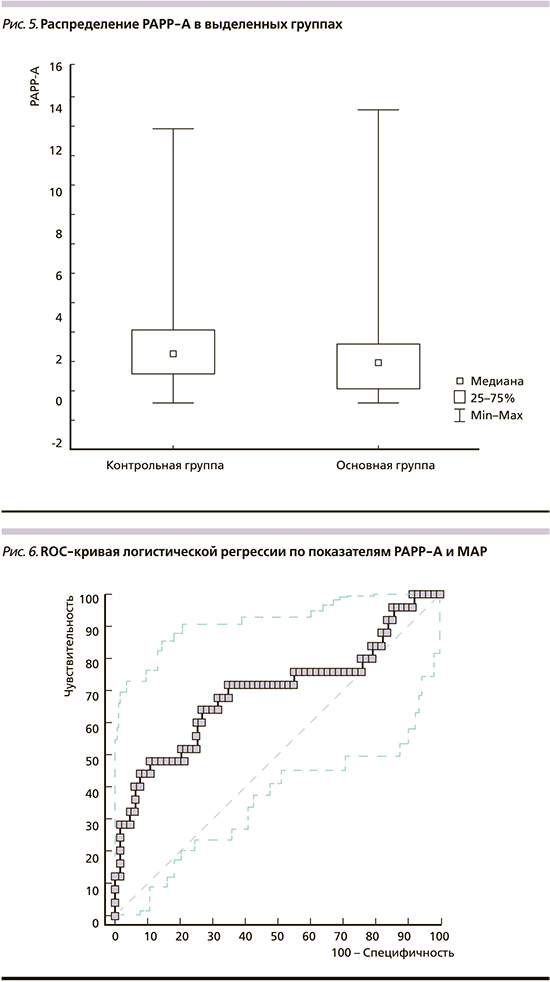
Биохимическим параметром сравнения у пациенток выделенных групп был материнский сывороточный белок PAPP-A. Показано, что этот показатель не имел статистически значимых различий у пациенток выделенных групп: 1,92 [0,80–2,82] и 2,26 [1,14–3,84] МЕ/мл (р=0,269; рис. 5). Для конкретизации значения этого параметра в рамках анализа эффективности мини-комбинированного теста нами был применен ROC-анализ для оценки эффективности совместного влияния двух факторов (МАР и РАРР-А). ROC-кривая, представленная на рис. 6, отображает показатели их совместного применения для оценки эффективности прогнозирования ПЭ. Чувствительность теста при 10% ложнопозитивных результатов составила 44%.
Обсуждение
Согласно современным представлениям, ряд клинико-анамнестических факторов рассматривается как наиболее вероятные предикторы ПЭ. Так, в исследовании, выполненном на значительной выборке (159 072 беременных) [12], показано, что фактором риска развития ПЭ является не только ожирение с ИМТ ≥30,0 кг/м2, но и ИМТ в пределах 25,0–29,9 кг/м2. Риск развития ПЭ при таких показателях значительно выше, чем у женщин с ИМТ, равным 20,0 кг/м2 [1]. В нашем исследовании женщин с ПЭ отличали более высокие значения ИМТ, что подтверждает данные литературных источников.
Полученные нами результаты также подтверждают ценность МАР как маркера развития ПЭ. На основании анализа клинических данных 17 383 беременных D. Galloc et al. пришли к аналогичным выводам о целесообразности использования данного фактора для прогноза ПЭ [24].
Согласно данным некоторых исследователей, PAPP-A – биохимический параметр, значимый для прогноза ПЭ [22, 25]. А. Bilagi et al. [26] при обследовании 12 592 пациенток обнаружили, что изменение концентрации PAPP-A служит прогностическим маркером ПЭ. Однако данные другого масштабного исследования, включившего биохимический анализ параметров 10 710 пациенток, отрицают его прогностическую ценность [27]. Результаты нашей работы показали, что у беременных с ПЭ значения PAPP-А не были значимо увеличены по сравнению с пациентками контрольной группы. С нашими результатами созвучны последние данные мета-анализа, не подтвердившие прогностического значения в отношении ПЭ [9].
В нашем исследовании также показана низкая прогностическая эффективность совместного применения двух факторов: МАР и РАРР-А. Полученный результат согласуется с данными других авторов [5, 9] и свидетельствует о необходимости продолжения поиска предикторов поздней ПЭ.
Заключение
Несмотря на многочисленные исследования, посвященные обнаружению ранних предикторов ПЭ, поиск эффективных, доступных в применении на практике маркеров этого осложнения беременности, по-прежнему остается одной из важнейших научно-практических задач современного акушерства. Особенно эффективен, на наш взгляд, многофакторный подход, позволяющий компилировать различные маркеры с целью идентификации женщин высокого риска по развитию ПЭ. В связи с этим нас заинтересовал предложенный NICE мини-комбинированный тест.
В нашем исследовании показана значимость клинических факторов, прогнозирующих ПЭ средней тяжести после 34 недель беременности: возраста, МАР и ИМТ (чувствительность данного метода составила 69,6%, специфичность – 86%). Кроме того, мы оценили прогностическую значимость мини-комбинированного теста для поздней ПЭ, оказавшуюся низкой (44% при 10% ложнопозитивных результатов).
Таким образом, для своевременного прогноза поздней ПЭ, а также для расширения наших представлений о ее патогенезе необходим поиск новых маркеров развития ПЭ.



