Введение
Современные представления о хронической обструктивной болезни легких (ХОБЛ) свидетельствуют о сложном по своей патофизиологии и морфологии заболевании, для которого характерны многообразные клинико-функциональные проявления и гетерогенный воспалительный ответ. Длительное время ключевой клеткой воспаления дыхательных путей при ХОБЛ считался нейтрофил, тогда как эозинофильное воспаление рассматривалось в качестве типичной цитологической характеристики бронхиальной астмы – БА [1, 2]. Вместе с тем накоплены многочисленные данные, свидетельствующие о гетерогенности воспалительного ответа у больных ХОБЛ как в стабильном состоянии [3, 4], так и при обострении заболевания [5, 6]. В частности, результаты исследований последних лет демонстрируют эозинофильное воспаление дыхательных путей у значительной части больных ХОБЛ при исключении сопутствующей БА [7, 8].
Растущее число исследований, посвященных многообразию клинических форм ХОБЛ, свидетельствует о существенном влиянии эозинофильного воспаления не только на особенности течения и прогноз больных ХОБЛ, но и на различия терапевтической эффективности ингаляционных глюкокортикостероидов (ИГКС), что подтверждает фенотипическую гетерогенность заболевания.
Эозинофилия крови как косвенный маркер эозинофильного воспаления дыхательных путей при ХОБЛ
При оценке воспалительного ответа при ХОБЛ и БА предпочтение отдается исследованию цитологической характеристики содержимого дыхательных путей. Эозинофильный вариант ХОБЛ определяется при наличии ≥3% эозинофилов в цитологии индуцированной мокроты [3]. Эозинофилия мокроты, по данным ряда исследователей, встречается у трети (34–38%) больных ХОБЛ в стабильном состоянии [3, 4]. Следует отметить, что цитологический анализ индуцированной мокроты является методически сложной и трудоемкой задачей для большинства клинических лабораторий и во многих случаях малодоступен в реальной клинической практике.
В связи со сказанным привлекают внимание результаты исследований, показывающие, что содержание эозинофилов в мокроте коррелирует с уровнем эозинофилии крови [6, 9]. Механизм взаимосвязи уровня эозинофилов в периферической крови и выраженности воспалительного процесса в дыхательных путях при ХОБЛ изучен недостаточно. Вместе с тем продемонстрированы существенные различия уровня эозинофилии крови больных ХОБЛ с таковой мокроты и без нее, что подтверждается корреляционным анализом (r=0,535; p<0,0001). Было показано, что специфичность этой корреляционной зависимости увеличивается от 50 до 99% по мере нарастания числа эозинофилов в периферической крови от ≥200 до ≥600 клеток/мкл [9].

Кроме того, выраженность эозинофильного воспаления в бронхах, в частности в подслизистой оболочке дыхательных путей у больных ХОБЛ при исключении БА, также коррелирует с показателем эозинофилии периферической крови (r=0,57; р=0,009) [10]. Аналогичные данные, подтверждающие взаимосвязь уровней эозинофилии крови и мокроты, получены и у больных БА [11–13], что позволяет рассматривать эозинофилию крови в качестве универсального маркера эозинофильного воспаления дыхательных путей. Необходимо отметить, что анализ крови в отличие от исследования индуцированной мокроты широко доступен, легко выполним и может проводиться всем больным, поэтому число эозинофилов крови в качестве биомаркера заслуживает самого пристального внимания для фенотипической характеристики воспаления при ХОБЛ.
Изучение клинических особенностей эозинофильного фенотипа ХОБЛ позволило выявить существенные различия частоты обострений у больных ХОБЛ в зависимости от уровня эозинофилии периферической крови [14, 15]. При этом подчеркивается, что эозинофилия крови является независимым фактором риска обострений заболевания. Ретроспективный анализ некоторых исследований свидетельствует о закономерном увеличении вероятности обострений ХОБЛ по мере нарастания числа эозинофилов периферической крови. Так, у больных ХОБЛ с эозинофилией крови <2% частота обострений составила 0,89 в год, 2–3% эозинофилов – 1,21 обострения/год, 4–5% эозинофилов – 1,24 и с эозинофилией крови ≥6% – 1,62 обострения ХОБЛ в год [15]. Сравниваемые группы больных ХОБЛ в анализируемых исследованиях не имели существенных различий по выраженности респираторных симптомов и показателям легочной функции, поэтому полученные результаты позволили авторам рассматривать уровень эозинофилов крови в качестве независимого биомаркера более частых обострений ХОБЛ.
В современных научных публикациях по ХОБЛ отсутствуют строго согласованные количественные критерии эозинофильного воспаления с учетом выраженности эозинофилии периферической крови. Однако большинство исследователей определяют эозинофильный вариант воспаления при уровне эозинофилии ≥2%, или 200 и более клеток/мкл, периферической крови [3, 14, 16]. Проект федеральных клинических рекомендаций по ХОБЛ, представленный на сайте Российского респираторного общества [17], предлагает использовать в качестве критерия эозинофильного воспаления вне обострения заболевания уровень эозинофилии крови >300 клеток/мкл.
Доля больных ХОБЛ с эозинофилией периферической крови ≥2%, по данным литературы, существенно варьирует: от 32 до 75% [7, 14, 16]. Представленный разброс по числу больных в зависимости от уровня эозинофилии крови (рис. 1), вероятнее всего, можно объяснить различающимися критериями включения/исключения и возможным участием в некоторых из представленных исследований больных ХОБЛ в сочетании с БА. Вместе с тем в клинических исследованиях, критерии включения/исключения которых были прицельно ориентированы на изолированную ХОБЛ без возможной БА, хотя и наблюдалось меньшее число больных с эозинофилией, тем не менее и у них частота уровня эозинофилов в крови >2% была достаточно высокой, составив 27–37% [7, 8].
Большое клиническое значение для фенотипической характеристики того или иного заболевания имеет оценка воспроизводимости или стабильности оцениваемого биомаркера. N. Negewo и соавт. показали, что повторный анализ уровня эозинофилии крови больных ХОБЛ с интервалом 1 месяц в среднем характеризовался высоким внутриклассовым коэффициентом корреляции – 0,8 (95% доверительный интервал [ДИ] – 0,66–0,88; р<0,0001), что подтверждает воспроизводимость эозинофилии при данном варианте ХОБЛ [9]. Таким образом, представленные результаты исследований позволяют рассматривать уровень эозинофилов более 2% (>200 клеток/мкл) в периферической крови в качестве обоснованного предиктора эозинофилии дыхательных путей и, соответственно, широко доступного в клинической практике диагностического биомаркера эозинофильного фенотипа ХОБЛ.
Характеризуя клинические особенности эозинофильного фенотипа ХОБЛ, следует иметь в виду неблагоприятное модифицирующее влияние эозинофильного воспаления на эволюцию заболевания. В частности, при эозинофильном фенотипе ХОБЛ увеличивается частота обострений [15, 18] и темпы прогрессирования заболевания [16], что приводит к неблагоприятному прогнозу и повышенной летальности по сравнению с пациентами без увеличенного уровня эозинофилов в крови и/или мокроте. Было показано, что эозинофилия крови >275 клеток/мкл ассоциируется с увеличением риска смерти в 4,8 раза среди больных ХОБЛ с анамнезом обострений заболевания [19]. Кроме того, анализ показателей летальности продемонстрировал, что указанный уровень эозинофилии крови в общей популяции на протяжении 30-летнего периода наблюдения был связан с увеличением общей смертности на 40% [20].
К настоящему времени накоплены убедительные данные о том, что выделение эозинофильного фенотипа ХОБЛ имеет большое значение не только в связи с клиническими особенностями и прогнозом заболевания, но и с точки зрения его дифференцированной терапии. В частности, эффективность и безопасность ИГКС для больных ХОБЛ существенно ассоциированы с выраженностью эозинофильного воспаления.
Эозинофилия при ХОБЛ как предиктор эффективности терапии ИГКС
Хорошо известно, что воспаление дыхательных путей является одним из ключевых патофизиологических механизмов ХОБЛ и, соответственно, важной мишенью для фармакологического воздействия. В связи с этим до недавнего времени добавление ИГКС к длительно действующим бронходилататорам рассматривалось в качестве обязательного шага терапевтического алгоритма для больных тяжелой и крайне тяжелой ХОБЛ [21]. В последние годы целесообразность назначения ИГКС в терапии ХОБЛ подвергается существенному пересмотру, поскольку влияние этой группы препаратов на легочное и системное воспаление неоднозначно [22]. Кроме того, в ряде исследований был обнаружен повышенный риск развития пневмонии и туберкулеза легких на фоне применения этого класса препаратов у больных с ХОБЛ [23,24]. Все вышеизложенное послужило предпосылкой для поиска новых терапевтических мишеней и анализа соотношения польза/риск для ИГКС при различных фенотипах ХОБЛ, в т.ч. его эозинофильном варианте.
Анализ данных двух рандомизированных исследований, в которых оценивались комбинированная терапия флутиказоном фуроатом и вилантеролом, а также монотерапия вилантеролом, свидетельствует о значительных различиях частоты обострений ХОБЛ, зависимых от исходного уровня эозинофилии крови в сравниваемых группах. При комбинированной терапии по сравнению с группой монотерапии вилантеролом частота обострений ХОБЛ в год у пациентов с уровнем эозинофилов в крови ≥2% снижалась на 29% (р<0,0001), тогда как в группе с показателем эозинофилов <2% снижение частоты обострений составило только 10% (р=0,28). Важно отметить, что результаты анализа показывают прогрессивное нарастание частоты обострений с увеличением числа эозинофилов крови в группе пациентов, не получающих поддерживающей терапии ИГКС [15]. Аналогичные данные получены при проведении post-hoc-анализа исследования WISDOM. Так, в случае отмены ИГКС у пациентов тяжелой и крайне тяжелой ХОБЛ, получающих тройную терапию, на фоне эозинофилии крови ≥3 и ≥5% риск обострений увеличивался на 29 и 67% (отношение рисков [ОР]=1,289, 95% ДИ – 1,013–1,640; p=0,039) и (ОР=1,667, 1,085–2,561; р=0,02) соответственно [18]. Кроме того, отмена ИГКС в этом исследовании сопровождалась существенными различиями скорости снижения объема форсированного выдоха за первую секунду (ОФВ1) по сравнению с пациентами, продолжавшими получать тройную терапия ХОБЛ. Так, через год наблюдения разница показателей ОФВ1 между сравниваемыми группами пациентов составила 43 мл (р=0,001) [25].
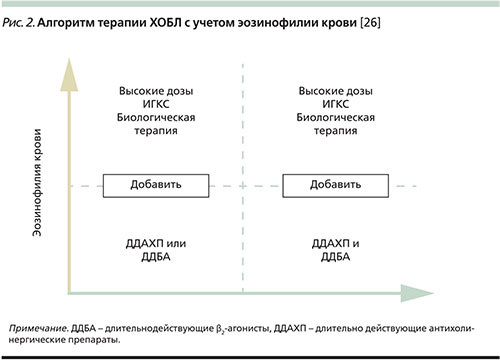
Полученные данные позволяют рассматривать уровень эозинофилов крови не только в качестве биомаркера более частых обострений ХОБЛ и предиктора их снижения на фоне терапии ИГКС, но и как индикатор, позволяющий прогнозировать высокую вероятность развития обострений ХОБЛ при отмене ИГКС. Результаты проведенных исследований еще раз подтверждают вывод, согласно которому исследование уровня эозинофилов периферической крови позволяет не только персонализировать терапию ХОБЛ, но и оптимизировать ее эффективность (рис. 2) [26]. Аналогичные алгоритмы терапии ХОБЛ, учитывающие уровень эозинофилии крови, в самое последнее время представлены и другими авторами [27, 28].
Анализируя взаимосвязь эозинофилии и обострений ХОБЛ, следует отметить, что повышенный уровень эозинофилов в периферической крови не только ассоциируется с более частыми обострениями, но и является предиктором их тяжести [29]. Так, у пациентов с эозинофилией крови ≥200 клеток/мкл и/или ≥2% риска повторных госпитализаций в течение 12 месяцев по поводу тяжелого обострения ХОБЛ или любых других состояний, требующих стационарного лечения, был значительно выше по сравнению с больными, у которых регистрировалось меньшее число эозинофилов для тяжелых обострений ХОБЛ и для госпитализаций по другим причинам (отношение шансов [ОШ]=3,59 [1,65–7,82]; p=0,0013) и (ОШ=2,32 [1,10–4,92]; p=0,0277) [29].
Эозинофильный фенотип ХОБЛ ассоциируется не только с повышением частоты обострений и их тяжести, но и с более быстрыми темпами снижения легочной функции. Это показал ретроспективный анализ эффективности ИГКС в исследовании ISOLDE: у больных ХОБЛ были выявлены существенные различия ежегодного снижения ОФВ1 в зависимости от исходного числа эозинофилов крови (рис. 3) [16]. У больных ХОБЛ с эозинофилией крови менее 2% терапия флутиказоном пропионатом по сравнению с группой плацебо не сопровождалась различиями показателей скорости снижения ОФВ1 – 54,2 и 51,3 мл/год соответственно (р=0,688), тогда как у пациентов с числом эозинофилов в крови ≥2% темпы падения легочной функции были существенно ниже в группе флутиказона пропионата, составив 33,9 мл/год по сравнению с показателем группы плацебо 74,5 мл/год (р=0,003).
Таким образом, анализ результатов приведенного исследования убедительно подтверждает мнение, cогласно которому для эозинофильного фенотипа ХОБЛ характерно более быстрое нарастание бронхиальной обструкции, тогда как терапия ИГКС позволяет значительно замедлять скорость прогрессирования заболевания при данном фенотипе болезни.

Также не менее важными представляются вопросы безопасности длительного применения ИГКС больными ХОБЛ в зависимости от уровня эозинофилии периферической крови. Проведенный мета-анализ 10 рандомизированных клинических исследований с участием 10 861 пациента, основной целью которого стало определение различий в отношении риска развития пневмонии у больных ХОБЛ с низким (<2%) и высоким (≥2%) уровнями эозинофилии крови, свидетельствует о некотором «протективном» эффекте эозинофильного воспаления при ХОБЛ [30]. Результаты мета-анализа показали, что риск развития пневмонии у больных ХОБЛ с низким уровнем эозинофилов был на 31% выше (ОР=1,31, 95% ДИ – 1,06–1,62). Кроме того, тяжелые пневмонии также встречались чаще в группе больных ХОБЛ с низкой эозинофилией крови. Тенденция к повышению частоты развития пневмонии при уменьшении уровня эозинофилов сохранялась и после стратификации пациентов по применению ИГКС. В группе, где проводилась терапия ИГКС, эпизоды пневмонии были зарегистрированы у 40 (3,8%) из 1063 пациентов с уровнем эозинофилов <2% и у 48 (2,4%) из 2002 пациентов с уровнем эозинофилов ≥2% (ОР=1,53, 95% ДИ – 1,01–2,31).
Более низкая частота пневмоний у пациентов с эозинофильным фенотипом ХОБЛ рассматривается специалистами с позиций активного участия эозинофилов в иммунно-воспалительных реакциях, опосредованных Тh-2-клетками, а также противоинфекционной активности эозинофильных гранулоцитов [30]. Соответственно, уменьшение числа эозинофилов может говорить о повышенной восприимчивости к инфекции или быть следствием недавно перенесенной инфекции. Кроме того, у пациентов с ХОБЛ и уровнем эозинофилов крови <2%, вероятнее всего, преобладает нейтрофильное воспаление дыхательных путей, которое часто связано с хронической инфекцией, предрасполагающей к развитию пневмонии. Именно с нейтрофильным характером воспаления связывается низкая эффективность ИГКС при ХОБЛ.
Таким образом, эозинофильный фенотип ХОБЛ наряду с отмеченными выше клинико-функциональными особенностями заболевания характеризуется и клинически значимыми особенностями ответа на терапию ИГКС, уменьшающими в этой группе больных частоту обострений и снижающими темп прогрессирования бронхиальной обструкции.
Заключение
Приводимые в настоящем обзоре материалы свидетельствуют о существенном вкладе эозинофильного воспаления в клинические проявления ХОБЛ, включая и особенности терапевтического ответа, что позволяет рассматривать эозинофилию при ХОБЛ в качестве самостоятельной фенотипической характеристики заболевания.
Эозинофильный фенотип ХОБЛ, диагностируемый по уровню эозинофилии мокроты и/или крови, достаточно широко распространен и определяется примерно у трети больных. Эозинофильное воспаление в значительной степени модифицирует течение ХОБЛ, влияя на частоту обострений и темп прогрессирования обструктивных нарушений, что в конечном счете обусловливает и более высокую смертность в этой группе больных. Вместе с тем использование ИГКС в терапии эозинофильного фенотипа оказывает существенное влияние на эволюцию ХОБЛ, снижая частоту обострений и замедляя скорость прогрессирования заболевания.
Таким образом, выделение в клинической практике эозинофильного фенотипа ХОБЛ играет важную роль, поскольку не только детализирует клинические особенности заболевания, но и обосновывает целесообразность назначения ИГКС (в комбинации с ДДБА), что повышает эффективность лечения в данной группе больных.



