Интерес к микрофлоре пищеварительного тракта возник в XIX в., когда Луи Пастер заявил, что «жизнь без бактерий была бы невозможной». Несколько лет спустя И. Мечников постулировал, что молочнокислые бактерии могут содействовать долголетию. В настоящее время установлено, что количество микроорганизмов, которые колонизируют человеческий организм, в 10 раз превышает число клеток организма человека, а число генов микроорганизмов в 150 раз больше числа генов человека [1].
В связи с этим весьма популярной становится точка зрения, согласно которой исследование заболеваний человека должно включать изучение роли микробиома [2].
Изучение микрофлоры желудочно-кишечного тракта (ЖКТ) проходит весьма активно. В 2007 г. Американ-ский Национальный институт здоровья запустил проект микробиома человека [3]. В 2008 г. Европейский Союз финансировал проект, посвященный метагеномике ЖКТ человека. В 2009 г. Международный консорциум микробиома человека начал исследовать связь микробиоты со здоровьем и заболеваниями человека [4, 5]. Мы рассмотрим некоторые результаты исследований, связанных с изучением состава микробиоты желудка.
Изучение желудочной микробиоты развивалось медленно вследствие догмата, будто «желудок является стерильным органом». Считалось, что помимо кислоты рефлюкс желчных кислот, слизь и перистальтика препятствуют бактериальной колонизации желудка. Мешало изучению микробиома желудка отсутствие простых и надежных диагностических тестов [6, 7].
Открытие Campylobacter pyloridis R. Warren и B. Marshall разрушило догму о стерильном желудке [8]. Сле-дует заметить, что в 1981 г. за несколько месяцев до открытия Helicobacter pylori в журнале Lancet было сообщение о множестве кислотоустойчивых штаммов бактерий в желудке, среди которых преобладали Streptococcus, Neisseria и Lactobacillus [9]. В Советском Союзе в это время также были опубликованы аналогичные работы [10, 11].
В последнее время развитие молекулярных методов, основанных на определении генов 16S рРНК, например флуоресцентной гибридизации, дот-блот-гибридизации с рРНК-целевыми пробами, клонирование и секвенирование рДНК, способствовали выявлению и классификации бактерий в желудке [12, 13].
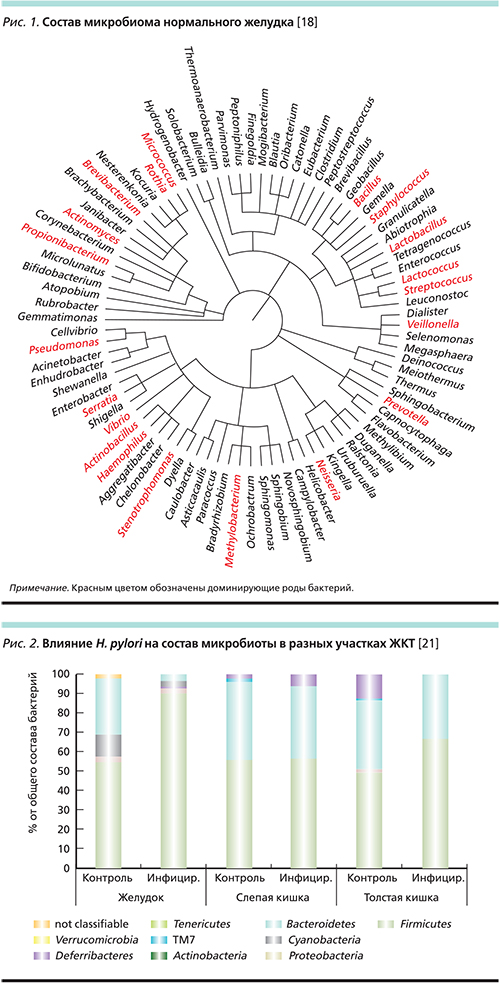
К первым методически безупречным работам относят исследование E.M. Bik и соавт. [14], которые проанализировали слизистую оболочку желудка у 23 здоровых взрослых испытуемых с использованием клонирования 16S рДНК. Авторы идентифицировали 1056 нехеликобактерных клонов, 127 филотипов и 5 доминирующих родов (Streptococcus, Prevotella, Rothia, Fusobacterium и Veillonella) бактерий. Несколько лет спустя X.X. Li и соавт. [15] проанализировали желудочную микробиоту 10 здоровых лиц путем клонирования и секвенирования 16S рРНК и определили 1223 нехеликобактерных клона, 133 филотипа и 5 доминирующих родов (Streptococcus, Prevotella, Neisseriae, Haemophilus и Porphyromonas). В 2013 г. L. Engstrand и М. Lindberg [16] исследовали желудочную микрофлору 13 здоровых пациентов с помощью пиросеквенирования и идентифицировали в желудке 200 филотипов и 5 доминирующую родов (Prevotella, Streptococcus, Veillonella, Rothia, Pasturellaceae). S. Delgado и соавт. [17] изучали желудочный сок и образцы биопсии слизистой оболочки желудка 12 здоровых лиц, используя культуральный метод и пиросеквенирование, и обнаружили, что наиболее распространенными были роды Streptococcus, Propionibacterium и Lactobacillus. У различных групп населения (афроамериканцы, латиноамериканцы, китайцы и европейцы) желудочная микрофлора имела очевидное сходство. При этом общее число родов бактерий в желудке достигает 85 (рис. 1) [18].
Активно исследуются отношения между Н. pylori и другой микрофлорой желудка. M.P. Tan и соавт. сообщили, что хроническая инфекция Н. pylori не приводит к существенному изменению микробиоты в желудке у мышей [19]. Точно так же E.M. Bik и соавт. не обнаружили существенных различий в желудочной микробиоте между H. рylori-положительными и H. рylori-отрицательными пациентами с точки зрения 16S рДНК [14]. Y. Khosravi и соавт. подтвердили эти результаты на большой выборке субъектов, включившей 131 H. рylori-положительных и 84 H. рylori-отрицательных пациентов [20]. Авторы систематического обзора пришли к следующему выводу: влияние Н. pylori на микробиом ЖКТ нуждается в дальнейшем изучении (рис. 2) [21].
В плане изучения взаимосвязи микрофлоры с патологией приобретает значение определения дисбиоза желудка. Японские авторы полагают, что дисбиоз желудка – это снижение нормальных доминантных штаммов и увеличение минорных штаммов бактерий [22].
Большое внимание в настоящее время уделяется изучению предраковых и онкологических заболеваний органов пищеварения [23, 24]. В работе шведских ученых была исследована микробиота 10 больных раком желудка и 5 лиц с диспепсией молекулярными методами. Секвенирование показало относительно низкое содержание H. pylori и доминирование у больных раком желудка анаэробных штаммов (Клостридии, Бактероиды), увеличение общего количества бактерий в желудке по сравнению с лицами с нормальной слизистой оболочкой желудка [25]. В другом исследовании количество бактерий семейства Helicobacteraceae было значительно снижено в группе лиц с раком желудка по сравнению с пациентами с хроническим гастритом, в то время как число бактерий семейства Streptococcaceae значительно возросло. Разнообразие и плотность микробиоты желудка в группе рака желудка было увеличено по сравнению со здоровыми лицами [26]. Авторы одной из обзорных работ пришли к выводу, что как H. pylori, так и другая флора могут играть роль в развитии рака желудка [18]. Американские ученые исследовали микробиоту желудка в популяциях с высоким и низким риском рака желудка в Колумбии. Жители горного г. Тукуеррес имели в 25 раз более высокий риск развития рака желудка, чем жители прибрежного г. Тумако, несмотря на сходную распространенность H. pylori. Были обследованы по 20 человек от каждого города. Микробиота желудка изучалась с помощью глубокого секвенирования амплифицированной 16S рДНК. Были обнаружены выраженные различия в микробиоте желудка в исследованных популяциях. Leptotrichia wadei и Veillonella sрp. были значительно более распространены в Тукуерресе, а Staphylococcus sрp. чаще определялись в Тумако [27].
Огромное значение для признания объективности изменений имеют международные классификации. Поэтому точка зрения авторов Киотского консенсуса, согласно которой гастрит может быть ассоциирован не только с H. pylori, но и с другими микроорганизмами, имеет очень большое значение [28]. Все вышесказанное позволяет сделать вывод об уже состоявшемся втором этапе революции, связанной с изучением микробиоты желудка. Очевидно, что дальнейшее понимание патогенеза заболеваний этого органа будет связано с изучением взаимодействия бактерий, вирусов, грибов и паразитов [29].


