Внастоящее время хорошо известно, что микробиота человека служит фундаментальной основой его здоровья и резервом адаптации к неблагоприятным воздействиям окружающей среды. В связи с этим активно развиваются новые молекулярно-биологические направления исследования здоровья человека, связанные с анализом нарушений структуры микробиоты и риском возникновения различных хронических инфекционных и метаболических заболеваний, включая атеросклероз, липидный дистресс-синдром, диабет 2 типа, ожирение и др. [7, 38].
В клиническую микробиологию активно включаются новые научные технологии: геномика, протеомика, метаболомика, транскриптомика человека (табл. 1). Аналогичные научные технологии используют и для оценки роли нормальной микробиоты человека, что позволяет выявлять тонкие механизмы ее реагирования на различные стрессовые воздействия внешней среды и устанавливать факторы, поддерживающие биохимическое, метаболическое и иммунологическое равновесие, необходимое для сохранения стабильности взаимоотношений между макроорганизмом и микроорганизмами. В обзоре также обсуждается важность оценки профилактического и лечебного действий новых штаммов с пробиотическим действием и их комбинаций на микробиоту человека с позиций новых научных технологий [30].
Микробиота
В процессе накопления новых данных стало понятно, что общее число клеток микробиоты, которая является совокупностью микроорганизмов, населяющих открытые полости организма человека, составляет 90% от общего числа клеток организма и насчитывает около 1 трлн бактерий. Клетки и ткани макроорганизма содержат 2,5 млн различных молекул, около 1 млн разнообразных белков, 300 тыс. разновидностей липидов и сотни тысяч других простых и сложных соединений [55]. Установлено, что в таких сложных биологических системах, как организм человека, различные представители микробиоты участвуют в метаболических процессах как в отдельных клетках, так и органах и тканях всего организма хозяина.
Микробиом
В настоящее время показано, что в микробиоме, представляющем собой совокупность всех генов микробиоты человека, количество генов на три порядка выше такового генома человека [43]. Полученные данные требуют глубокого исследования роли микроорганизмов во всех проявлениях функциональной и метаболической активности человеческого организма с применением в области клинической микробиологии новых медицинских технологий.
Использование новых научных технологий применительно к микробиоте человека позволяет с большей точностью устанавливать функции большинства их генов, а также выявлять метаболические и сигнальные пути, влияющие на реализацию экспрессии необходимых для адаптации генов симбионтных представителей нормальной микробиоты, являющихся основой пробиотических препаратов.
Пробиотическое воздействие микробиоты связано с проявлением самых различных свойств бактерий, что может оказывать существенное влияние на клеточные функции всего макроорганизма.
Показано, что у бактерий эпигеномные механизмы участвуют в детерминировании фазных вариаций клеточного цикла; синтеза факторов, ассоциированных с адгезией, адаптацией, биопленкообразованием, антагонистической активностью, вирулентностью, токсинообразованием и др. [28, 51]. Благодаря эпигенетическим исследованиям стали более понятными многие механизмы клинических проявлений метаболического синдрома, аллергии и астмы [54]. В сложных микробиоценозах представители симбионтной микробиоты тесным образом связаны с функциями отдельных клеток, органов и тканей всего организма хозяина [23]. Эпигенетическое воздействие может быть индивидуальным: ткане- и/или клеточно-специфическим [24]. Возникшие в раннем онтогенезе эпигенетические изменения могут стать триггерными в процессах развития многих хронических заболеваний [53].

Транскриптомика
В настоящее время стало возможным устанавливать интенсивность синтеза всех молекул РНК (транскриптов) в эу- и прокариотических клетках организма в определенном его физиологическом состоянии, а также в конкретный период времени и в определенных условиях среды, в т.ч. и при возникновении и развитии заболеваний, с помощью методических подходов транскриптомики. В отличие от геномики и метагеномики, свидетельствующих лишь о потенциальных возможностях организма, транскриптомика количественно измеряет динамическую экспрессию молекул РНК хозяина, его микрофлоры и/или всего надорганизма в целом (мета-транскриптомика). Анализ транскриптома (определение в исследуемом материале количественного и качественного профиля всех синтезированных информационных, рибосомальных, транспортных и других РНК) позволяет устанавливать, какие именно гены транскрибируются для последующего синтеза соответствующих белков, характерных для здорового человека или для конкретного заболевания. Разновидностью транскриптомики является РНомика, методологический подход, направленный на идентификацию в исследуемом образце молекул РНК, которые не связаны непосредственно с синтезом белков, а выполняют регуляторную функцию, влияя на экспрессию генов, в т.ч. через феномен интерференции с мРНК [50]. Например, при исследовании мета-транскриптома кишечной микробиоты здоровых людей установлено, что более 50% всех обнаруженных в образцах молекул РНК относились к микроРНК, не участвовавших в синтезе белков [34]. Информация о количественном содержании РНК позволяет устанавливать, какие именно гены активированы в организме в момент взятия исследуемого биоматериала.
Протеомика
Понятие «протеом» включает совокупный спектр всех белков, обнаруживаемых в исследуемом образце.
В связи с этим протеомика позволяет дать характеристику количества и качественных особенностей всех индивидуальных белковых продуктов на уровне клеток, тканей и всего организма, т.е. осуществляет оценку состояния организма человека на основе исследования всего профиля присутствующих у него белков, их функций и структуры [30, 57]. Для оценки протеома используют метод идентификации белков путем анализа фрагментов, получаемых при предварительном воздействии на белки протеолитических ферментов и разделяемых с помощью микрокапиллярной жидкостной хроматографии. Подобный подход позволяет анализировать до 10 тыс. индивидуальных белков в одном образце и получать их количественную характеристику. Однако использование вышеуказанных приемов позволяет идентифицировать относительно ограниченное число белков из всех присутствующих в образцах, взятых у живых организмов (например, в образцах фекалий от здоровых взрослых людей содержится не более 20–40% общего метапротеома кишечной микробиоты). Для расширения спектра выявляемых протеинов в последнее время разработаны новые количественные методы протеомики, в т.ч. масс-спектрометрический анализ пептидов. Разновидностью протеомики является научно-аналитический подход, получивший название «интерактомика». Целью этой разновидности протеомного анализа является изучение живых клеток путем одновременного исследования молекулярных взаимоотношений всего комплекса белков, участвующих в клеточных процессах в виде совместно агрегированных мультибелковых комплексов. Интерaктомику, таким образом, следует рассматривать как важный раздел функциональной протеомики, позволяющий глубже отображать клеточный метаболизм. Данные интерактомики открывают физико-химические или функциональные взаимоотношения между компонентами живой клетки и биологических систем на различных уровнях их структурной организации [69].
Метаболомика
Методические приемы метаболомики позволяют идентифицировать и количественно оценивать максимально возможный спектр низкомолекулярных метаболических продуктов и/или компонентов клеток, присутствующих в биологическом материале человека. В результате удается создать специфический метаболический портрет и на его основании получить наиболее полную информацию о геноме, микробиоме, эпигеноме и фенотипе, а также их функциональном взаимодействии в конкретных условиях окружающей среды [35, 44, 69]. Расщепление тканевыми и микробными ферментами различных пищевых компонентов и химических соединений сопровождается формированием большого числа разнообразных низкомолекулярных конечных или промежуточных метаболитов. Количественное определение входящих в их состав соединений позволяет получать объективную информацию о фенотипической экспрессии генов, их активности, эпигеномных механизмах взаимодействия человека с окружающей средой, давать интегральную оценку внутри и межпопуляционных взаимоотношений эукариотических клеток и симбиотических микроорганизмов. Метаболомика применяет различные приемы спектроскопии, протонного ядерного магнитного резонанса, хроматографии и другие методы для идентификации и количественной оценки метаболитов в сыворотке крови, моче и других физиологических жидкостях организма человека. Эти методы позволяют устанавливать, какие исходные субстраты, их метаболиты и сигнальные молекулы участвуют в ДНК-метаболизме, ДНК-репарации, регуляции экспрессии генов, посттрансляционной модификации генных продуктов, в метаболических реакциях в клетках и во всем организме в целом.

ОМИК – технологии, используемые в последнее время без выделения чистых культур микроорганизмов для исследования генома, транскриптома и протеома всех симбиотических, в т.ч. некультивируемых, микроорганизмов, присутствующих в различных биотопах человека, получили соответственно названия «метагеномика», «метатранскриптомика» и «метапротеомика» [50, 62]. Различные ОМИК-приемы нашли применение также и для оценки функциональных эффектов пробиотических микроорганизмов [25]. Комплексное использование ОМИК- и МЕТАОМИК-технологий значительно расширяет понимание молекулярного взаимодействия симбиотической микробиоты и эукариотических клеток различных органов и тканей человека в процессах сохранения и восстановления нормального функционирования макроорганизма [37].
Биоинформатика
Основной целью и задачами биоинформатики служат хранение, анализ, объединение, распределение, моделирование и распространение биологической, генетической, протеомной, метаболомной, клинической и биомедицинской информации. Биоинформатика использует комплексные методы биомедицины совместно с приемами компьютерной техники, статистики и математики, что позволяет более детально расшифровывать механизмы, определяющие те или иные биологические феномены, генерировать новые гипотезы, визуализировать известные и новые сведения, давать им новую интерпретацию, сопоставлять гетерогенные ОМИК-данные, полученные при применении новых технологи [21, 61].
Таким образом, недавно была установлена роль симбионтной кишечной микробиоты в эпигеномике метаболического синдрома, ожирения, сахарного диабета и других патологических состояний [30].
Данные, полученные с помощью методических подходов транскриптомики, протеомики и метаболомики, позволяют лучше понять происходящие в клетках макро- и микроорганизмов процессы, способствующие стабилизации и нормальному функционированию микробиоты для оптимизации жизнедеятельности организма человека [62].
Роль микробиоты человека
Для любого макроорганизма, в т.ч. человека, характерно изменение структуры микробиоценоза кишечника в онтогенезе, связанное с явлением естественной сукцессии нормальной микрофлоры. Аутогенная сукцессия – это последовательность смены биоценоза в определенной экологической нише. В ходе этого процесса в видовом сообществе происходит вытеснение одних видов другими вследствие их биоэкологических преимуществ в определенных условиях. При этом образуется т.н. сукцессионный ряд с образованием конечного – устойчивого – биоценоза. Аутогенная сукцессия затрагивает первые два года жизни человека и проходит в 4 стадии: 1-я – до введения прикорма, 2-я – после начала прикорма, 3-я – после включения в рацион твердой пищи, 4-я – после прекращения грудного вскармливания. Помимо этого изменения в составе микрофлоры совпадают с критическими периодами развития в детском и подростковом возрасте: становлением иммунной и ферментативной систем, изменением гормонального фона, сменой пищевого рациона.
В то время как микробиоценоз взрослых людей в норме считается относительно стабильным.
Представители рода Bifidobacterium являются наиболее важным компонентом нормальной микробиоты желудочно-кишечного тракта (ЖКТ) человека как по представительству в составе микробиоценозов, так и по полифункциональной роли в поддержании большинства физиологических параметров макроорганизма. Бóльшая часть бифидобактерий находится в толстой кишке, составляя у детей более 90% всех микроорганизмов.
В норме число бифидобактерий у грудных детей составляет 1010–1011 КОЕ/г, у детей старшего возраста и у взрослых – 109–1010 КОЕ/г. Исследования видового пейзажа микробиоты здоровых детей и взрослых позволили выявить наиболее часто присутствующие в микробиоценозах кишечника виды бифидобактерий, а также продемонстрировали различия в спектре видов и в их количественном составе у лиц, относящихся к различным возрастным группам.
Род Bifidobacterium включает 32 вида. Типовой вид – Bifidobacterium bifidum. Плеоморфные грамположительные некислотоустойчивые палочки, 0,5–1,3×1,5–8 мкм (рис. 1, 2). Могут быть короткими правильной формы, тонкими с утолщенными булавовидными концами, шарообразными почти правильной формы, а также удлиненными клетками, часто окруженными фимбриями (рис. 3). Расположение клеток поодиночке, парами, V-образное, иногда в виде цепочек или розеток. Неспорооборазующие неподвижные бактерии. По строению пептидогликана клеточной стенки наиболее близки к таким грамположительным представителям микробиоты, как лактобациллы.

Бифидобактерии относятся к анаэробным микроорганизмам, не способным расти на поверхности питательных сред в присутствии кислорода. Могут расти в атмосфере воздуха, обогащенного 10%-ным СО2. Оптимальная температура для роста – 37–41°С, минимальная – 25–28°С, максимальная – 43–45°С. Оптимальные значения рН составляют 6,5–7,0. Хемоорганотрофы ферментируют углеводы с образованием уксусной и молочной кислот с выделением СО2. Для роста на питательных средах нуждаются в добавлении витаминов, в частности С. Каталазоотрицательные, в редких случаях, например при росте в атмосфере воздуха с добавлением СО2, – каталазоположительные. Идентификация бифидобактерий до вида требует применения специальных методов, создающих условия анаэробиоза, при которых исследуют особенности их метаболических реакций.
Идентификация видов бифидобактерий считается проблематичной вследствие их фенотипической и генотипической гетерогенности. Наиболее часто в ЖКТ человека выявляют B. bifidum, B. longum, B. adolescentis, B. breve, B. infantis, B. animalis, В. саtenulatum, B. pseudocatenulatum и др. Бактерии B. animalis и B. lactis объединены в один вид с подвидами B. animalis subsp. lactis и B. animalis subsp. аnimalis [65]. Японскими исследователями для характеристики бифидобактерий была использована полимеразная цепная реакция (ПЦР) с видоспецифическими праймерами для генов 16S рРНК, выявляющих нуклеотидные последовательности, консервативные для 10 видов бифидобактерий: В. 1оngum, B. infantis, B. dentium, В. gallicum, В. аdoslescentis, В. аngulatum, B. bifidum, В. breve, В. саtenulatum и B. pseudocatenulatum. Был изучен видовой состав бифидобактерий, содержащихся в экстрактах фекалий, полученных от 27 грудных младенцев и 48 здоровых взрослых. У взрослых наиболее часто регистрировали в пробах В. саtenulatum (92%), затем следовали В. 1оngum и В. аdoslescentis, в то время как у детей – В. breve, В. infantis и В. 1оngum [47].
В Российской Федерации (РФ) с помощью ПЦР была проведена идентификация 77 изолятов бифидобактерий, выделенных из фекалий 28 детей раннего возраста. Удалось идентифицировать 63 изолята, из которых 28 (71,1%) были представлены B. longum, 23 (53,5%) – B. bifidum, 6 (17,9%) – B. catenulatum, 5 (14,4%) – B. breve и 1(3,6%) – B. dentium. Виды B. infantis, B. adolescentis и B. angulatum не обнаружены [22].
При исследовании 70 штаммов бифидобактерий, выделенных при зубном кариесе, выявлены B. dentium и два новых вида бифидобактерий. Морфологические характеристики, биохимические свойства, потребности в питательных субстратах, электрофоретические спектры белков, данные гибридизации ДНК и содержания Г+Ц пар оснований ДНК этих микроорганизмов показали, что две группы штаммов принадлежат к новым видам бифидобактерий, обозначенных как B. inopinatum и B. denticolens [31].
Исследование микробного пейзажа детей и взрослых показало, что бифидобактерии в кишечнике здорового человека представлены сразу несколькими видами, каждый из которых имеет свои биохимические и физиологические особенности. Клетки вида B. bifidum выявляют у здоровых людей всех возрастных групп; у детей на грудном вскармливании он является преобладающим и выделяется у 70% обследованных, до 40% – у детей 4–6 лет и до 15–20% – у взрослых [49]. Вид B. longum также характерен для детей и взрослых и выделяется у 40–60% детей первого года жизни, у 70–75% детей старшего возраста и взрослых людей среднего возраста; у пожилых людей его выделяют в 30% случаев. Вид B. adolescentis свойствен взрослым людям и детям старшего возраста и обнаруживается у них в 60–65% случаев. Этот вид становится преобладающим у пожилых людей (85%). Виды B. infantis и B. breve, B. animalis и их подвиды обнаруживают преимущественно у детей грудного возраста [16]. Указанные виды бактерий характерны для детей и взрослых различных рас и географических мест проживания населения с небольшим разнообразием энтеротипов, зависимых от вида потребляемых пищевых продуктов.
Наряду с бифидобактериями важная роль в поддержании симбиотических отношений между макроорганизмом и его микробиотой, а также в регуляции межмикробных взаимоотношений принадлежит бактериям рода Lactobacillus, заселяющим организм новорожденного ребенка в раннем постнатальном периоде. Лактобациллы, присутствуя во всех отделах пищеварительного тракта, начиная с полости рта и заканчивая толстой кишкой, являются доминирующей нормальной микробиотой влагалища, выявляются также в грудном молоке. В полости рта здоровых людей обнаруживают, как правило, 7 видов лактобацилл. В желудочном соке общее число лактобацилл может достигать 103 КОЕ/мл, в содержимом тощей кишки – 104, подвздошной кишке – от 102 до 105, а в фекалиях – от 106 до 1010 КОЕ/мл в зависимости от возраста.
Позитивная роль микробиоты состоит в обеспечении колонизационной резистентности ЖКТ, иммуномодулирующем, антимутагенном и антиканцерогенном действиях, участии в метаболических процессах, регуляции роста эпителиоцитов, защите слизистой оболочки от повреждений и регуляции местной толерантности [5, 6, 16, 19, 20].
Нарушение микробной экологии кишечника принято обозначать термином «дисбактериоз». Согласно ОСТу Минздрава РФ, «дисбактериоз кишечника – это клинико-лабораторный синдром, возникающий при ряде заболеваний, характеризующийся изменением качественного и количественного состава нормофлоры, а также метаболическими и иммунными нарушениями, сопровождающимися у части пациентов поражением кишечника, транслокацией бактерий в несвойственные биотопы и их избыточным ростом» [15].
Известно, что увеличение числа лиц с иммунодефицитными состояниями ведет к росту инфекционных заболеваний, вызываемых условно-патогенными микроорганизмами. Увеличение заболеваемости тесным образом связано с широким распространением микроэкологических нарушений в кишечнике, неуклонным ростом числа больных, страдающих хроническими воспалительными заболеваниями ЖКТ, включая гастриты, язвенную болезнь желудка и двенадцатиперстной кишки, панкреатиты, гепатиты и холециститы, а также воспалительные процессы урогенитального и респираторного трактов [1, 3, 8]. Определенное значение имеют микроэкологические нарушения при атеросклерозе, астме, бесплодии, ожирении, подагре, остеохондрозе, поражении суставов, остеопорозе, диабете и некоторых онкологических заболеваниях, сопровождающихся дисбиозами [7, 18, 67]. Положение о том, что в основе многих хронических патологических процессов лежит воспаление, срыв оральной толерантности и цитокиновый дисбаланс, в последнее десятилетие широко обсуждается на различных медицинских форумах и симпозиумах. Решение этой проблемы тесно связано с развитием новых научных технологий в области исследования состава и функций микробиоты организма, относимой к «надорганизму», а также разработкой более совершенных и эффективных пробиотических препаратов.
Результаты расшифровки геномов макро- и микроорганизмов показали, что геном человека содержит нуклеотидные последовательности, характерные более чем для 200 бактериальных генов, а также для 500 видов ретровирусов, которые, очевидно, заимствованы у микроорганизмов в процессе филогенеза. Благодаря координированной работе эволюционно сложившихся систем регуляции симбиоза осуществляется согласованное взаимодействие генов эукариотических клеток и геномов многочисленных симбиотических микроорганизмов. Процесс регуляции внутрипопуляционного информационного обмена бактериальных клеток между собой получил название «Quorum Sensing» (QS) – Чувство Кворума, и представляет собой специфический вариант глобальной регуляции экспрессии генов, т.е. механизм, посредством которого микроорганизмы способны осваивать окружающую среду, в т.ч. и человеческий организм [33]. Взаимодействие друг с другом и с клетками хозяина происходит через низкомолекулярные сигнальные молекулы, называемые аутоиндукторами. Благодаря аутоиндукторам бактерии обмениваются информацией и координируют свою деятельность. Исследования последних лет показали, что микроорганизмы синтезируют и распознают широкий спектр аутоиндукторов различной химической природы [36].
Важно выявление сигнальных молекул, стимулирующих рост и развитие биопленок собственных индигенных микроорганизмов, зависимое от функции QS-системы, контролирующей плотность популяции в биотопе. Определенное значение имеет и мишень-опосредованный способ доставки лекарственных форм пробиотиков, получивший обозначение как таргетированный (от англ. слова target – мишень). Возможно, познание методов управления единой симбионтной системой «микробиота–макроорганизм» в будущем будет иметь первостепенное значение в плане укрепления здоровья человеческой популяции и оптимального продления долголетия [20, 25, 64, 67, 69].
Следует отметить, что многие гнойно-воспалительные инфекции часто возникают у пациентов со сниженной иммунологической резистентностью макроорганизма. Больные обращаются за медицинской помощью и поступают в различные стационары, как правило, уже со сформированными микроэкологическими нарушениями. Микробиота таких лиц находится в состоянии нового ассоциативного симбиоза. Полагают, что в этом процессе на фоне утраты способности организма различать «свой–чужой» осуществляется замена биопленок индигенной микрофлоры организма хозяина на смешанные полимикробные биопленки условно-патогенных микроорганизмов. В результате такой трансформации формируется локальный инфекционный очаг, который впоследствии может перейти в генерализованную форму путем трансинтестинальной транслокации микроорганизмов и их токсинов в лимфатическое и кровеносное русла с возникновением дополнительных очагов инфекционного процесса и суперинфекций различной локализации. Наиболее часто очаги эндогенной инфекции формируются в кишечном, урогенитальном и респираторном трактах и обусловлены полиантибиотикорезистентными штаммами бактерий родов Staphylococcus Enterococcus, Klebsiella, Escherichia, Enterobacter, Citrobacter, Hafnia, Serratia, Providencia, Morganella, Proteus, Pseudomonas, Acinetobacter, Streptococcus, грибами родов Candida и Geotrichium. Наиболее тяжело протекают эндогенные инфекционные процессы, возникающие на фоне такой основной соматической патологии, как опухоли, спаечная болезнь кишечника, нейроэндокринная и генетическая патология с выраженными вторичными иммунодефицитами. Возможно сочетание микстинфекции с наличием микологических, глистных и паразитарных заболеваний у лиц с лучевой болезнью и при суперинфекциях (хламидиоз, микоплазмоз, уреаплазмоз, герпес-, рота-, корона- и цитомегаловирусная инфекции, вирусные гепатиты, туберкулез и сифилис). Поэтому в случае обнаружения полирезистентных бактериальных ассоциаций условно-патогенных микроорганизмов больным рекомендуется проведение дополнительных целевых микробиологических, вирусологических, иммунологических и паразитологических исследований для исключения вышеуказанных суперинфекций, паразитозов и различных иммунодефицитных состояний, что в большинстве случаев позволяет провести правильную диагностику, адекватное лечение основных заболеваний и сопутствующих микроэкологических нарушений. Усугубление заболевания может произойти при проведении этиотропной химиотерапии, подавляющей нормальную микробиоту. На фоне микроэкологических нарушений могут проявляться признаки аллергии, атопического дерматита и нейродермитов, степень выраженности которых в разных случаях может быть различной.
Для восстановления нарушений структуры микробиоценоза открытых полостей организма применяют препараты, подразделенные на про-, пре-, синбиотики и метабиотики [8, 11]. Пробиотики – это живые микроорганизмы, оказывающие при естественном способе введения позитивные эффекты на физиологические, биохимические и иммунные реакции организма хозяина через стабилизацию и оптимизацию функции его нормальной микрофлоры. Аналогичную дефиницию предложили и эксперты Всемирной организации здравоохранения: «пробиотики – это живые микроорганизмы, которые при употреблении в необходимом количестве оказывают благоприятное воздействие на здоровье организма-хозяина».
Пребиотики – это препараты немикробного происхождения, способные оказывать позитивный эффект на организм хозяина через селективную стимуляцию роста или метаболической активности нормальной микрофлоры кишечника. В эту группу входят препараты, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством – стимулирововать рост нормальной микрофлоры кишечника. Синбиотики – это препараты, полученные путем рациональной комбинации пробиотиков с пребиотиками. Ряд синбиотиков можно позиционировать как пробиотические биологически активные добавки (БАД), содержащие живые бактерии определенных видов и различные полезные для поддержания здоровья человека ингредиенты. Метабиотики – препараты, содержащие микробные метаболиты, которые в совокупности с компонентами бактериальных поверхностных и цитоплазматических структур, ДНК и органическими кислотами оказывают лечебный эффект путем нормализации состава микробиоты кишечника и восстановления водно-электролитного баланса организма хозяина.
Механизм действия пробиотических препаратов
Пробиотические бактерии могут оказывать комплексное многоуровневое воздействие на организм человека. Однако наиболее важную роль играют адгезивная и антагонистическая активность пробиотических бактерий ЖКТ, их способность колонизировать слизистую оболочку, что в большей степени определяет длительность персистенции интродуцента при его пероральной аппликации.
Роль адгезинов для разных микроорганизмов выполняют различные поверхностные структуры: капсулы, фимбрии, а также компоненты клеточной стенки: антигены белковой или полисахаридной природы, липотейхоевые кислоты, фосфолипиды и др. Благодаря адгезии бактерии способны удерживаться в определенной экологической нише, что обеспечивает возможность эффективной колонизации слизистой оболочки симбионтами. Следовательно, одним из способов предотвращения колонизации кишечника патогенами является подавление их прикрепления путем насыщения эпителиальных рецепторов лигандами адгезии симбионтных микроорганизмов. Адгезия лактобацилл и бифидобактерий к кишечному эпителию происходит за счет поверхностных структур – фимбрий и компонентов клеточной стенки белковой природы, а также липотейхоевой кислоты. Антагонистическое действие пробиотических бактерий связано с продукцией органических кислот, бактериоцинов, образованием короткоцепочечных жирных кислот (КЖК), перекиси водорода и диацетила. Органические кислоты (молочная, уксусная, масляная, пропионовая, изомасляная, изовалериановая, муравьиная, сукциниловая, янтарная и др.) являются конечным продуктом метаболизма, экскретируемым в окружающую среду. Антимикробный эффект молочной и уксусной кислот достаточно хорошо изучен: они проникают через мембрану, выделяют ионы гидроокиси в нейтральную цитоплазму, что приводит к подавлению жизненных функций клетки [2]. Так, уксусная кислота при рН выше 4,5 проявляет более выраженный, чем молочная кислота, ингибирующий эффект и, наоборот, при рН ниже 4,0 наиболее сильная антимикробная активность отмечена у молочной кислоты. Положительное антагонистическое влияние оказывает перекись водорода и диацетил, эти вещества обладают антимикробной активностью по отношению к широкому кругу патогенных и условно-патогенных микроорганизмов.
Важную роль при проявлении пробиотических свойств микробиоты играют бактериоцины – биологически активные вещества белковой природы, выделяемые самими бактериями, как правило, при антагонистическом воздействии на другие бактерии [58]. Известно два типа бактериоцинов: высокомолекулярные белки, подавляющие в основном близкородственные виды бактерий, обитающие в той же экологической нише, и низкомолекулярные антимикробные пептиды, характеризующиеся широким спектром антагонистической активности [59]. Лактобациллы, бифидобактерии и энтерококки также необходимы для активации фагоцитарной и цитостатической активности макрофагов, стимуляции лимфоидной ткани, воздействия на иммунокомпетентные Т- и В-клетки. Вырабатывающиеся в кишечнике иммуноглобулины (Ig) включаются в сложный механизм контроля кишечных микроорганизмов, в т.ч. и патогенных, осуществляемый путем блокирования прикрепления их к эпителию слизистой оболочки, нейтрализации путем агглютинации, бактериостаза и других бактерицидных механизмов с последующей их элиминацией из кишечника.
Предполагают, что секреторные иммуноглобулины выполняют ответственную роль в местном иммунитете кишечника: IgA-1 антитела за счет тяжелых цепей, имеющих химическое сродство с мукозой, обеспечивают формирование монослоя Ig на поверхности слизистой оболочки. Иммуноглобулины субкласса IgA-2, не имея родства со слизистой оболочкой, поступают в просвет кишечника и действуют как первое звено иммунной защиты, при этом лактобациллы и бифидобактерии в отличие от эшерихиозной микрофлоры, как правило, не покрыты иммуноглобулинами. Показано, что пробиотические препараты способствуют значительному увеличению относительного и абсолютного числа В-лимфоцитов при снижении относительного и абсолютного числа Т-лимфоцитов. Важная роль микрофлоры в развитии иммунного ответа обусловлена ее универсальными иммуномодулирующими свойствами, включающими как иммуностимуляцию, так и иммуносупрессию [7, 52, 57].
Пробиотические комплексы
В настоящее время пробиотики выпускают в различных фармацевтических формах:
- лиофильно высушенная биомасса бактерий во флаконах или ампулах;
- лиофильно высушенная биомасса бактерий в желатиновых капсулах и капсулах, покрытых кишечнорастворимой оболочкой;
- жидкая суспензия живых пробиотических бактерий;
- суппозитории ректальные и вагинальные с лиофильно высушенной биомассой;
- лиофильно высушенная биомасса бактерий, прессованная в таблетки, покрытые растворимой в кишечнике оболочкой;
- лингвальные таблетки, рассасываемые под языком.
Следует отметить, что пробиотики, содержащие лиофильно высушенную биомассу, сохраняют свои свойства при значительно большем сроке хранения, чем жидкие суспензии. В настоящее время производственные штаммы бактерий, входящие в состав пробиотических препаратов, предложено характеризовать по наличию факторов адаптации и пробиотической активности, а также дополнять информацией о степени выраженности иммуномодулирующих свойств и спектром восстанавливаемых регуляторных метаболических функций макроорганизма, включая нормализацию процессов электролитного обмена, окислительного фосфорилирования и регенерацию поврежденных клеток.
За адаптацию интродуцента ответственны факторы, позволяющие бактериям прикрепляться к эпителию и колонизировать слизистую оболочку кишечника, конкурируя с биопленкой индигенной микрофлоры, что непосредственно связано со сроками их персистенции, длительностью поддержания микробного баланса нормальной микрофлоры и обеспечения временной защиты энтероцитов и колоноцитов от повреждения [7, 46]. К факторам, участвующим в процессе адаптации, следует относить адгезины, органические кислоты, бактериоцины, а также регуляторы, ответственные за биопленкообразование и сигнальные молекулы системы QS-системы [42, 48, 53, 54].
Пробиотическая способность связана с локальной конкуренцией/кооперацией в отношении нутриентов, активацией синтеза антимикробных факторов слизистой оболочки, восстановлением межмикробных коммуникаций и иммуномодулирующим действием. К факторам пробиотической активности интродуцента можно отнести биомолекулы различных белков, пептиды, ДНК и оригинальные метаболиты, включая КЖК, способствующие активизации микробиоты [3–6, 17, 29, 32, 41].
Указанные характеристики в совокупности обеспечивают клинический эффект пробиотических бактерий, связанный с процессом восстановления микроэкологических нарушений и локального природного иммунитета кишечного биотопа, задействованных в подавлении роста условно-патогенной микрофлоры и усилении защитного транслокационного барьера слизистой оболочки от проникновения во внутреннюю среду различных бактерий и их токсинов, включая эндотоксины – липополисахариды (ЛПС).
Производственные штаммы пробиотиков
Пробиотические штаммы лактобактерий. Одним из наиболее широко применяемых для изготовления пробиотических комплексов, содержащих лактобациллы, является штамм Lactobacillus rhamnosus GG (LGG), селекционированный американскими исследователями S. Gorbach и В. Goldin.
В доклинических исследованиях установлено отсутствие у этих бактерий способности вызывать инфекционный процесс, негативные изменения метаболической активности, чрезмерную иммунную стимуляцию у добровольцев и перенос генов in vitro. Показано, что перорально вводимые LGG сохраняются в кишечнике до одной недели. В настоящее время LGG – один из самых изученных штаммов в мире (более 400 публикаций и 14 рандомизированных двойных слепых плацебо-контролируемых исследований [26, 39]). Однако недавно при сравнении нуклеотидных фрагментов геномов бактерий L. rhamnosus GG и L. rhamnosus LC705 показано, что штаммоспецифические гены обоих штаммов (80 для LGG и 72 для LC705) входят в состав 5 и 4 геномных «островов» соответственно. Геномные «острова» LGG включали гены бактериофагов, транспорта углеводов и синтеза экзополисахаридов. Только у бактерий LGG один из «островов» кодировал синтез трех LPXTG-подобных муцин-связывающих белков пилей адгезии (spaCBA) и пилин-ассоциированной сортазы [40]. Наличие у LGG муцин-связывающих белков пилей адгезии обеспечивает прикрепление и колонизацию бактериями слизистой оболочки кишечника. Ранее показано, что лактобациллы штамма LGG синтезируют органические кислоты, бактериоциноподобные и иммуномодулирующие вещества, а также ферменты, способствующие пищеварению и улучшению обмена веществ. Препараты, содержащие LGG, применяют в комплексном лечении больных неспецифическим язвенным колитом, соматическими заболеваниями, осложненными дисбактериозами. Для лиц, перенесших острые кишечные инфекции, при наличии дисфункций кишечника в случае выделения патогенной и условно-патогенной микрофлоры штамм LGG назначают для быстрого восстановления оптимального значения рН в кишечнике. Клинический эффект LGG показан при терапии некротизирующего энтероколита, различных воспалительных процессах в кишечнике, псевдомембранозном колите, вызванном Clostridium difficile на фоне эрадикации Helicobacter pylori, а также при ротавирусной инфекции и атопическом дерматите у детей [14]. При использовании L. rhamnosus GG и B. lactis BВ12 наблюдали подавление транслокации микроорганизмов и их токсинов из просвета кишечника во внутреннюю среду организма; cтимуляцию и усиление иммунного ответа; снижение местной воспалительной реакции; доставку микробной лактазы в тонкую кишку; деконъюгирование желчных кислот [7, 12, 42].
Пробиотические штаммы B. lactis BB12 и Streptococcus thermophilus TH4. Комбинацию пробиотических бактерий B. lactis BB12 и S. thermophilus TH4 применяют в молочной индустрии с 1984 г. Указанные штаммы с 2002 г. разрешены к употреблению детям раннего возраста. За 25 лет использования данной комбинации штаммов не было получено данных о непереносимости этих бактерий и побочных эффектах. Бактерии B. lactis ВВ12 продуцируют антибиотикоподобные субстанции, совместимые с индигенной бифидофлорой, а также усиливают в биотопе синтез секреторных IgA антител. Штамм B. lactis ВВ12 имеет статус GRAS (Generally Regarded as Safe) и безопасен при использовании с момента рождения ребенка. Интересно наблюдение о том, что адгезивная и колонизирующая активность B. lactis BB12 усиливается в присутствии бактерий S. thermophilus TH4, эффективных при лактазной недостаточности [41].
Пробиотические штаммы энтерококков. Энтерококки относятся к представителям нормальной микробиоты человека. Эти бактерии – одни из первых колонизируют ЖКТ ребенка, в норме обнаруживаются во всех отделах кишечника здоровых людей всех возрастов и используются при изготовлении пищевых продуктов и пробиотических комплексов [56]. В то же время бактерии Enterococcus faecalis и Enterococcus faecium, несущие гены вирулентности, при снижении резистентности организма нередко вызывают серьезные энтерококковые гнойно-воспалительные заболевания человека [9]. Потенциальная патогенность (вирулентность) энтерококков вызывает существенную озабоченность в плане безопасности их практического применения. Под патогенностью возбудителей заболеваний принято понимать их способность вызывать инфекционный процесс, вирулентность является степенью патогенности определенного штамма микроорганизмов. Нами методом ПЦР исследованы три штамма E. faecium, входящих в состав пробиотических препаратов Линекс (Лек, Словения), Бифиформ (E. faecium SF68, Ферросан, Дания) и Ламинолакт (E. faecium L-3, Авена, Россия). При сравнительном анализе с патогенными клиническими штаммами в геноме всех трех пробиотических культур E. faecium ни одного из восьми тестируемых генов вирулентности, контролирущих синтез адгезинов asa1, esp, efaA, цитолизинов cylA, cylM, протеолитических ферметов (желатиназы – gelE и сериновой протеиназы – spr) и fsr-регулятора, обнаружить не удалось, что подтверждает данные об их безопасности [9].
E. faecium SF68 – один из наиболее изученных пробиотических штаммов, и его безопасность многократно подтверждалась в различных исследованиях. Так, производитель штамма E. faecium SF68 – компания Christian Hansen A/S, сообщает, что данный штамм изначально выделен из испражнений человека и не подвергался никаким генным модификациям. Кроме того, для E. faecium SF68 определены минимальные подавляющие концентрации (МПК) 12 антибиотиков, которые сравнивали с установленными EFSA (European Food Safety Authority) граничными значениями. Ни одна из МПК для E. faecium SF68 не превышала установленные EFSA контрольные значения, на основании чего данный штамм E. faecium SF68 считается чувствительным ко всем трестировавшимся антибиотикам, в частности к ванкомицину (МПК 1,0 мкг/мл на среде Мюллера–Хинтона при использовании Etest System от компании AB Biodisk, Швеция) [13].
Таким образом, клетки штамма E. faecium SF68 не обладают устойчивостью к ванкомицину и другим 11 антибиотикам, а также не содержат гены вирулентности (см. выше).
В ряде работ показано, что совместное применение штамма E. faecium SF68 с различными антибиотиками приводит к положительному эффекту, предотвращая диарею и другие нежелательные проявления функционирования ЖКТ [10, 68, 27]. Кроме того, безопасность этого штамма подтверждена тем, что он включен в рекомендации Всемирной гастроэнтерологической организации по применению про- и пребиотиков с высокими уровнями доказательности (лечение острой диареи и профилактика антибиотик-ассоциированной диареи у взрослых – 1b) [67].
В данный момент в научном сообществе продолжается дискуссия, связанная с безопасностью пробиотических штаммов энтерококков и их применения у детей. В 2014 г. общество ESPGAN (The European Society for Paediatric Gastroenterology Hepatology and Nutrition – Европейское общество по детской гастроэнтерологии, гепатологии и питанию) не рекомендовало использование E. faecium SF68 у детей для лечения острого гастроэнтерита [63], несмотря на ряд клинических исследований с положительными результатами. В тексте своей рекомендации рабочая группа ссылается на одно исследование in vitro, в ходе которого, по их мнению, была показана возможность восприятия клетками E. faecium SF68 генов устойчивости к ванкомицину. Однако в указанном исследовании 2001 г. работа проводилась с совершенно другим штаммом энтерококков [45]. Напротив, исследования в идентичных условиях, проведенные с клетками E. faecium SF68, показывают, что данный штамм является плохим преемником генов устойчивости от других микроорганизмов [66]. Кроме того, в 10-суточном эксперименте по совместному культивированию E. faecium SF68 с ванкомицинустойчивыми E. faecium DSM13590 F. Verholen и соавт. не обнаружили передачи генов устойчивости от одного штамма к другому.
Приведенные данные подтверждают, что не все штаммы пробиотических энтерококков одинаковы и не все имеют одинаковый профиль безопасности. Штамм E. faecium SF68 наиболее изучен и в различных исследованиях показал свою безопасность и эффективность: отсутствие устойчивости к ванкомицину, отсутствие генов вирулентности, отсутствие восприимчивости генов устойчивости к ванкомицину. Безопасность и эффективность штамма также подтверждены многочисленными клиническими исследованиями и длительным опытом применения в составе различных пробиотических комплексов на рынке России и Европы.
При анализе опроса врачей-специалистов РФ, назначающих пробиотики, большинство отмечали принципиальную важность индивидуального подхода к каждой возрастной категории страдающих дисбактериозом пациентов. То есть бактериальные штаммы нормальной микробиоты должны максимально соответствовать возрастным физиологическим нормам. Не менее важным, особенно для детей, респонденты считали форму выпуска пробиотиков [1].
Форма выпуска особенно важна для детей первого года жизни, т.к. они, обладая ограниченным размером желудка, не могут потреблять большое количество жидкости. В связи с этим разработаны жидкие формы пробиотических препаратов в небольшой дозировке – в специально адаптированном варианте для детей раннего возраста, что удобно как для самих детей, так и для их родителей.
Ряд клиницистов отмечают, что эффект пробиотикотерапии зависит от того, какой штамм и какого вида бактерии взяты за основу пробиотика, какова форма применяемого препарата и метод его введения в организм пациента, а также максимальное соответствие вида пробиотического штамма возрастным физиологическим нормам. Кроме того, эффект пробиотикотерапии определяется также иммунным статусом пациента, нозологией заболевания, остротой течения процесса. Применение пробиотиков можно сочетать с назначением иммуномодулирующих препаратов, поскольку весьма различны причины развития дисбактериоза, его характер и степень выраженности, клинические проявления, состояние иммунной системы, условия для развития гнойно-воспалительных инфекций.
В связи с наличием выраженных конкурентных взаимоотношений за рецепторы адгезии между пробиотическими бактериями интродуцируемого препарата-пробиотика и дисбиозными условно-патогенными бактериями при сформировавшихся стойких очагах эндогенной и экзогенной инфекции пробиотикотерапия может не дать заметных положительных результатов из-за невозможности дезорганизации бактериальной биопленки ассоциантов-возбудителей воспалительного процесса. В этом случае могут возникать рецидивы, требующие индивидуальной коррекции нарушения нормальной микробиоты пациента.
В связи со сложностями определения этиопатогенеза дисбактериоза кишечника для коррекции микроэкологических нарушений применяют комплексное лечение, направленное в первую очередь на ликвидацию и санацию всех выявленных первичных и вторичных очагов эндогенной и экзогенной инфекции. Комплекс лечебных мероприятий должен быть направлен на восстановление физиологических функций и структуры поврежденных органов и систем пациента (в частности, коррекция моторной, секреторной и пищеварительной функций кишечника, энтеросорбция, энтеропротекция и т.д.), а также на оптимизацию работы иммунной системы и на восстановление витаминно-минерального баланса, функционального питания и т.д.
В последнее время в связи с неблагоприятной социально-экономической и экологической обстановкой повсеместно наблюдается не только широкое распространение дисбактериозов и вторичных иммунодефицитов, но и высокий уровень аллергизации населения. Дисбактериозы, аллергизация и иммунодефицитные состояния существенно влияют на длительность и тяжесть острых, и хронических воспалительных инфекций, они также усложняют и удорожают диагностику и лечение основных заболеваний. Такие патологические состояния можно рассматривать как инфекционно-аллергические заболевания, возникающие в результате патогенного воздействия на организм человека целых ассоциаций дисбиозных микроорганизмов, что, как правило, приводит к доминированию инфекционной составляющей.
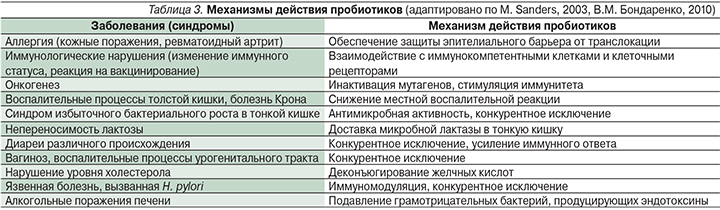
При практическом применении пробиотиков возникает ряд вопросов: (1) связан ли эффект их воздействия с приживлением пробиотических бактерий на слизистой оболочке кишечника; (2) обладают ли биологической активностью метаболиты пробиотических бактерий; (3) связано ли эффективное действие пробиотиков с их иммуномодулирующей активностью; (4) нужна ли для реализации действия пробиотиков их способность взаимодействовать с Toll-подобными рецепторами (TLR – Toll-like receptors); (5) существует ли зависимость наблюдаемого клинического эффекта от свойств пробиотического штамма? На все эти вопросы можно дать положительный ответ. Наиболее допустима ситуация, когда после введения через ротовую полость живые пробиотические бактерии приживаются на слизистой оболочке кишечника и тем самым достигается нормализация кишечной микробиоты. Позитивное воздействие пробиотических бактерий на организм может быть связано с конкуренцией за рецепторы адгезии на кишечном эпителии, подавлением роста патогенов за счет синтеза различных антимикробных веществ, ингибированием транслокации микроорганизмов и их токсинов из просвета кишечника в кровоток. Биологической активностью обладают также метаболиты пробиотических бактерий, эффективное действие пробиотиков связано с их иммуностимулирующей активностью. Показано, что для реализации модулирующего действия пробиотиков необходим контакт их лигандов (агонистов) с TLR. При этом контакт может быть обусловлен как живыми бактериальными клетками, так и их структурными компонентами. Интенсивность позитивного эффекта пробиотика в значительной мере зависит от его видовой и штаммовой принадлежности, в первую очередь от его способности к адгезии и временной колонизации слизистой оболочки, спектра антагонистической активности, взаимодействия с TLR и последующей активации врожденного иммунитета. Интенсивность воздействия на организм человека может изменяться в связи с различиями иммуномодулирующих свойств у отдельных пробиотических штаммов, что включает повышение уровня параметров Т- и В-клеточного иммунитета, увеличение авидности антител сыворотки крови к связыванию антигенов условно-патогенных бактерий и их токсинов. Механизмы действия пробиотиков детально обсуждены в обзорах [4, 60, 64] и систематизированы в табл. 3.
Следует подчеркнуть, что пробиотическая концепция является на сегодняшний день ведущей при назначении бактерийных препаратов. При этом наибольшую эффективность в клинической практике демонстрируют лекарственные препараты и биологически активные добавки к пище на основе комбинаций нескольких видов или штаммов пробиотических микроорганизмов, приближенных по составу к естественному и соответствующему определенному возрасту микробиоценозу и обладающих широким спектром антагонистической активности в отношении условно-патогенных бактерий и грибов.
Таким образом, прогнозируемый терапевтический и профилактический эффекты пробиотических препаратов определяются сроками, степенью стабилизации и спектром восстановления индивидуальных регуляторных функций макроорганизма, включая нормализацию микробиоценоза, иммунологических реакций, процессов электролитного обмена, окислительного фосфорилирования и регенерации поврежденных клеток. Именно поэтому большое значение имеет научное обоснование эффекта воздействия пробиотика с помощью таких новых технологий, как геномика, протеомика, метаболомика, транскриптомика. Совершенно очевидно, что от степени изученности, в т.ч. и с помощью новых научных технологий пробиотических штаммов, а также реакции на них организма человека, зависит успех в лечении таких сложных, вызванных дисбактериозами патологических состояний, как хронические инфекции, вторичные иммунодефициты, повышенная аллергизация, а также ряда метаболических заболеваний, включая атеросклероз, липидный дистресс-синдром, диабет 2 типа и ожирение.



