Введение
Преэклампсия (ПЭ), или гестоз, – это тяжелое осложнение беременности, проявляющееся клинически впервые выявленными гипертензией и протеинурией после 20 недель беременности, существенно повышающее материнскую и младенческую заболеваемость и смертность. Согласно различным статистическим данным, частота этого осложнения варьируется в различных регионах мира от 5 до 18%. В России гестоз занимает третье место в структуре материнской смертности, уступая лишь экстрагенитальным заболеваниям и кровотечениям. Перинатальная смертность при гестозе превышает средние показатели в 5–7 раз [6, 15].
На сегодняшний день не вызывает сомнений, что гестоз является поли-этиологическим, или мультифакторным, процессом и существует ряд возможных путей его развития, которые сходятся на этапе развития эндотелиальной дисфункции, определяющей клинику заболевания. В последнее десятилетие выявлен ряд биохимических маркеров, характеризующих процесс формирования плаценты, которые выполняют роль диагностических предикторов развития гестоза (преэклампсии) [7, 12, 13]. Возможность определения показателей ангиогенеза плаценты позволяет условно разделять риск развития ранней и поздней ПЭ. Нарушение ангиогенеза плаценты приводит к неполной инвазии трофобласта в спиральные артерии матки, и как правило, приводит к раннему началу и тяжелому течению гестоза (преэклампсии). При наличии у пациентки ранее существовавшей эндотелиальной дисфункции, имеющейся при ряде экстрагенитальных заболеваний, но при условии благоприятного ангиогенеза плаценты гестоз развивается, как правило, в более поздние сроки и протекает в более легкой форме [8]. Очевидно, что наиболее неблагоприятное течение гестоза можно ожидать при сочетании плацентарного и материнского пути развития эндотелиальной дисфункции [14].
С учетом крайней опасности гестоза (преэклампсии) для жизни матери и плода весьма актуальна акушерская проблема поиска методов профилактики этого осложнения и даже незначительное снижение частоты и тяжести ПЭ на фоне предпринимаемых профилактических мер следует считать большим успехом [9]. Отмечается, что профилактика ПЭ может быть первичной, вторичной или третичной. Первичная профилактика подразумевает не рекомендовать беременность пациенткам высокого риска, улучшать образ жизни и нутриентный состав пищи всем беременным. Вторичная профилактика предполагает прерывание патогенетических процессов развития ПЭ до начала клинических проявлений. Для осуществления эффективной вторичной профилактики необходимы знание патогенеза заболевания, возможность определения предикторов (лабораторных маркеров, предшествующих клинике), а также наличие медикаментозных средств, способных эффективно тормозить патогенетический путь развития заболевания.

Третичная профилактика основана на лечении уже возникшей ПЭ для избежания ее прогрессирования и развития угрожающих жизни состояний [11].
На сегодняшний день наиболее доказанным, значимым медикаментозным средством профилактики ранней ПЭ является аспирин. Недавний мета-анализ убедительно показал, что применение низких доз аспирина, начатое до 16 недель беременности, существенно снижает частоту развития ПЭ у беременных с высоким и средним риском ее развития [10]. Вместе с тем, поскольку гестоз является мультифакториальным процессом, профилактика и лечение эндотелиальной дисфункции у беременных с экстрагенитальной патологией представляется неотъемлемой частью комплексной профилактической терапии.
Базовой профилактикой развития гестоза у пациенток с экстрагенитальной патологией, подразумевающей наличие эндотелиальной дисфункции (хроническая артериальная гипертензия, ожирение, нарушение углеводного и липидного обменов, заболевания мочевыделительной системы) является назначение поливитамино-минерального комплекса, препаратов магния и прогестерона [1].
Профилактическое действие комплексных витамино-минеральных препаратов в отношении гестоза осуществляется за счет целого спектра благоприятных воздействий на эндотелий. Достигается коррекция нутриентной недостаточности микроэлементов; коррекция уровня гомоцистеина за счет комплекса витаминов В и фолиевой кислоты в требуемом для этой цели количестве. Осуществляется создание благоприятных условий для развития трофобласта благодаря непрерывному поступлению витаминов Е и А. Кроме того, сбалансированное и достаточное количество витаминов и микроэлементов, в первую очередь А, С и Е, оказывает существенную поддержку антиоксидантной системе беременных, нарушения в которой служат одной из основных причин развития эндотелиальной дисфункции [5]. Магний оказывает комплексное воздействие на систему гемостаза. Он имеет эндотелиопротекторное действие, проявляющееся в активации выработки простациклина и NO и подавлении тромбоксана TxA2. Кроме того, магний опосредует уменьшение внутрисосудистой агрегации тромбоцитов, участвует в опорно-сократительной системе тромбоцита за счет активации фермента актомиозина, в ретракции тромбоцитарно-фибринового сгустка – финальном этапе гемостаза [4]. Прогестерон обеспечивает подготовку к беременности и имплантацию оплодотворенной яйцеклетки, поддерживает нормальное течение гестационного периода за счет снижения тонуса и возбудимости матки, имммуносупрессии, подавления цитотоксических реакций. В недавнем исследовании было показано, что при условии терапии прогестероном частота развития гестационной гипертензии в 7,5 раз ниже, чем в группе без гестагенов [16].
Тем не менее при серьезном риске развития гестоза базовой профилактической терапии бывает недостаточно. В таких случаях дополнительным средством выбора может быть препарат омега-3 полиненасыщенных жирных кислот (ω-3 ПНЖК). Механизм действия препаратов, содержащих ω-3 ПНЖК, эйкозапентаеновую (ЭПК) и докозагексаеновую кислоты (ДГК), обусловлен их влиянием на метаболизм арахидоновой кислоты. Угнетение липоксигеназного пути и активация циклооксигеназного пути превращения арахидоновой кислоты, вызываемое ω-3 ПНЖК, приводят к выраженному изменению баланса простациклин-тромбоксановой системы в сторону увеличения простациклина. Применение таких средств оказывает многостороннее воздействие на гомеостаз сердечно-сосудистой системы, охватывающий биохимические показатели липидного обмена, перекисного окисления липидов, свертывания, фибринолиза и многих других систем организма, а также физиологических и функциональных показателей сердечно-сосудистой системы [1, 3]. Метаболические эффекты ПНЖК зависят от их дозы. Было обнаружено, что длительное потребление малых доз ω-3 ПНЖК (0,5-3,0 г/сут) оказывает действие, близкое к таковому при коротких курсах приема их высоких доз (>4 г/сут). В ряде работ отмечена эффективность применения препаратов ω-3 ПНЖК для профилактики гестоза [2].
Целью данного исследования стала оценка эффективности применения омега-3 ПНЖК для профилактики возникновения и прогрессирования гестоза у беременных с экстрагенитальной патологией.
Материал и методы
Для добавления ω-3 ПНЖК в комплексную профилактическую терапию гестоза был выбран препарат в котором ПНЖК представлены практически полностью в виде ДГК (соотношение ДГК:ЭПК – 7:1), что оптимально для матери и важно для обеспечения оптимального нервно-психического развития будущего ребенка, т.к. ДГК обладает антиапоптотическими и иммуномодулирующими свойствами [15]. ДГК- и ЭПК-субстанции защищены от окисления посредством добавления альфа-, бета- и гамма-токоферолов, аскорбилпальмитата и лимонной кислоты.
Для поддержания функции эндотелия комплексная профилактика с добавлением к базовой терапии ω-3 ПНЖК по 2 капсулы 2 раза в день была назначена 28 пациенткам с экстрагенитальной патологией, из них 7 – планирующим беременность, 21 – в 1-м триместре беременности. Эти пациентки составили первую основную группу (группа Ia). Первую группу сравнения, ретроспективную, составили беременные с сопоставимой экстрагенитальной патологией, получавшие непостоянно и нерегулярно фолиевую кислоту и витамин Е, препараты прогестерона и магния (группа Iб).
Вторую основную группу составили 28 беременных в 3-м триместре с гестозом легкой/средней степени тяжести, у которых ω-3 ПНЖК были назначены по 2 капсулы 2 раза в день в связи с нежелательным применением антикоагулянтной терапии низкомолекулярными гепаринами (в связи с количеством тромбоцитов в клиническом анализе крови менее 180×109/л и/или снижением их агрегационной активности, с наличием диабетической пролиферативной ретинопатии) в дополнение к общепринятой терапии (группа IIa); вторую группу сравнения составили 35 беременных в 3-м триместре с гестозом легкой степени, получавшие общепринятую терапию (эуфиллин, дибазол и папаверин, клофелин, сульфат магнезии, инфузионная терапия солевыми растворами) без применения ω-3 ПНЖК и антикоагулянтной терапии (группа IIб).
В процессе ведения пациенток осуществлялся динамический контроль показателей системы гемостаза и оценивались исходы беременности для матери и плода.
Статистический анализ полученных данных проводился с использованием программ Microsoft Excel 2007 (Microsoft Corporation, США) иSTATISTICA v.6.0 (Statsoft Inc., Tulsa, США). Определение достоверности различий между сравниваемыми группами проводили с помощью критерия хи-квадрат по стандартной формуле. Для оценки межгрупповых различий использовали t-критерий Стьюдента. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых различий или факторных влияний) принимали равным 0,05 (р ≤0,05).
Результаты исследования
В первой основной группе возраст женщин колебался в пределах от 20 до 41 года и составил в среднем 30,1±4,6 года; в первой группе сравнения средний возраст беременных составил 32,4±5,4 года (диапазон от 26 до 40 лет). Большая часть беременных в обеих группах были первородящими, в группе 1а процент первобеременных (36,7±8,8%) был несколько выше, чем в группе 1б, что, однако, оказалось статистически незначимым. Анамнестические факторы риска гестоза у беременных групп 1а и 1б статистически значимых различий не имели; данные представлены в табл. 1. Отмечено, что у большинства беременных имело место сочетание нескольких факторов риска, при этом превалировали избыточная масса тела и ожирение, отмечался высокий процент нарушений углеводного обмена, хронической артериальной гипертензии. Частота хронического пиелонефрита, урогенитальной инфекции также была сопоставимой в обеих группах.
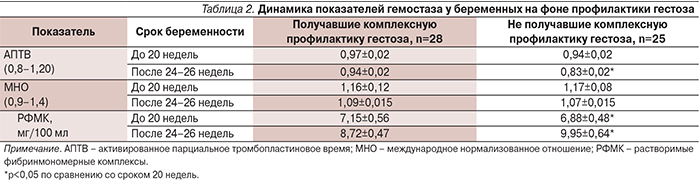
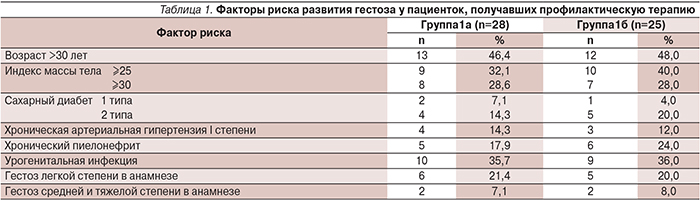
При наблюдении за клинико-лабораторными показателями в динамике было отмечено, что у беременных, получавших комплексную терапию с включением ω-3 ПНЖК наблюдалось достоверно большее количество тромбоцитов в периферической крови и при этом не наблюдалось значительного повышения их агрегационной активности (рис. 1 и 2). Уровень фибриногена и Д-димера был достоверно более низким в группе с комплексной профилактикой гестоза (рис. 3 и 4). Кроме того, было отмечено, что у беременных 1-й основной группы остальные показатели гемостаза не изменялись в динамике, тогда как в 1-й группе сравнения к 3-му триместру происходило укорочение активированного частичного тромбопластинового времени и возрастание содержания растворимых фибрин-мономер-комплексов (табл. 2).
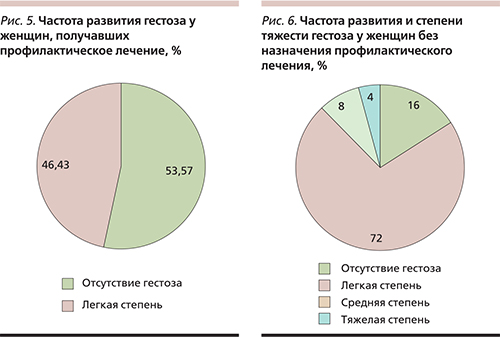
Средний срок появления гестоза в группе 1а составил 35,3±1,6 недели, тогда как в группе сравнения гестоз развивался достоверно раньше – в 30,6±1,3 недели (р<0,05). При этом, как представлено на рис. 5 и 6, частота развития гестоза в группе 1а была достоверно ниже и составила 46,4% по сравнению с 84% в группе 1б (χ2=8,26; р<0,01). На фоне комплексной профилактики не наблюдалось среднетяжелых форм гестоза, тогда как в группе без постоянной комплексной профилактики частота таких форм составила 12%.
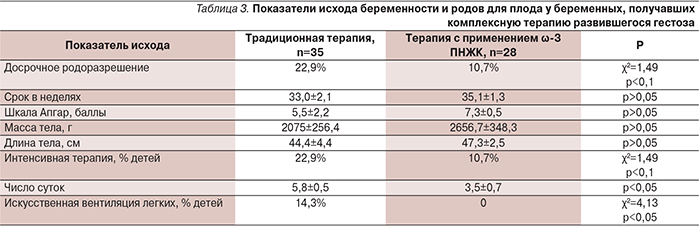
При добавлении ω-3 ПНЖК к традиционной терапии гестоза (группа беременных 2а) было отмечено, что такая комплексная терапия приводила к более значимой стабилизации показателей гемодинамики и протеинурии и способствовала возможности более длительного пролонгирования беременности. В группе, получавшей ω-3 ПНЖК, значимо нормализовался липидный профиль и коагулограмма по сравнению с беременными группы 1б, получавшими только традиционную терапию, без дезагрегантов и антикоагулянтов. На фоне приема ω-3 ПНЖК достоверно увеличилось время свертывания (с 27±0,7 до 36±0,5 с; р<0,05) и снизились уровни фибриногена (с 5,8±0,2 до 4,1±0,1 г/л; р<0,01). Отмечено значительное улучшение показателей липидного обмена. В частности, выявлено снижение уровня триглицеридов (от 342±12 до 306±11 мл/дл; р<0,05), общего холестерина (от 272±6 до 243±5 мг/дл; р<0,01), повышался уровень холестерина липопротеинов высокой плотности (от 52±2 до 59±2 мг/дл; р<0,05). Было отмечено достоверное улучшение исхода родов для плода (табл. 3).
Примеры клинических случаев, иллюстрирующих показания к назначению и эффективность использования ω-3 ПНЖК в комплексной терапии гестоза: Пациентка Н. 29 лет обратилась амбулаторно в 8 неделе беременности. Особенности анамнеза: с 13 лет – вегето-сосудистая дистония по гипертоническому типу с диэнцефальными кризами, ожирение I степени, сахарный диабет 2 типа, компенсированный диетой, стаж – 2 года. Акушерский анамнез: первобеременная. Клинический анализ крови: Hb 115 г/л; лейкоциты 7,8×109/л; тромбоциты 140×109/л; АЛТ 23,3 АСТ 24,5; билирубин 9,45 мкг/л; мочевина 3,9 мкм/л; креатинин 0,068 мкмоль/л, общий белок 66,4 г/л; холестерин 6,5 ммоль/л. Дневные колебания сахара: 4,5–6,6–5,7–5,5 ммоль/л, анализ мочи в пределах нормы. Коагулограмма: протроминовое время 19 с; протромбиновый индекс 101%, АПТВ 49; тромбиновое время 25 с; время образования сгустка 4,83 мин; фибриногенген 3,1 г/л. Интенсивность агрегации тромбоцитов – 34%, снижена. Дезагрегантная и антикоагулянтная терапия не показаны. Профилактика сосудистых осложнений: поливитаминная минеральная добавка – 1 капсула постоянно, прогестерон – 200 мг 2 раза в день до 20 недель, магне В6 – 4 таблетки, 3 курса по 2 недели; ω-3 ПНЖК – 2 капсулы 2 раза в день постоянно. C 32 недель беременности появились умеренные отеки, по данным УЗИ: плацента 3 степени зрелости, асимметричная форма гипотрофии плода: окружность животика плода соответствует 30–31 неделя (в пределах 10%). Клинический анализ крови: Hb 121 г/л; лейкоциты 6,5×109/л; тромбоциты 210×109/л; интенсивность агрегации тромбоцитов 44% (N); фибриноген 3,5 г/л. Дополнение к терапии: дипиридамол по 3 таблетки в день, растительный диуретик по 6 таб. в день; ω-3 ПНЖК 6 капсул (по 2 капсулы, 3 раза в день). В 36 недель – стационарное лечение по поводу гестоза легкой степени (дегидратация, улучшение кровотока фето-плацентарного комплекса). Роды через естественные родовые пути в 38 недель. Кровопотеря 200 мл. Состояние новорожденного: вес 3240 г, рост 51 см, Апгар 8 баллов. Пациентка выписана на 5 сутки домой с ребенком.
Пациентка К. Диагноз: беременность 32 недели. Гестоз легкой степени, сахарный диабет I типа, стаж 10 лет. Диабетическая пролиферативная ретинопатия – 1 год, дезагрегантная и антикоагулянтная терапия не показаны. При беременности выявлены диабетическая кардиопатия, нейро- и энцефалопатия. Хронический пиелонефрит, длительность 17 лет. Течение сахарного диабета: лабильный, субкомпенсированный. Дневные колебания сахара крови: 2,7–5,2–8,6 ммоль/л, уровень Нb1=9,07%. Акушерский анамнез: первобеременная. Текущая беременность: на учете с 8 недель, прибавка веса 19 кг, белок в моче 0,32 г/л с 32 недель, АД 130/90 мм рт.ст., отеки с 20 недель; угроза прерывания с 8 недель, хроническая плацентарная недостаточность с 27 недель, нарушение гемодинамики 1-й ст. Клинико-лабораторные данные при начале лечения: Hb 118 г/л, эритроциты 4,1×1012/л; лейкоциты 8×109/л; тромбоциты 240×109/л; АЛТ 24,9 ед., АСТ 27,1 ЕД; билирубин 14,45 мкмоль/л; мочевина 4,8 ммоль/л; креатинин 0,069 мкмоль/л; общий белок 61,33 г/л; ОЩФ 154,8 ЕД; ПЩФ 26,9 ЕД, холестерин 7,41 ммоль/л. Коагулограмма: протромбиновое время 19 с, протромбиновый индекс 111%; АПТВ 49 с; тромбиновое время 25 с, фибриноген 6,1 г/л; интенсивность агрегации тромбоцитов 67%, Д-димер 780 ед. Терапия: инсулинотерапия, поливитаминная минеральная добавка, метилдопа, инфузии магнезии и гидроксиэтилкрахмала, ω-3 ПНЖК по 2 капсулы 3 раза в день. Кровь: Hb 124 г/л, эритроциты 3,7×1012/л; лейкоциты 5,5×109/л, тромбоциты 245×109/л; АЛТ 24,9 ЕД, АСТ 27,1 ЕД; биллирубин 14,45 мкмоль/л; мочевина 4,68 ммоль/л; креатинин 0,071 мкмоль/л; общий белок 65,17 г/л; ОЩФ 155 ЕД, ПЩФ 32,1 ЕД, холестерин 6,13 ммоль/л.
Моча: общий анализ в пределах нормы; колебания уд. веса – 19; суточный диурез 1410 мл, минутный диурез 1,11 мл/мин, креатинин 7,2 мкмоль/л; ацетон 0; сахар 56 ммоль/л, клубочковая фильтрация 99,9 мл/мин; реабсорбция 98,9%. Коагулограмма: протромбиновый индекс 105%; АПТВ 55 с; тромбиновое время 28 с, время образования сгустка 5,08 мин; фибриноген 5,5 г/л; интенсивность агрегации тромбоцитов 59%, Д-димер 450 ЕД. Особенности родового акта: в 37–38 недель – плановое кесарево сечение. Кровопотеря 600 мл. Состояние новорожденного: вес 3980 г, рост 53 см, Апгар 7 баллов, умеренные признаки диабетической фетопатии. Выписана на 8-е сутки домой с ребенком.
Обсуждение результатов
У всех беременных, включенных в исследование, были выявлены анамнестические и клинико-лабораторные факторы риска гестоза, по поводу которых они получали базовую профилактику поливитаминами, препаратами магния и прогестерона. Очевидно, что эти пациентки относились к группе риска развития сочетанного гестоза, расцениваемого в настоящее время многими исследователями как «поздняя преэклампсия».
Тем не менее развитие гестоза (преэклампсии) даже позже 32 недель беременности хоть и сопровождается меньшим риском перинатальной смерти, но сохраняет высокий риск заболеваемости как матери, так и плода. Ведь данный контингент беременных, как правило, имеет отягощенный соматический анамнез и часто родоразрешается оперативным путем с более высоким риском послеродовых осложнений. При этом происходит рождение незрелых плодов с нарушениями адаптации к внеутробной жизни. Усиление медикаментозной профилактики гестоза длительным приемом ω-3 ПНЖК, особенно у беременных с нарушениями липидного и углеводного обмена и в случаях, когда не показана дезагрегантная и антикоагулянтная терапия, приводит к коррекции эндотелиальной дисфункции и достижению благополучных исходов беременности и родов для матери и плода.



