Отечно-асцитический синдром – наиболее частое осложнение цирроза печени. Его появление указывает на прогрессирование заболевания и связано с 50%-ной летальностью в течение ближайших 5 лет [1–3]. К ключевым препаратам для лечения отечно-асцитического синдрома относятся петлевые диуретики, которые позволяют улучшать качество жизни больных, предупреждают развитие спонтанного бактериального перитонита и гепаторенального синдрома. В качестве консервативного лечения используют антагонист альдостерона, спиронолактон и петлевые диуретики – фуросемид и торасемид [4–6]. Такое сочетание позволяет добиваться регресса отечно-асцитического синдрома примерно у 60–75% больных, особенно на ранних этапах лечения. Для отдельных пациентов диуретическая терапия может быть неэффективной ввиду потери чувствительности к мочегонной терапии с формированием рефрактерного асцита, при наличии которого годичная выживаемость составляет всего 25% [7]. Использование мочегонных препаратов в рекомендуемых дозах ограничивает такие нежелательные явления, как гипотония, электролитные нарушения, ухудшение функции почек и азотемия, нарастание печеночной энцефалопатии [1, 4]. Резистентность к мочегонным препаратам и побочные эффекты традиционной схемы послужили толчком для поиска новых алгоритмов лечения пациентов с отечно-асцитическим синдромом. В качестве альтернативы зарекомендовал себя торасемид SR, клиническими преимуществами которого служат больший диуретический эффект, меньший риск развития электролитных нарушений [1, 8–10]. Важные особенности препарата (в отличие от фуросемида) состоят в его блокирующем действии на рецепторы альдостерона и отсутствии феномена рикошета, который ассоциируется с задержкой натрия и воды. Это делает обоснованным применение торасемида SR при циррозе печени. Торасемид доказал свою эффективность в отношении как пациентов с хронической сердечной недостаточностью [11–13], так и больных циррозом печени. По сравнению с фуросемидом терапия торасемидом SR сопровождалась уменьшением числа госпитализаций и снижением смертности больных с отечно-асцитическим синдромом при циррозе печени [14]. За последние годы появился торасемид с замедленным высвобождением (ЗВ). Обладая всеми свойствами торасемидов, пролонгированная форма (бритомар) обеспечивает постепенное высвобождение препарата, что позволяет снижать колебания концентрации торасемида в плазме крови [15, 16]. Высокая и предсказуемая биодоступность, длительный период полувыведения определяют стабильность натрийуреза и диуретического эффекта торасемида ЗВ, минимизируют электролитные нарушения, улучшают качество жизни пациентов [17–19]. Применение торасемида ЗВ пациентами с отечно-асцитическим синдромом на фоне цирроза печени недостаточно изучено.
Целью исследования была оценка эффективности и безопасности применения торасемида ЗВ (бритомар) пациентами с отечно-асцитическим синдромом на фоне декомпенсации цирроза печени.
Материал и методы
В исследование включены 42 пациента (в т.ч. 20 женщин) с циррозом печени и отечно-асцитическим синдромом. Средний возраст составил 57,4±11,5 года. Критериями исключения были возраст младше 18 лет, гепаторенальный синдром, гипонатриемия <125 ммоль/л, гипокалиемия <3,5 ммоль/л, гиперкалиемия >5,5 ммоль/л, нарастание печеночной энцефалопатии или печеночная кома, повышенная чувствительность к торасемиду с пролонгированным высвобождением, анурия, синоатриальная и атриовентрикулярная блокада II–III степеней, артериальная гипотензия (АД <90/60 мм рт.ст.). В исследование не включены пациенты с острым алкогольным гепатитом тяжелого течения.
Все пациенты соблюдали диету с ограничением поваренной соли до 3 г/сут, воздерживались от употребления алкоголя и получали стандартную терапию по поводу цирроза печени: переливание альбумина, свежезамороженной плазмы, лактулозу, ципрофлоксацин, пропранолол.
При рандомизации больные были распределены на 2 группы. Основная группа получала торасемид ЗВ (n=20), контрольная – фуросемид (n=22). Все пациенты получали спиронолактон. Препараты принимались внутрь в таблетированной форме в среднем в течение 3 недель. Исходные дозы диуретиков (торасемид ЗВ 10 мг, фуросемид 40 мг, спиронолактон 100 мг/сут) увеличивались в 2 раза каждые 3 дня в случае потери массы тела менее чем на 300 г/сут. Ограничением при этом служило снижение массы тела более 500 г/сут у пациентов без периферических отеков [1, 5, 6].
Всем пациентам проведены клиническая оценка, лабораторное обследование, включавшее общий анализ крови, биохимические показатели сыворотки крови (общий белок, альбумин, креатинин, электролиты, щелочная фосфатаза, билирубин, аланинаминотрансфераза – АлАТ, аспартатаминотрансфераза – АсАТ, γ-глутамилтранспептидаза, показатели свертывающей системы, общий анализ мочи, суточная экскреция натрия с мочой. Кроме того, были проведены инструментальные исследования, включившие электрокардиографию, рентгенографию грудной клетки, ультразвуковое исследование печени, эзофагогастродуоденоскопию. Ультразвуковая эластометрия печени с использованием аппарата Fibroscan 502 Touch («Echosens», Франция) проведена всем пациентам после уменьшения асцита. Алкогольный генез цирроза печени подтверждался наличием признаков хронической алкогольной интоксикации. Всем больным проведено серологическое исследование маркеров вирусных гепатитов. У больных моложе 35 лет исследовали церулоплазмин. Для исключения гемохроматоза исследовали сывороточное железо и ферритин.
Эффективность и безопасность терапии оценивали ежедневно по следующим показателям: суточный диурез, масса тела, окружность живота, отеки, артериальное давление (АД), частота сердечных сокращений. Уровень электролитов и креатинина в крови определяли каждые 3 дня, суточный натрийурез – до мочегонной терапии и после нее.
 Статистическая обработка полученных данных проведена с использованием программы Statistica 7.0. Для оценки статистической значимости различий между группами применяли непараметрические критерии Манна–Уитни и Вилкоксона. Корреляционный анализ осуществлен с использованием статистики Спирмена. Все данные представлены в виде средних значений±SD. Статистически значимым считали различия при p<0,05.
Статистическая обработка полученных данных проведена с использованием программы Statistica 7.0. Для оценки статистической значимости различий между группами применяли непараметрические критерии Манна–Уитни и Вилкоксона. Корреляционный анализ осуществлен с использованием статистики Спирмена. Все данные представлены в виде средних значений±SD. Статистически значимым считали различия при p<0,05.
Результаты
По основным клинико-демографическим показателям исследуемые группы были сопоставимыми (табл. 1). У всех пациентов цирроз печени имел алкогольный генез, у 31% выявлены маркеры вирусных гепатитов, у 71% цирроз печени соответствовал классу С по Чайлд–Пью. У 14,2% из них диагноз цирроза печени был установлен впервые. У всех пациентов течение цирроза печени осложнилось развитием асцита, у 86% асцит имел III степень выраженности; 43% ранее принимали мочегонную терапию. Ни у одного пациента ни ранее, ни во время исследования не потребовалось проведение лапароцентеза. У всех определялись отеки нижних конечностей, имелись желтуха, признаки печеночной энцефалопатии, снижение синтетической функции печени.
Плотность печени в группе торасемида ЗВ составила в среднем 56±8 кПа, в группе фуросемида – 60±10 кПа. К концу исследования средняя доза торасемида ЗВ составила 8±2 мг/сут, фуросемида 60,0±35 мг/сут. При этом в группе фуросемида у 11 (50%) пациентов доза фуросемида увеличилась, причем в 2 раза – у 7. В группе торасемида ЗВ увеличения дозы не потребовалось. По сопутствующей терапии группы были сопоставимы. На фоне диуретической терапии в обеих группах отмечалось уменьшение отечного синдрома: в группе торасемида ЗВ у 2 (10%) человек сохранялась пастозность голеней и стоп; в группе фуросемида – у 6 (27%).
У всех пациентов наблюдался регресс асцита до I степени. Более выраженный диуретический эффект отмечался в группе торасемида ЗВ.
В группе торасемида ЗВ диурез в среднем увеличился на 865±660 мл, а в группе фуросемида – 400±300 мл (р=0,018). При этом статистически значимых различий по динамике массы тела между группами выявлено не было: в группе торасемида ЗВ масса тела уменьшилась на 8±4 кг, в группе фуросемида – на 5,8±3,8 кг (р=0,06).
В группе пролонгированной формы торасемида отмечалось статистически значимое усиление суточной экскреции натрия с мочой (93±63,0 ммоль/сут по сравнению с группой фуросемида 51±20 ммоль/сут; p=0,012). Статистически значимых различий по уровню калия и натрия в плазме крови в двух группах получено не было.
В ходе лечения функция почек была стабильной, уровень креатинина не нарастал.
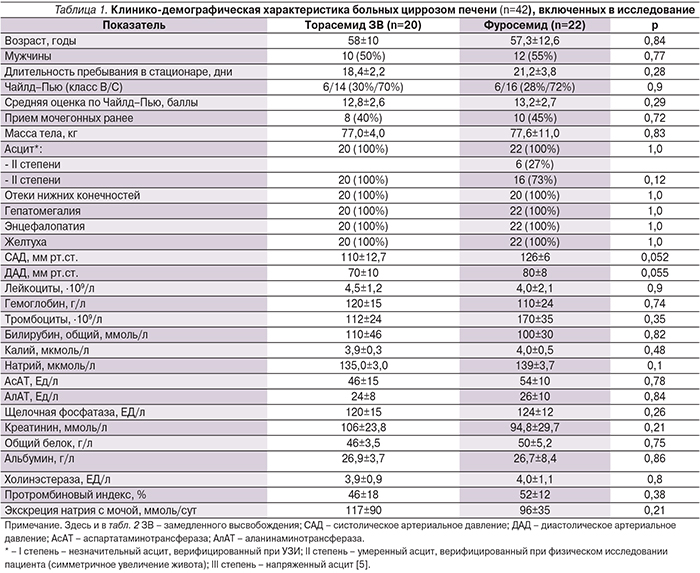
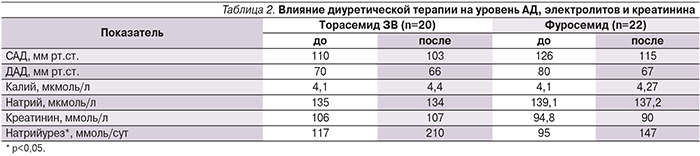
Влияние мочегонной терапии на уровень АД, электролитов и креатинина представлено в табл. 2. У всех больных к окончанию исследования отмечены статистически значимое снижение средней оценки по шкале Чайлд–Пью (р=0,003) и уменьшение тяжести цирроза печени (р=0,003). При этом статистически значимых различий между группами не выявлено (рисунок).
Таким образом, при сравнении торасемида ЗВ с фуросемидом в исследуемой группе получен достоверно больший диуретический и салуретический эффект. При этом статистически значимых различий по снижению массы тела и регресса отечного синдрома не выявлено.
Обсуждение
Для лечения отечно-асцитического синдрома у больных с декомпенсацией цирроза печени наиболее изучен торасемид немедленного высвобождения. В ряде исследований было продемонстрировано, что фармакокинетика торасемида ЗВ, в частности биодоступность, сопоставима с таковой у торасемида немедленного высвобождения [20]. При циррозе печени отмечено увеличение биодоступности (в 2,5 раза) и длительности периода полувыведения торасемида (до 4,8 часа) [21].
Тем не менее увеличения кумуляции при длительном использовании препарата не ожидается, т.к. у таких больных за сутки с мочой выводилось около 80% дозы препарата (в неизмененном виде и в виде метаболитов), т.е. коррекции дозы при циррозе печени не требуется [22].
При лечении отечно-асцитического синдрома у больных циррозом печени возможно использовать торасемид как в качестве монотерапии, так и в сочетании с спиронолактоном [23]. Терапия торасемидом показана как при декомпенсации асцита, так и в целях его профилактики. Торасемид не вызывает гипокалиемии даже при длительном приеме [24].
Для оценки эффективности мочегонной терапии пациентов с циррозом печени и асцитом был проведен ряд сравнительных исследований торасемида и фуросемида. В рандомизированном исследовании 28 пациентов с асцитом, получавших спиронолактон (200 мг/сут), были сопоставлены результаты 6-недельной терапии торасемидом (20 мг/сут) и фуросемидом (40 мг/сут). Оба препарата оказывали сопоставимое влияние на массу тела, диурез и экскрецию мочевой кислоты, натрия и хлоридов, однако в группе торасемида экскреция калия, кальция, неорганических фосфатов и магния была ниже [25].
В двойном слепом перекрестном исследовании были сопоставлены результаты приема фуросемида (80 мг) и торасемида (20 мг) внутрь у 14 больных. Торасемид превосходил фуросемид по диуретической и натрийуретической активности.
У 5 пациентов наблюдался слабый ответ на прием фуросемида, при этом торасемид вызывал значительное увеличение натрийуреза и диуреза [26].
Положительное влияние торасемида на диурез и салурез было показано в исследовании с участием 124 больных циррозом печени: 61 человек получал торасемид и 63 – фуросемид. Дозы подбирались индивидуально с учетом градации асцита и ответа на мочегонную терапию. В группе торасемида достоверно увеличилась суточная экскреция натрия с мочой по сравнению с таковой в группе фуросемида (р<0,05) [10].
Увеличение натрийуреза (p=0,012) и диуреза (р=0,018) наблюдалось и в нашем исследовании при использовании торасемида ЗВ. В группе из 46 больных циррозом печени, осложнившимся асцитом (рандомизированное исследование), проведено лечение торасемидом 20 мг/сут или фуросемидом 40 мг/сут в сочетании со спиронолактоном 200 мг/сут. Если не удавалось добиваться снижения массы тела на 300 г/сут, дозы диуретиков каждые 3 дня увеличивали до 40, 120 и 400 мг/сут соответственно. Торасемид ЗВ вызывал более выраженное увеличение диуреза, чем фуросемид, хотя в целом результаты лечения в 2 группах оказались сопоставимыми. Увеличения доз диуретиков потребовалось 2 больным группы торасемида ЗВ и 9 пациентам группы фуросемида (p<0,05) [15].
В нашем исследовании при сравнении торасемида ЗВ с фуросемидом также статистически значимых различий по динамике массы тела выявлено не было (р=0,06). Отсутствие достоверных различий между показателями средней массы тела опытной группы и группы сравнения, возможно, связано с целевым дозированным снижением массы в обеих группах по рекомендованным схемам. Стоит отметить, что увеличения доз диуретика потребовалось только в группе фуросемида.
Торасемид не влиял на уровни АД, креатинина и электролитов в плазме при использовании препарата в дозе 20 мг/сут по сравнению с фуросемидом в дозе 50 мг/сут [22, 27]. Длительность мочегонной терапии составила 7 дней. В нашем исследовании пациенты принимали торасемид ЗВ в среднем в течение 3 недель. В исследуемой группе до включения в исследование наблюдалась тенденция к более низким уровням АД. Однако влияния на уровень АД бритомар не оказывал. Не наблюдалось и изменений уровня калия, натрия и креатинина в крови.
В одном из исследований показано, что на фоне терапии торасемидом по сравнению с фуросемидом достоверно реже развивается асцит, резистентный к лечению (16,4 и 38,1%; p<0,05). Длительность терапии составила 15 дней [9]. При этом были включены только пациенты с III степенью асцита. Более чем у 50% пациентов имелось повторное развитие асцита, не поддающегося коррекции мочегонной терапией на амбулаторном этапе. Снижение синтетической функции печени (гипоальбуминемия) корригировалось переливанием только свежезамороженной плазмы. В нашем исследовании потери чувствительности к мочегонным препаратам не было выявлено ни в одной из групп. Возможно, это обусловлено сопутствующей терапией. Так, основным методом коррекции гипопротеинемии служило переливание альбумина, а не свежезамороженной плазмы. Кроме того, тяжесть асцита была менее выраженной. В исследовании принимали участие пациенты со II степенью асцита, 42% ранее не получали мочегонную терапию и у 14,2% цирроз печени дебютировал отечно-асцитическим синдромом.
При планировании исследования мы предполагали, что применение торасемида ЗВ сократит длительность пребывания в стационаре за счет более быстрого регресса отечно-асцитического синдрома. Достоверных различий по длительности пребывания больных в стационаре получено не было. Соотношение дозы торасемида и фуросемида составляет 10–20 и 40 мг/сут [21, 28]. В большинстве исследований начальная доза торасемида немедленного высвобождения составила 20 мг/сут [9, 23–27]. В нашем исследовании примерно 50% пациентов ранее не получали мочегонной терапии, имели относительно сохранный натрийурез и тенденцию к более низкому АД. В связи с этим начальная доза торасемида ЗВ составила 10 мг/сут. На фоне проводимой терапии наблюдалась положительная динамика в виде увеличения диуреза и натрийуреза без развития гипотонии, электролитных нарушений, со стабильным уровнем креатинина.
С учетом спокойного профиля безопасности торасемида ЗВ, вероятно, при увеличении дозы будет наблюдаться более быстрый клинический эффект.
Таким образом, торасемид ЗВ (бритомар) может служить альтернативой фуросемиду в лечении отечно-асцитического синдрома у больных декомпенсированным циррозом печени.



