Несмотря на возможность использования в клинической практике достаточного количества современных антигипертензивных препаратов, проблема лечения рефрактерной артериальной гипертензии (РАГ) остается сложной задачей. Важность проведения оптимальной антигипертензивной терапии (АГТ) данной категории больных продиктована тесной взаимосвязью РАГ с ухудшением прогноза, а также ранним и значительным повреждением органов-мишеней. Так, у больных РАГ частота развития гипертрофии левого желудочка (ЛЖ), ангиопатии сосудов сетчатки, нефропатии, атеросклероза каротидных артерий почти в два раза больше по сравнению с пациентами без АГ [1].
Нельзя не отметить и другое: в развитии РАГ важную роль играет повышенная чувствительность к соли [2]. В свою очередь сама по себе солечувствительность в настоящее время рассматривается как одна из причин увеличения массы миокарда ЛЖ и повреждения других органов-мишеней [3, 4].
В связи с этим представляет интерес попытка ответить на вопрос: можно ли оптимизировать АГТ, в т.ч. достичь целевых значений артериального давления (АД) и обеспечить эффективную кардиопротекцию пациентам с РАГ с учетом наличия или отсутствия солечувствительности? Кроме того, появление новых классов лекарственных средств может расширить возможности лечения РАГ. Одним из таких препаратов служит прямой ингибитор ренина (ПИР) алискирен, эффективность которого в отношении солечувствительных и солерезистентных больных, в т.ч. РАГ, не изучена.
С учетом вышесказанного целью настоящего исследования стала оценка влияния комбинированной АГТ, включившей ПИР, на основные показатели структурно-функционального состояния миокарда ЛЖ в зависимости от солечувствительности пациентов с РАГ.
Материал и методы
В исследование были включены 192 пациента с РАГ (82 мужчины и 110 женщин), медиана возраста которых составила 64 (59–67) года.
Критерии включения: АД≥140/90 мм рт.ст. на фоне «изменения образа жизни и рациональной комбинированной АГТ с применением адекватных доз не менее 3 препаратов, включая диуретики» [5]; информированное согласие пациента на участие в исследовании.
Не были включены больные, имевшие хотя бы один из критериев исключения: контролируемая АГ; псевдорезистентная или вторичная АГ; сахарный диабет; стенокардия напряжения II–IV функциональных классов (ФК), инфаркт миокарда или нестабильная стенокардия; нарушение мозгового кровообращения менее чем за 6 месяцев до включения в исследование; хроническая сердечная недостаточность III–IV ФК (NYHA); тяжелые сопутствующие заболевания, определяющие неблагоприятный прогноз на ближайшее время; в анамнезе непереносимость ингибиторов ангиотензинпревращающего фермента (иАПФ), блокаторов кальциевых каналов (БКК), β-адреноблокаторов (БАБ), диуретиков.
Вторичный генез АГ исключен на основании анализа анамнестических данных, результатов клинического и лабораторно-инструментального обследования больных (общий и биохимический анализы крови, мочи, ультразвуковое исследование почек, щитовидной железы, рентгенография и др.).
Всем пациентам исходно проведено суточное мониторирование АД (СМАД). Определение солечувствительности осуществлено с помощью пробы В.И. Харченко: утром натощак после 7-дневного периода низкосолевой диеты (содержание поваренной соли до 2 г и ограничение жидкости до 1,5 литров в сутки) проводилась однократная пероральная солевая нагрузка из расчета 0,22 г/кг хлорида натрия, разведенного в 150 мл дистиллированной воды (в день проведения солевой нагрузки свободный водный режим) [6]. На фоне нагрузки повторно проведено СМАД, и в случае повышения среднесуточных значений систолического (САД) и/или диастолического (ДАД) АД на 5 мм рт.ст. и выше пациенты расценивались как солечувствительные [7].
На основании полученных результатов пробы все больные были распределены в две основные группы в зависимости от наличия или отсутствия солечувствительности:
- группа 1 (n=102) – солечувствительные пациенты;
- группа 2 (n=90) – солерезистентные пациенты.
После оценки солечувствительности больные были рандомизированы методом «конвертов» в подгруппы А и Б в зависимости от использования одного из двух вариантов комбинированной АГТ:
- 1А (солечувствительные) и 2А (солерезистентные) подгруппы – пациенты, которым к полнодозовой комбинации иАПФ эналаприла 20 мг/сут, дигидропиридинового БКК амлодипина 10 мг/сут и тиазидного диуретика (ТД) гидрохлоротиазида 12,5 мг/сут был добавлен ПИР алискирен 150 мг/сут (Расилез, Novartis).
- 1Б (солечувствительные) и 2Б (солерезистентные) подгруппы – больные, которым к полнодозовой комбинации эналаприла 20 мг/сут, амлодипина 10 мг/сут и гидрохлоротиазида 12,5 мг/сут был добавлен БАБ метопролола сукцинат 50 мг/сут.
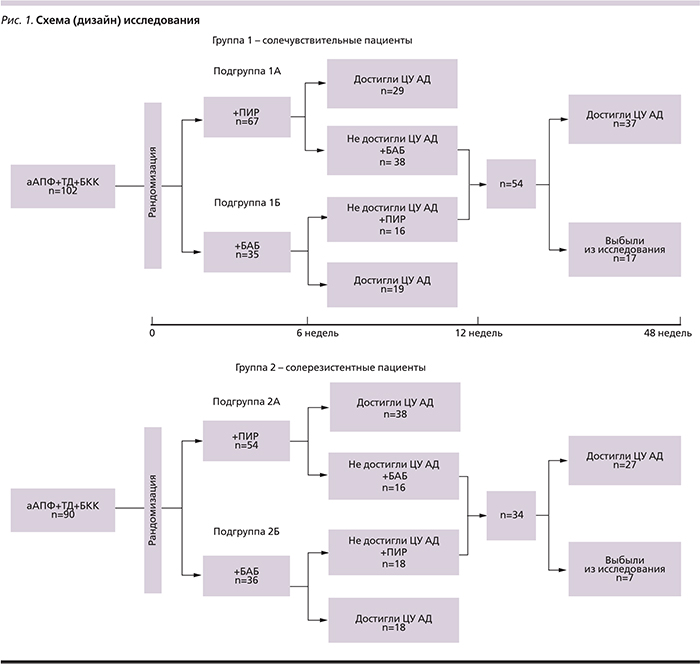
Схема (дизайн) исследования представлена на рис. 1.
Через 3 недели при недостаточной эффективности терапии в подгруппах 1А и 2А дозу алискирена увеличили до 300 мг/сут, а в подгруппах 1Б и 2Б увеличили дозу БАБ до 100 мг/сут.
В отсутствие достижения целевого уровня (ЦУ) АД через 6 недель от начала наблюдения пациентам подгрупп 1А и 2А к терапии был добавлен 5-й препарат – БАБ метопролола сукцинат 50–100 мг/сут, а пациентам подгрупп 1Б и 2Б – алискирен 150–300 мг/сут (рис. 1).
Еще через 6 недель вновь оценивалась эффективность терапии; при недостижении ЦУ АД проведена замена ПИР на торасемид, и эти пациенты исключались из исследования.
Всем включенным в исследование пациентам исходно и через 48 недель терапии проведено общеклиническое исследование, суточное мониторирование АД (аппаратный комплекс суточного мониторирования АД МН СДП-2, Россия), а также эхокардиографическое исследование («ALOKA SSD 2500», Япония). Оценивали конечно-диастолический (КДР) и конечно-систолический размеры (КСР) ЛЖ, фракцию выброса (ФВ) ЛЖ, толщину задней стенки (ТЗС) ЛЖ, толщину межжелудочковой перегородки (ТМЖП), массу миокарда ЛЖ (ММЛЖ), индекс ММЛЖ (ИММЛЖ). Гипертрофию ЛЖ диагностировали у женщин при ИММЛЖ>95 г/м2, у мужчин – при ИММЛЖ>115 г/м2 [8].
По результатам эхокардиографии (ЭхоКГ) выделяли следующие типы ремоделирования ЛЖ: эксцентрическая гипертрофия (ЭГЛЖ), концентрическая гипертрофия (КГЛЖ), концентрическое ремоделирование (КРЛЖ) [8]. Диастолическую функцию ЛЖ оценивали в режиме допплер-ЭхоКГ. Определяли пиковую скорость раннего диастолического наполнения ЛЖ (Е), пиковую скорость позднего диастолического наполнения (А), коэффициент Е/А, время замедления раннего диастолического кровотока (DT), время изоволюметрического расслабления (IVRT). Выделяли гипертрофический, псевдонормальный и рестриктивный типы диастолической дисфункции (ДД) ЛЖ [9].
Результаты исследования обработаны с использованием программы Statistica 6.1 (StatSoft Inc, США). Количественные признаки представлены медианами и интерквартильными интервалами. Сравнение выборок по количественным показателям произведено с помощью U-критерия Манна–Уитни (для двух независимых групп), метода Краскела–Уоллиса и медианного теста (для трех и более независимых групп), критерия Вилкоксона (для зависимых групп), по качественным – построение таблиц сопряженности и их анализ с применением критерия χ2 в модификации Пирсона. Исходно установленный уровень статистической значимости р<0,05.

Результаты исследования
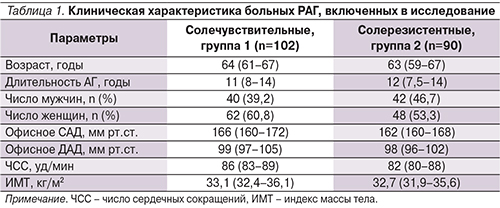
На момент включения в исследование группы солечувствительных и солерезистентных пациентов по исходным анамнестическим и клиническим показателям достоверно не различались (табл. 1).
Антигипертензивная эффективность комбинированной терапии оценивалась по результатам измерений офисного АД и анализа СМАД.
Добавление к терапии ПИР способствовало достижению солечувствительными пациентами (подгруппа 1А) целевых значений АД через 6 недель – 29 (43,3%) пациентов. Пациентов подгруппы 1Б добавление БАБ привело к снижению АД до ЦУ через 6 недель терапии – 19 (54,3%) больных.
В группе солерезистентных пациентов ЦУ АД был зафиксирован через 6 недель применения четырехкомпонентной АГТ, включившей ПИР, – 38 (70,4%) из 54. Вместе с тем использование четырехкомпонентной терапии с БАБ без ПИР (подгруппа 2Б) привело 18 (50 %) из 36 больных к достижению ЦУ АД.
Применение пятикомпонентной терапии, включившей ПИР, обеспечило 37 (68,5 %) из 54 солечувствительных и 27 (79,4%) из 34 солерезистентных пациентов достижение ЦУ АД. Таким образом, при наличии солечувствительности достоверно чаще (р<0,05) требовалось назначение пятикомпонентной терапии.
Через 48 недель лечения, по данным ЭхоКГ, в обеих подгруппах солечувствительных пациентов (1А и 1Б), достигших ЦУ АД, регистрировалось статистически значимое улучшение основных показателей структурно-функционального состояния миокарда ЛЖ (табл. 2).
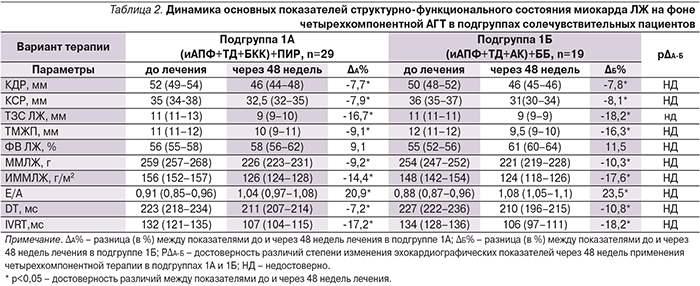
Так, применение комбинированной терапии с ПИР сопровождалось достоверным уменьшением исходно увеличенных значений КДР на 7,7%, КСР на 7,9%, ТМЖП на 9,1%, ТЗСЛЖ на 16,7%, ММЛЖ на 9,2%, ИММЛЖ на 14,4%. На фоне использования комбинации с БАБ также отмечен регресс гипертрофии ЛЖ, что проявлялось достоверным уменьшением ТМЖП на 16,3%, ТЗСЛЖ на 18,2%, ММЛЖ на 10,3%, ИММЛЖ на 17,6%, а также КДР на 7,8%, КСР на 8,1%.
Существенный антиремоделирующий эффект обоих вариантов комбинированной АГТ для солечувствительных больных РАГ сопровождался изменением соотношения регистрируемых до и после лечения вариантов ремоделирования миокарда, а также частоты нормализации геометрии ЛЖ (рис. 2). Так, независимо от используемой комбинации антигипертензивных препаратов через 48 недель в подгруппах 1А и 1Б число пациентов с нормальной геометрией по сравнению с исходным достоверно увеличилось: на фоне применения ПИР – до 52%, при применении БАБ – до 57% (р<0,05). Динамика регистрации различных вариантов ремоделирования миокарда ЛЖ была позитивной, но статистически незначимой (рис. 2).
Важно отметить, что комбинированная терапия, включившая как ПИР, так и БАБ, обеспечила нормализацию геометрии миокарда ЛЖ у сопоставимого числа солечувствительных больных.
Регресс гипертрофии миокарда ЛЖ сопровождался достоверной позитивной динамикой всех исследуемых параметров диастолической функции ЛЖ у солечувствительных пациентов подгрупп 1А и 1Б (табл. 2).
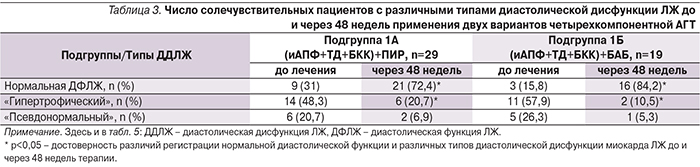
Кроме того, через 48 недель применения обоих вариантов комбинированной терапии солечувствительных пациентов отмечено достоверное увеличение числа больных с нормализовавшейся диастолической функцией ЛЖ (табл. 3). Кроме того, в обеих подгруппах статистически значимо уменьшилось число пациентов с гипертрофическим типом ДД.
Следовательно, на фоне применения обоих вариантов комбинированной АГТ (включивших ПИР или БАБ) у солечувствительных пациентов наблюдалась статистически значимая положительная динамика основных показателей структурно-функционального состояния миокарда ЛЖ, в т.ч. характеризующих его диастолическую функцию. Независимо от используемой комбинации в обеих подгруппах отмечено существенное и, что немаловажно, сопоставимое увеличение числа больных с нормальными геометрией и диастолической функцией миокарда ЛЖ.

Анализ изменений основных показателей ремоделирования миокарда ЛЖ в подгруппах солерезистентных пациентов показал, что через 48 недель комбинированной четырехкомпонентной терапии, включившей как ПИР, так и БАБ, имело место статистически значимое уменьшение КДР, КСР, ТМЖП, ТЗС ЛЖ, ММЛЖ, ИММЛЖ (табл. 4). Вместе с тем использование в составе комбинации алискирена сопровождалось достоверно более выраженным уменьшением таких параметров, как ТЗС ЛЖ и ТМЖП, ММЛЖ и ИММЛЖ, что свидетельствует о преимуществе ПИР перед БАБ у солерезистентных больных в отношении регресса гипертрофии миокарда ЛЖ.
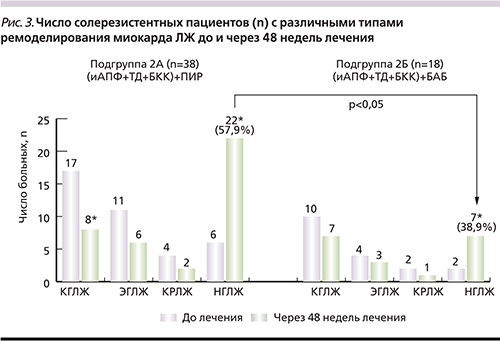
Динамика основных эхокардиографических параметров сопровождалась изменением числа пациентов с различными вариантами ремоделирования миокарда (рис. 3). В подгруппе 2А на фоне терапии ПИР отмечено увеличение числа больных с нормальной геометрией ЛЖ до 57,9% (р<0,05), в подгруппе 2Б – до 38,9% (р<0,05). Немаловажно, что у солеризестентных больных РАГ нормализация гео-метрии ЛЖ имела место достоверно чаще при использовании комбинированной терапии с включением алискирена по сравнению с применением БАБ (рис. 3).
Вполне закономерно, что регресс эхокардиографических показателей, свидетельствующих о наличии гипертрофии, сопровождался достоверными и сопоставимыми в подгруппах 2А и 2Б позитивными изменениями параметров диастолической функции миокарда ЛЖ (табл. 4). Кроме того, в этих подгруппах отмечено статистически значимое уменьшение числа больных с «гипертрофическим» и «псевдонормальным» типами ДД, а также достоверное увеличение числа пациентов без нарушения релаксации миокарда ЛЖ (табл. 5).
Следует отметить, что эти изменения были сопоставимыми в обеих подгруппах пациентов, хотя оказались несколько более выраженными на фоне терапии, включившей алискирен.
Таким образом, сравнительный анализ кардиопротективного действия комбинированной четырехкомпонентной терапии показал, что у солерезистентных пациентов при использовании ПИР имел место достоверно более значимый по сравнению с терапией БАБ регресс гипертрофии ЛЖ и отмечено увеличение числа лиц с нормальной геометрией ЛЖ. В то же время улучшение всех исследуемых параметров диастолической функции ЛЖ и изменение числа больных с различными вариантами ДД оказались сопоставимыми в обеих подгруппах.
Обсуждение
В нашем исследовании была проведена оценка антигипертензивной и кардиопротективной эффективности двух вариантов четырехкомпонентной терапии солечувствительных и солерезистентных пациентов с РАГ.
Как показали результаты этого сравнительного исследования, лечение солечувствительных пациентов с использованием как ПИР, так и БАБ в составе двух вариантов четырехкомпонентной терапии сопровождалось достижением целевых значений АД сопоставимым числом больных. В то же время при наличии солерезистентности терапия, включившая алискирен, оказалась более эффективной, чем применение метопролола сукцината в отношении снижения АД до ЦУ.
Кроме того, в подгруппах солечувствительных пациентов использование обоих вариантов комбинированной АГТ сопровождалось достоверным и сопоставимым регрессом структурно-функциональных изменений миокарда ЛЖ. В то же время у солерезистентных больных более выраженный антиремоделирующий эффект наблюдался на фоне применения комбинации, включившей алискирен, по сравнению с лечением метопрололом сукцинатом. Исключение составили показатели диастолической функции, динамика которых была сопоставимой в обеих группах.
Отвечая на вопрос, чем можно объяснить полученные результаты исследования, следует, очевидно, исходить из особенностей нейрогуморальных механизмов развития АГ у солечувствительных и солерезистентных больных.
Известно, что при наличии солечувствительности имеет место низкий уровень плазменного ренина, что позволяет думать о «второстепенной» или по крайней мере менее значимой роли ренин-ангиотензин-альдостероновой системы (РААС) в прогрессировании АГ у данной категории больных [10, 11]. В то же время данные экспериментальных исследований свидетельствуют о достаточно выраженной активации симпато-адреналовой системы (САС) у солечувствительных пациентов с АГ.
В свою очередь гиперсимпатикотония способствует стимуляции РААС и как результат – усилению канальцевой реабсорбции, а также замедлению выделения натрия с мочой [12]. Следовательно, в поддержании высокого АД у солечувствительных лиц играет важную роль гиперактивация САС, а также непосредственно связанная с ней активация РААС. Такая гиперактивность нейрогуморальных систем способствует, как известно, формированию ремоделирования миокарда ЛЖ и нарушению его диастолических свойств. Вероятно, именно этим можно объяснить сопоставимую антигипертензивную и кардиопротективную эффективность применения как ПИР, так и БАБ в составе комбинированной терапии солечувствительных больных РАГ.

Установленный нами более значимый кардиопротективный эффект алискирена по сравнению с БАБ в группе солерезистентных пациентов, возможно, объясняется особенностями механизма действия ПИР. Считается, что повышение АД при солерезистентности ассоциировано с высокой активностью ренина. Алискирен блокирует активный сайт молекулы ренина и тем самым способствует уменьшению образования ангиотензина II, а следовательно, вносит определенный вклад в предупреждение гиперактивации РААС [13]. Кроме того, данный препарат предотвращает связывание ренина со специфическими рецепторами в тканях [14–16]. По-видимому, эти механизмы обеспечивают блокаду активности РААС на тканевом уровне и связанный с этим определенный регресс структурно-функциональных изменений в миокарде ЛЖ.
Таким образом, результаты нашего исследования продемонстрировали целесообразность дифференцированного подхода к лечению РАГ в зависимости от наличия солечувствительности. Использование в составе комбинированной терапии БАБ или ПИР обеспечивает солечувствительным пациентам статистически значимый и сопоставимый антигипертензивный (по частоте достижения ЦУ АД) и кардиопротективный эффекты. Применение алискирена солерезистентными больными имеет определенные преимущества перед БАБ в отношении более выраженного антигипертензивного эффекта и нормализации структурно-функционального состояния миокарда ЛЖ.



