Острый средний отит (ОСО) в педиатрической практике по-прежнему остается лидирующей причиной назначения системной антибактериальной терапии [1, 2]. По данным статистики, до 634 из 1000 визитов к детским врачам (педиатрам, семейным врачам, детским оториноларингологам) происходят именно по поводу ОСО или подозрения на него. При этом в 76 % обращений в свою очередь назначается системный антибиотик [1]. В России более 65 % детей в возрасте до 3 лет переносят острый средний отит 1–2 раза и 35 % детей болеют 3 раза и чаще [3]. По европейским данным, до 5-летнего возраста подобный диагноз ставится хотя бы однократно 90 % детей [4]. Предрасполагающие факторы развития острого воспаления среднего уха именно в младших возрастных группах известны: с одной стороны, это высокая частота острых респираторных вирусных инфекций, с другой – склонность к развитию дисфункции слуховой трубы в силу анатомических факторов (относительно короткая, широкая и горизонтально расположенная слуховая труба; обструкция глоточного ее устья гиперплазированной глоточной миндалиной) и зачастую низкие уровни секреторных иммуноглобулинов А, способствующие большей контаминации носоглотки патогенной бактериальной флорой [5–7].
Подобная распространенность заболевания и связанное с ним практически неконтролируемое потребление антибактериальных средств на протяжении последнего десятилетия заставили ведущие мировые педиатрические сообщества создать ряд клинических рекомендаций, призванных регламентировать тактику лечения ОСО. Наибольшую известность получили Рекомендации Американской академии педиатрии и Американской академии семейной медицины (AAP/AAFP), изданные в 2004 г. [8]. Принципы данных рекомендаций легли в основу национальных руководств в Канаде (2009) [9], Испании (2007) [10] и многих других странах. Появление новых данных в результате проведения ряда крупных эпидемиологических и клинических исследований за последние годы привело к пересмотру некоторых позиций, отраженных в новых Рекомендациях AAP 2013 г. [11]. Эти рекомендации доступны врачам практически во всем мире, и одной из целей данной публикации является ознакомление с их основными положениями российской профессиональной аудитории.
Диагностика ОСО
Постановка детям диагноза ОСО в соответствии с Рекомендациями AAP/AAFP (2004) базируется на сочетании трех критериев:
- Недавнее острое, иногда молниеносное, начало заболевания;
- Наличие экссудата в среднем ухе (любой из нижеперечисленных признаков):
- выбухание барабанной перепонки,
- ограничение или отсутствие подвижности барабанной перепонки (по данным пневматической отоскопии и/или тимпанометрии),
- уровень жидкости за барабанной перепонкой,
- оторея.
- Признаки воспаления среднего уха (любой из нижеперечисленных признаков):
- выраженная гиперемия барабанной перепонки,
- выраженная боль в ухе (дискомфорт, отчетливо связанный с ухом/ушами и приведший к нарушению активности и сна).
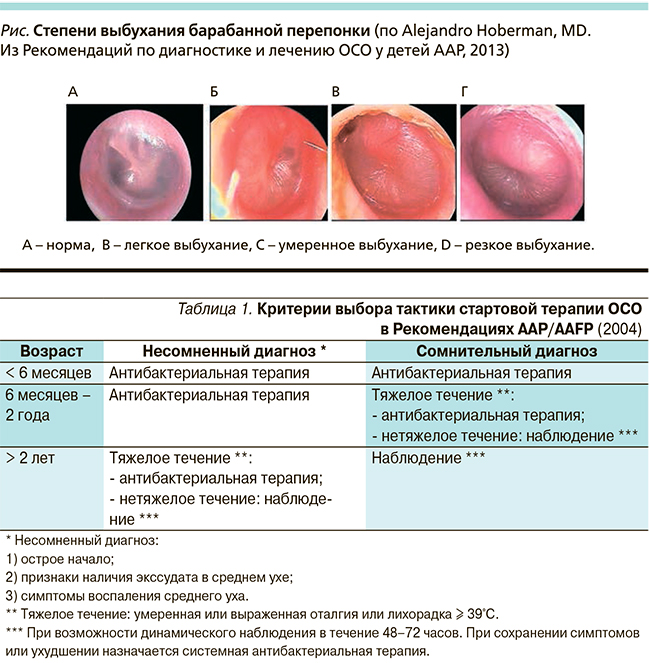
При этом зачастую, особенно у детей младших возрастных групп, верификация диагноза по всем критериям представляется затруднительной в связи с невозможностью педиатра четко визуализировать барабанную перепонку или адекватно оценить отоскопическую картину. Для подобной ситуации в Рекомендациях AAP/AAFP был предложен термин «сомнительный диагноз» (uncertain diagnosis), который встретил значительную критику в последней редакции документа. Подобная критика связана с крайне широким назначением антибиотиков именно пациентам с «сомнительным диагнозом», которое в большинстве случаев оказывалось необоснованным. В настоящее время именно правильная оценка отоскопической картины (степень гиперемии и выбухания барабанной перепонки) играет ведущую роль в диагностике острого среднего отита (см. рисунок).
Таким образом, критерии диагностики ОСО в Рекомендациях AAP были несколько ужесточены и сведены к следующим позициям:
Врач должен диагностировать ОСО у ребенка при умеренном и резком выбухании барабанной перепонки или при возникновении отореи, не связанной с наружным отитом.
Врач должен диагностировать ОСО у ребенка с легким выбуханием барабанной перепонки и недавним (до 48 часов) дебютом ушной боли (прижимание, подергивание, потирание ушной раковины детьми на доречевом этапе развития) или интенсивной гиперемией барабанной перепонки.
Врач не должен диагностировать ОСО у ребенка в отсутствие экссудата в барабанной полости (по данным пневматической отоскопии и/или тимпанометрии).
Следование описанным выше критериям снижает вероятность гипердиагностики ОСО и назначения необоснованного лечения в такой типичной ситуации, как сочетание дебюта ОРВИ и экссудативного среднего отита.
Классификация же тяжести течения ОСО остается неизменной с 2004 г.: тяжелое течение характе-ризуется наличием интоксикации, постоянного выраженного болевого синдрома (более 48 часов) и лихорад-кой > 39 °C в течение последних 48 часов.
Стартовая терапия
Основными направлениями терапии являются устранение болевого синдрома и этиотропное лечение, когда это необходимо.
Препараты выбора для купирования болевого синдрома, по версии Рекомендаций AAP-2004 и -2013, – ацетаминофен (парацетамол) и ибупрофен [12].
Ушные капли, включающие местные анестетики (бензокаин, прокаин, лидокаин), использование которых возможно только при неперфорированной барабанной перепонке, могут иметь вспомогательное значение, однако могут обладать кратковременным преимуществом перед парацетамолом (доказано в возрастной группе старше 5 лет).
Наиболее важной и одновременно неоднозначной проблемой остается определение показаний к системной антибактериальной терапии. Еще 10 лет назад в Рекомендациях AAP/AAFP для определенного контингента пациентов была предложена выжидательная тактика при ОСО с отсроченным назначением антибиотика в случае сохранения симптомов или ухудшения. Неотъемлемой частью данного подхода служит возможность осуществления динамического наблюдения за ребенком в течение 48–72 часов с оценкой динамики клинической и отоскопической картины при условии информированности родителей или опекунов ребенка о применяемой тактике и тесного взаимодействия с ними. Пренебрежение этими условиями во многом дискредитировало данную стратегию, в частности, в России. Определяющим фактором, несомненно, является доступность медицинской помощи (позитивный опыт внедрения выжидательной тактики был получен в штате Нью-Йорк, США [13]).
Критерии выбора тактики стартовой терапии в Рекомендациях AAP/AAFP- 2004 отражены в табл. 1.
В отличие от предшествующих рекомендаций последняя их версия исключает детей в возрасте до 6 месяцев. Основываясь на результатах последних рандомизированных контролируемых сравнительных клинических исследований [14–19], значение приобрели локализация ОСО (одно- или двусторонний) и наличие гноетечения из уха (табл. 2).
В то время как в 2004 г. назначение антибиотика ребенку в возрасте от 6 месяцев до 2 лет при ОСО считалось обязательным, в настоящее время предлагается выбор между безотлагательным стартом антибактериальной терапии и наблюдением в случае одностороннего процесса и легкого течения при условии согласия родителей или опекунов [11].
Выбор антибактериального препарата
Спектр основных бактериальных возбудителей острого среднего отита постоянен на протяжении многих лет и, как известно, включает Streptococcus pneumoniae, Haemophilus influenzae и Moraxella catarrhalis. Перераспределение в сторону грамотрицательных возбудителей, отмеченное первые годы после массового внедрения вакцинации против пневмококковой инфекции [20, 21], в последующем было скомпенсировано за счет невакцинальных штаммов пневмококка. Таким образом, целевые микроорганизмы для проведения эмпирической антибактериальной терапии не изменили свой видовой состав, однако отмечается тенденция к росту доли пенициллин-резистентных штаммов пневмококка.
Стартовым антибактериальным препаратом лечения неосложненного ОСО является амоксициллин в случае отсутствия анамнеза его применения в течение последних 30 дней, сопутствующего гнойного конъюнктивита (как фактора риска гемофильной инфекции) и отсутствия указаний на аллергию к пенициллинам [11]. Назначение «защищенных» форм амоксициллина (амоксициллина клавуланат) оправданно в случае повторного назначения аминопенициллинов в течение месяца; при наличии сопутствующего гнойного конъюнктивита и при рецидивирующем ОСО (3 и более отдельных эпизодов ОСО за 6 месяцев или 4 и более – в течение года с как минимум 1 эпизодом за последние полгода), резистентном к амоксициллину. В случае отрицательной динамики через 48–72 часа от начала приема стартового антибиотика оправданна смена препарата.
Рекомендованные Американской академией педиатрии стартовые дозы амоксициллина и амоксициллина клавуланата (14 : 1) ориентированы на высокую распространенность пенициллин-резистентных штаммов пневмококка и составляют 80–90 мг/кг/сут.
В качестве препарата «второго ряда» при неэффективности стартовой терапии «незащищенным» амоксициллином в течение 48–72 часов AAP также рекомендует использовать амоксициллина клавуланат (14 : 1) в дозе 90 мг/кг/сут или цефтриаксон внутривенно или внутримышечно в дозе 50 мг/кг/сут. В качестве альтернативных схем предлагаются сочетание цефалоспоринов III поколения и клиндамицина в дозе 30–40 мг/кг/сут.

Наиболее значимые изменения при сравнительном анализе Рекомендаций 2004 и 2013 гг. касаются выбора антибактериального препарата при аллергии на пенициллины. Если в предшествующей редакции при наличии IgE-опосредованных аллергических реакций на пенициллины в анамнезе предпочтение отдавалось макролидам и линкозамидам, то в настоящее время рекомендованы цефтриаксон внутривенно или внутримышечно в дозе 50 мг/кг/сут или цефуроксим аксетил внутрь – 30 мг/кг/сут (указаны лишь препараты, зарегистрированные в РФ). Это связано, с одной стороны, с ростом резистентности актуальных возбудителей к препаратам макролидного ряда, с другой – с получением убедительных доказательств крайне низкой вероятности перекрестной аллергии между аминопенициллинами и цефалоспоринами II–III поколений [22].
Длительность антибактериальной терапии
Оптимальная продолжительность приема антибиотика при неосложненном ОСО в соответствии с приведенными рекомендациями составляет 10 дней для детей до 2 лет, а также при тяжелом течении заболевания независимо от возраста; при легком и среднетяжелом течении – 7 дней в возрасте от 2 до 5 лет и 5–7 дней у детей старше 6 лет. Допустимо применение цефтриаксона более короткими курсами (вплоть до однократной инъекции) [23].
Обсуждение, критика и экстраполяция на российское здравоохранение
Рекомендации по лечению ОСО Американской академии педиатрии, являясь на данный момент крупнейшим согласительным документом в данной области, представляют несомненный интерес и несут потенциальную пользу для практикующих педиатров, семейных врачей и оториноларингологов в связи с масштабной доказательной базой, которая легла в их основу. Как и любые алгоритмы и рекомендации, этот документ не способен объять весь спектр разнообразных клинических ситуаций и ориентирован на «типичного» или «идеального» пациента. За рамками представленной информации находятся такие аспекты, как ОСО у новорожденных и детей первого полугодия жизни; сочетание с анатомическими аномалиями челюстно-лицевой области, иммунодефицитами, а также состояниями после тимпаностомии, кохлеарной имплантации и т.д. Кроме того, неосвещенными остаются вопросы топической терапии сопутствующих заболеваний полости носа, носоглотки, в большинстве случаев играющих пусковую роль в развитии патологии среднего уха.
Недостаточное применение отоскопии педиатрами в России, несомненно, резко ограничивает сферу использования подобных рекомендаций. Это диктует необходимость расширения диагностических навыков врачей первичного звена.
Тем не менее позитивными отличительными особенностями отечественных условий оказания медицинской помощи детям с ОСО являются относительная доступность специализированной оториноларингологической помощи, особенно в мегаполисах (максимально адекватная оценка отоскопической картины, относительно частое выполнение парацентеза барабанной перепонки, тимпанопункции), что в итоге повышает эффективность лечения и улучшает исходы заболевания.
Кроме того, значительно более низкая распространенность резистентности пневмококков к пенициллину в России [24] позволяет в качестве стартовой стратегии антибактериальной терапии рассматривать «стандартные» дозы амоксициллина и амоксициллина клавуланата (45 мг/кг/сут), сохраняя «высокодозную» терапию (90 мг/кг/сут) на позиции «второй линии».
Именно с учетом как мирового опыта, так и региональных данных должны создаваться доступные для практического применения качественные российские клинические рекомендации по лечению ОСО в педиатрии.



