Введение
По оценкам, ежегодно во всем мире совершается 42 млн абортов [1]. Мифепристон, антагонист прогестероновых рецепторов, в настоящее время широко используется с целью медикаментозных абортов и был включен в перечень основных лекарственных средств ВОЗ [2]. В большинстве стран, где мифепристон разрешен к использованию в целях прерывания беременности, утверждена следующая схема приема: однократный прием 600 мг перорально с последующим приемом аналога простагландина (ПГ) Е1 через 36–48 часов. Дозировка мифепристона 600 мг была выбрана, поскольку она обусловливала самый низкий уровень сохранившихся (пролонгированных) беременностей при отдельном использовании, как показали исследования по подбору доз [3, 4]. ПГ, разрешенные к использованию вместе с мифепристоном, – это либо 400 мкг мизопростола перорально, либо 1 мг гемепроста вагинально в зависимости от страны.
Однако эффективность использования препарата в сочетании с 400 мкг мизопростола перорально уменьшается после 49 дней беременности [5–9]. Для того чтобы эффективность сохранялась до 63 дней, необходимо вводить 800 мкг мизопростола вагинально (неутвержденный способ введения препарата) или 1 мг гемепроста вагинально.
Все большее число фактов говорит о том, что для прерывания беременности на ранней стадии (до 63 дней аменореи) может быть эффективен прием мифепристона в дозировке 200 мг в том случае, если он используется в сочетании с вагинальным введением 800 мкг мизопростола или 1,0 мг гемепроста [9–15]. Данная эффективность была подтверждена в ходе Кокрановского мета-анализа, в рамках которого сравнивались дозы мифепристона 200 и 600 мг в сочетании с подходящей дозой ПГ и в качестве первичной конечной точки брался полный аборт [16].
В некоторых руководствах сегодня рекомендуется прием дозы 200 мг в сочетании с высокой дозой ПГ [17–20].
Однако в Кокрановском мета-анализе не рассматривались другие конечные точки, помимо неспособности достичь полного прерывания беременности и желудочно-кишечных побочных эффектов, в то время как в исходных исследованиях фазы II отдельного применения мифепристона в качестве конечной точки была взята «неудача», под которой понималось сохранение беременности. Это более строгий, чем полный аборт, критерий, и он минимизирует систематическую ошибку оценки в случае исследований открытым, а не слепым методом. Кроме того, сохранение беременности остается медицинской проблемой, связанной с тем, какие рекомендации дать пациентке: стоит ли продолжать дальнейшие вмешательства с целью прерывания беременности на более поздней к тому моменту ее стадии или позволить развитие беременности с неизвестным риском для плода? Ввиду всего вышеизложенного мы провели мета-анализ с привлечением тех же данных и статистических методов, что были использованы в исследовании Kulier и соавт. [16], но вводя параметры «неудачи» (сохранение беременности) и «успеха» (полный аборт) в качестве конечных точек. Так же как и в мета-анализе Kulier и соавт., мы не принимали во внимание различия в дозировке ПГ и способах его приема.
Методы
Для мета-анализа отбирались только рандомизированные прямые сравнительные исследования разных доз мифепристона, принимаемых женщинами со сроком беременности до 63 дней, для того чтобы обеспечить сопоставимость групп пациентов. Помимо исследований, найденных Kulier и соавт. [16], мы также искали исследования, опубликованные начиная с 2004 г., в базах данных Medline и EMBASE (январь 2004 г. – декабрь 2005 г., статьи на английском или французском языках). Был использован метод поиска по медицинским предметным рубрикам и ключевым словам «мифепристон» (mifepristone) и «аборт-вызванный-искусственно» (abortion-induced), а также «беременность-первый-триместр» (pregnancy-trimester-first) или «прерывание беременности на ранней стадии» (early termination), или «ранняя индукция беременности» (early medical induction); поиск велся только среди контролируемых исследований. Один из исследователей (Regine Sitruk-Ware) отобрал и изучил все исследования и провел оценку клинической значимости отобранных результатов. Другой исследователь (Miechel Lievre) извлек информацию и провел статистический анализ.
В качестве других источников информации использовались регистрационные досье на лекарственные препараты и исходные данные ВОЗ, в которых содержались неопубликованные сводные таблицы по сохранившимся беременностям среди женщин с аменореей < 50 и ≥ 50 дней [7, 21].
В качестве критерия эффективности прерывания беременности были выбраны «полный успех» (т.е. полное удаление плода без необходимости применения хирургической операции) или «неудача» (т.е. сохранение беременности). Кроме того, изучалась информация о побочных эффектах (кровотечения, боль, тошнота).
Со времени проведения данного мета-анализа был выполнен более поздний поиск опубликованных данных с целью обнаружения новых публикаций по этой теме. Новых исследований обнаружено не было.
Статистический анализ
Мы использовали модель мета-анализа с фиксированными эффектами, основанную на математическом допущении, согласно которому в каждом исследовании оценивается общий терапевтический эффект. Получаемая в результате оценка суммарного терапевтического эффекта – это «действительный» или «фиксированный» терапевтический эффект, а доверительный интервал (ДИ) описывает уровень неточности данной оценки.
Рассматриваемый вопрос – это вопрос о не меньшей эффективности одной дозы препарата по сравнению с другой. Если 95 % ДИ различий между дозами 200 и 600 мг с точки зрения «успеха» и «неудачи» попадает в границы не меньшей эффективности, доза 200 мг мифепристона может считаться не менее эффективной по сравнению с дозой 600 мг. Граница не меньшей эффективности может быть установлена статистически (поддержание заданной величины эффективности по сравнению с плацебо) или клинически, т.е. речь идет о величине эффективности, которую допустимо потерять, т.к. она не является клинически значимой. Поскольку эффективность плацебо в качестве абортивного средства близка к нулю, статистическое определение не меньшей эффективности не имеет смысла, ибо аборт возникает более чем в 80 % случаев при дозе мифепристона 200 мг в случае отдельного приема. Основное методологическое требование состояло в том, чтобы границы не меньшей эффективности были определены проспективно или по крайней мере независимо от результатов испытаний, сравнивавших испытуемое лекарство с контрольным лекарством. Выбранные в настоящем исследовании границы не меньшей эффективности соответствовали диапазонам «успеха» и «неудачи», принятым регулирующими органами на момент выдачи первого регистрационного удостоверения на мифепристон. Границы не меньшей эффективности для «успеха» были установлены на уровне 4 % на основании результатов базовых исследований среди женщин с аменорей менее 50 дней [5, 6, 22]. Это соответствует допустимой относительной потере в эффективности около 4 %, что является очень низким показателем, но также увеличению приблизительно на 67 % количества допустимых «неудач», что можно считать очень высоким показателем. Граница не меньшей эффективности для «неудачи» (сохранение беременности) была установлена на уровне 0,5 %. Это соответствует допустимому увеличению количества «неудач» приблизительно на 40 %, что можно считать допустимым, поскольку случаи полной неудачи с сохранением беременности наблюдаются редко.
Было выполнено три анализа на чувствительность. Во-первых, нами было исключено исследование McKinley и соавт. [23], поскольку в нем использовалась доза мизопростола 600 мкг перорально. Такая высокая доза могла компенсировать возможную сниженную эффективность дозы мифепристона 200 мг. Во-вторых, поскольку анализ результатов пациентов с назначенным лечением (ITT) может искажать результаты в пользу не меньшей эффективности, мы провели анализ по протоколу (PP). Несмотря на то что группы пациентов в анализе по протоколу не были определены во всех исследованиях, мы приблизились к результатам РР путем исключения пациентов, результат лечения которых не был известен. Однако было невозможно исключить пациентов, которые не удовлетворяли критериям включения или отказались от приема ПГ. В-третьих, поскольку границы не меньшей эффективности для «успеха» и «неудачи» были установлены на основании результатов, полученных исключительно от женщин с аменореей < 50 дней, мы провели анализ в двух подгруппах женщин с аменореей < 50 и ≥ 50 дней.
Результаты
Нашим критериям включения соответствовали 4 рандомизированных контролируемых испытания (РКИ). Все они были опубликованы ранее 2004 г. и уже были представлены Kulier и соавт. [16].
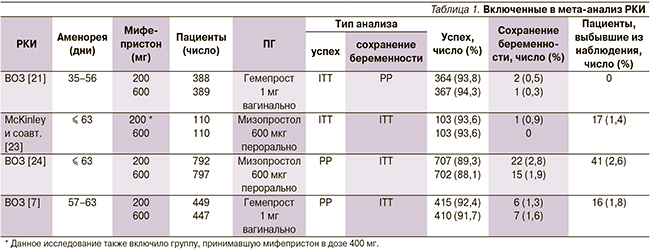
Описательные данные представлены в табл. 1 и 2. Данные исследования включали в общей сложности 3482 пациента, из которых 1739 (49,9 %) получали 200 мг и 1743 – 600 мг мифепристона. Тип, доза и способ введения ПГ различались в четырех исследованиях, как и интервал между приемом мифепристона и ПГ. Возможное влияние ПГ на результаты исследований не оценивалось. Сообщаемый уровень «успеха» (полный аборт) варьировался в диапазоне от 89,3 до 93,8 % для дозы 200 мг и от 88,1 до 94,3 % для дозы 600 мг. Процент сохранившейся беременности варьировался в диапазоне от 0,5 до 2,8 % в случае дозы 200 мг и от 0 до 1,9 % в случае дозы 600 мг.
В ходе первичного мета-анализа различие в «успехе» между дозами 200 и 600 мг мифепристона составило 0,4 % с ДИ 95 % – от -1,4 до 2,3 %. Поскольку нижний предел данного ДИ (-1,4 %) не достиг границы не меньшей эффективности -4 %, мы могли сделать следующее заключение: эффективность дозы 200 мг была не ниже таковой дозы 600 мг с точки зрения «успеха» (полный аборт). Различие по показателю «неудача» (сохранение беременности) между двумя группами доз составило 0,4 % с ДИ 95 % – от -0,3 до 1,0 %. Поскольку верхний предел данного ДИ (1,0 %) был выше границы не меньшей эффективности (0,5 %), нельзя было сделать заключение, будто эффективность дозы 200 мг не уступает таковой дозы 600 мг.
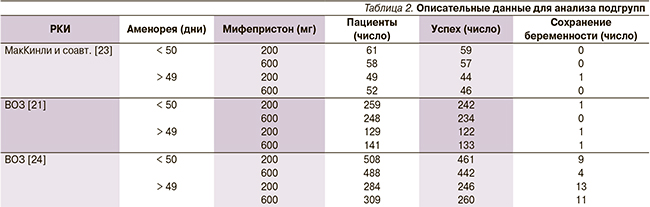
Три анализа на чувствительность подтвердили не меньшую эффективность в отношении «успеха». За исключением исследования McKinley [23], ДИ составил от -1,4 до 2,4 %. В анализе PP он достиг от -3,0 до 1,9 % среди женщин с аменореей < 50 дней и от -1,6 до 3,6 % среди женщин с аменореей ≥ 50 дней. Данные анализы на чувствительность, однако, не подтвердили не меньшую эффективность в отношении «неудачи». ДИ составили от -0,4 до 1,0 %, от -0,3 до 1,1 %, от -0,3 до 1,2 % и от -1,0 до 1,3 % соответственно. Результаты данных анализов на чувствительность могут быть предоставлены по запросу.
Безопасность 200 и 600 мг мифепристона в сочетании с ПГ
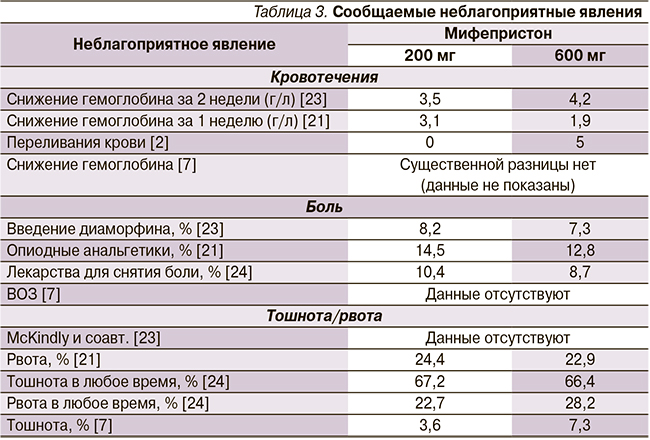
Из-за того что в четырех исследованиях сообщается о различных нежелательных явлениях, мы не смогли провести мета-анализ данных по нежелательным явлениям. Более подробные данные о таких явлениях, как кровотечение, боль и тошнота/рвота, представлены в табл. 3. О серьезных неблагоприятных явлениях не сообщалось ни в одном из четырех исследований. В одной работе высказывалось предположение, будто кровотечение может быть сильнее после приема 600 мг по сравнению с 200 мг мифепристона [24]. Это наблюдение не было подтверждено в других исследованиях.
В трех исследованиях [21, 23, 24] отмечается, что боль была несколько слабее при приеме ПГ после 600 мг, чем после 200 мг; в четверном исследовании [7] об этом не сообщается. В одной работе [7] указывается, что значительно большее число пациентов сообщали о тошноте после приема 600 мг мифепристона, однако это не было подтверждено в двух других исследованиях, располагавших информацией о тошноте у пациентов [21, 24].
Обсуждение
В результате проведенного мета-анализа четырех исследований, охвативших в общей сложности 3482 женщины, было установлено, что доза мифепристона 200 мг с последующим приемом мизопростола перорально или гемепроста вагинально имеет не меньшую эффективность по сравнению с дозой 600 мг с точки зрения «успеха» (который был определен как полный аборт), но не с точки зрения «неудачи» (под которой понималось сохранение беременности).
В такой стране, как Франция, где ежегодно совершается 100 тыс. медикаментозных абортов, систематическое использование дозы 200 мг вместо 600 мг мифепристона могло бы приводить к увеличению числа случаев сохранившихся беременностей на 1000. Этот результат имеет большую клиническую значимость, поскольку в этой ситуации требуется принятие решения: стоит ли продолжать меры по прерыванию беременности хирургическим способом на более поздней ее стадии или посоветовать женщине сохранить беременность и вести наблюдение? Риск патологии развития плода после воздействия двух препаратов, использованных для медикаментозного аборта, не известен, поскольку трудно установить причинно-следственную связь с исследуемым препаратом [25]. В США инструкция по применению препарата содержит предупреждение о риске патологии развития плода, а в европейской инструкции по применению рекомендуется внимательное наблюдение за беременностью с помощью ультразвукового метода, в том случае если женщина решает сохранить беременность.
Одна из трудностей настоящего исследования заключалась в необходимости установить границы не меньшей эффективности до проведения мета-анализа. Границы были выбраны на основании данных регистрационного удостоверения на мифепристон в показаниях к применению для прерывания беременности, т.е. до выполнения исследований, сравнивавших дозы 200 и 600 мг мифепристона. Выбранный диапазон (-4 % для полного аборта) был очень узким, однако даже более узкий диапазон (-1,6 %) все еще свидетельствовал бы о не меньшей эффективности. Не меньшая эффективность была подтверждена на двух подгруппах пациентов (с аменореей > 50 и ≥ 50 дней) и в рамках нескольких анализов на чувствительность. На этом основании становится очевидным, что полный аборт после применения 200 мг мифепристона может быть достигнут с такой же вероятностью, как и после 600 мг.
В свете результатов, касающихся «успеха» лечения, не очень просто понять, почему исследования не смогли продемонстрировать не меньшую эффективность дозы 200 мг в плане «неудачи» лечения (сохранение беременности). Несколько гипотез могут объяснить этот результат:
1. Возможно, была установлена слишком строгая граница не меньшей эффективности (0,5 %). Граница выше 1,1 % позволила бы сделать заключение, будто доза 200 мг имеет не меньшую эффективность, чем доза 600 мг. Однако подобная граница означала бы признание двукратного увеличения среднего уровня сохранившейся беременности, наблюдаемого в трех базовых испытаниях [5, 6, 22], особенно среди женщин с аменореей < 50 дней. Это недопустимо в отсутствие преимуществ с точки зрения безопасности при приеме более малой дозы; таких преимуществ выявлено не было. Если бы мы вычислили ДИ 97,5 % (двусторонний) вместо 95 % для того, чтобы компенсировать множественную проверку гипотезы (две конечные точки, изучаемые одновременно), ДИ был бы шире и не меньшая эффективность была бы исключена, даже если граница не меньшей эффективности была бы установлена на уровне 1,2 %.
2. Возможно, на результат повлияли тип и доза ПГ, а также способ его введения. Вагинальный прием гемепроста может быть более эффективным, чем пероральный прием 400 мкг мизопростола и, таким образом, способен компенсировать потенциально более низкую эффективность 200 мг мифепристона по сравнению с 600 мг [7, 21]. Вторичный мета-анализ только двух исследований, в которых использовался гемепрост, свидетельствует о менее выраженной тенденции в пользу 600 мг при точечной оценке (на 0,2 % больше сохранившихся беременностей) с ДИ 95 % от -0,6 до 0,9 %, что не позволило сделать заключение о не меньшей эффективности, но этот мета-анализ включал очень малое число случаев (дополнительные таблицы могут быть предоставлены по запросу). При этом влияние пероральной дозы мизопростола (400 или 600 мкг) не было подкреплено анализом на чувствительность. Правда, исключенное из анализа на чувствительность исследование имеет наименьший вес, поскольку оно было самым небольшим и в нем сообщалось только об одном случае сохранившейся беременности, но его результаты не говорят, будто прием 600 мкг мизопростола перорально имеет более высокую эффективность, чем 400 мкг [23].
3. Было недостаточно данных для надежной оценки не меньшей эффективности. Уровень «неудачи» бы оценен на основании очень незначительного числа случаев, что увеличивает ДИ различий. Однако исследования были хорошо согласующимися (однородность, p = 0,73) даже при анализе подгрупп. При этом единственное исследование с большим числом случаев показало незначительную тенденцию в пользу 600 мг, хотя следует отметить, что в каждом центре проходили лечение только 50 или 100 пациентов и эффективность между центрами различалась довольно сильно – от 77 до 100 % [24].
4. Продолжительность беременности не была причиной относительной эффективности 200 мг мифепристона по сравнению с 600 мг с точки зрения «неудачи», поскольку одинаковые результаты наблюдались у женщин с аменореей < 50 и ≥ 50 дней.
Чтобы считаться приемлемым, любое снижение эффективности в плане числа сохранившихся беременностей при приеме 200 мг мифепристона должно компенсироваться преимуществами с точки зрения безопасности, более простого использования, стоимости и т.д. В четырех исследованиях не было представлено доказательств явных преимуществ применения дозы 200 мг мифепристона совместно с пероральным приемом мизопростола по утвержденной схеме с точки зрения безопасности, поскольку увеличение числа сохранившихся беременностей представляет собой серьезную клиническую проблему. Кроме того, более низкое число возникших неблагоприятных явлений трудно оценить, поскольку ПГ принимается вскоре после приема мифепристона. Во Франции и некоторых других европейских странах в большинстве рецептов на мифепристон используется утвержденная схема приема: 600 мг мифепристона с последующим приемом 400 мкг мизопростола перорально, в то время как в США отдается предпочтение сниженной дозе мифепристона с последующим приемом 400 или 800 мкг мизопростола вагинально – данная схема приема была протестирована в нескольких исследованиях, показавших высокий уровень ее эффективности. Однако недавно были сделаны предупреждения, подчеркивающие необходимость придерживаться утвержденной схемы приема по причине возникновения внутриматочных инфекций (которые в редких случаях могут быть смертельными), что породило дискуссии относительно вагинального приема мизопростола [26].
Стоимость мифепристона 600 мг, конечно, выше, чем мифепристона 200 мг, и вопрос цены может представлять проблему на уровне как социума в целом, так и отдельных пациентов в зависимости от системы здравоохранения. Применение более низкой дозы мифепристона было предложено с целью найти наименьшую эффективную дозировку и снизить стоимость медикаментозного метода прерывания беременности. Вагинальное введение мизопростола использовалось, чтобы сохранить эффективность лечения вплоть до 63-дневной беременности, поскольку было установлено, что эффективность перорального приема мизопростола после мифепристона не подходит для прерывания беременности свыше 49 дней. Однако форма выпуска мизопростола предназначена только для перорального приема, а специальной лекарственной формы, разработанной и разрешенной для вагинального введения, на данный момент не существует.
На уровне всего социума, однако, анализ стоимости должен включать дополнительные затраты, связанные с сохранением беременности, в случае перорального использования мизопростола согласно действующим рекомендациям. В настоящее время ведется дополнительное исследование, в рамках которого проверяется доставка мизопростола путем рассасывания под языком или в щечном кармане, что может увеличить биодоступность молекулы и улучшить эффективность [27]. Предварительные результаты показали, что буккальная доставка мизопростола более эффективна, чем пероральный прием (в группе пациентов, среди которых использовался буккальный метод приема препарата, сохранилось меньшее число беременностей), и этот способ приема может стать в будущем более эффективным вариантом введения ПГ, в случае если появятся необходимые лекарственные формы [28]. Относятся ли результаты нашего мета-анализа к буккальному методу введения мизопростола, неизвестно, т.к. отсутствуют сравнительные данные по двум дозам мифепристона при буккальном методе введения и мы не смогли включить его в нашу оценку. На уровне отдельных пациентов женщины могут остановить свой выбор на 200 мг исходя из соображений экономии, но с этической точки зрения это допустимо, только если эти женщины были полностью информированы о различных существующих схемах приема и возможных последствиях в плане вероятности сохранения беременности. Из-за отсутствия достоверных рандомизированных исследований настоящий мета-анализ не дал возможности оценить, может ли прием мизопростола по более активной схеме (предписано 36 часов после приема мифепристона) позволить использование дозы 200 мг мифепристона без снижения эффективности по сравнению с дозой 600 мг. В некоторых испытаниях мизопростол назначался в дозе 800 мкг перорально или вагинально после перорального приема 200 мг мифепристона [29, 30]. Эти испытания, однако, не предоставили доказательств того, что высокие дозы мизопростола или его вагинальное использование приводят к более высокой эффективности или переносимости по сравнению с утвержденной схемой приема. Данный вопрос может быть рассмотрен в рамках большого рандомизированного факториального исследования, сравнивавшего две дозировки мизопристона (200 и 600 мг) и разные схемы приема мизопростола (т.е. 400 мкг перорально, 800 мкг перорально и 800 мкг вагинально).
В заключение отметим, что имеющиеся доказательства не позволяют говорить о возможности замены дозы 600 мг мифепристона дозой 200 мг в целях медикаментозного прерывания беременности при приеме в сочетании с утвержденной дозой 400 мкг мизопростола перорально, за исключением случаев, когда единственным значимым результатом считается «успех» и когда превышенный уровень сохранившихся беременностей считается второстепенным по клинической значимости, что является спорным моментом. Другие схемы приема оказались успешными: прием 200 мг мифепристона с последующим вагинальным введением ПГ, таких как гемепрост, но соответствующие лекарственные формы для вагинальной доставки ПГ отсутствуют во многих странах. Кроме того, возможность введения мизопростола вагинальным путем недавно была поставлена под вопрос [26]. Необходимо проведение дальнейших исследований для разработки более совершенных лекарственных форм ПГ [27, 28] в качестве эффективного компонента медикаментозного метода прерывания беременности с использованием мифепристона.
Благодарность
Выражаем свою признательность исследователям ВОЗ за предоставленную информации для анализа по подгруппам среди женщин с аменореей до 50 и ≥ 50 дней.



