Введение
Проблема мочекаменной болезни (МКБ) сохраняет свою актуальность во всем мире в связи с неуклонным ростом заболевания, который ежегодно составляет 0,5–5,3 %. Абсолютное количество зарегистрированных больных МКБ в Российской Федерации в 2010 г. составило 760 237, а показатель числа зарегистрированных больных на 100 тыс. всего населения с 2006 по 2010 г. увеличился с 481,6 до 535,7 соответственно. По сравнению с 2005 г. прирост абсолютного числа пациентов с МКБ составил +15,7 %, а показатель числа зарегистрированных больных на 100 тыс. всего населения имел прирост +15,8 % [1, 2]. В настоящее время причины МКБ изучены недостаточно. Из-за отсутствия эффективных патогенетических методов лечения и метафилактики уролитиаза в 35–75 % заболевание носит рецидивирующий характер.
В результате нередко приходится прибегать к хирургическим вмешательствам, которые в 22–28 % приводят к различным осложнениям, в 11 % заканчиваются нефрэктомией и в 3 % случаев – летальным исходом [3, 4]. В отечественной и зарубежной литературе найдены единичные сообщения о значении и способах коррекции метаболических нарушений при МКБ. У 70 % больных МКБ диагностируется в наиболее трудоспособном возрасте 30–60 лет, 2/3 больных составляют мужчины. Исходя из этого, определенный интерес вызывает изучение особенностей этиопатогенетических механизмов нефролитиаза у мужчин, связанного с гормональными изменениями в организме. Физиологический уровень тестостерона необходим для нормального метаболизма витамина Д, который в свою очередь влияет и регулирует минеральный обмен, в частности, кальция и фосфора [5–14]. Поиск новых механизмов патогенеза и усовершенствование методов диагностики, лечения, профилактики и метафилактики уролитиаза определяют актуальность настоящего исследования. Его целью стало выявление метаболических нарушений и разработка эффективных методов метафилактики уролитиаза.
Материал и методы
В исследуемую группу вошел 221 пациент в возрасте от 20 лет до 81 года (мужчин – 112, женщин – 109), наблюдавшийся в клинических базах кафедры урологии и андрологии СПбМАПО и урологическом отделении Елизаветинской больницы. Для оценки эффективности разработанных методов патогенетической и противорецидивной терапии уролитиаза пациенты I группы были разделены на основную (140) и контрольную (81) подгруппы и в течение 6 лет находились под диспансерным наблюдением. В связи с отсутствием нормативных физико-химических и биохимических показателей камнеобразующих свойств мочи и крови для их определения были обследованы 50 здоровых людей (по 25 мужчин и женщин) в возрасте от 20 до 80 лет (средний возраст – 48,9 года), из которых была образована контрольная группа. Для оценки камнеобразующих свойств мочи определены циклический аденозинмонофосфат, показатели поверхностно-свободной энергии, электропроводности, осмолярности и кристаллоингибирующей активности мочи, косвенно отражающих степень ее кристаллизации.
О коллоидном состоянии судили по кинематической вязкости мочи.
Результаты и обсуждение
При сравнении нормативных показателей, полученных от здоровых людей, с результатами больных уролитиазом были получены достоверные различия (р < 0,001). По сравнению со здоровыми у всех пациентов с МКБ из-за уменьшения потребляемой жидкости в 2,2 раза достоверно снижен суточный диурез, в 1,4 раза увеличена экскреция кальция и неорганического фосфора, в 1,5 раза – оксалата кальция и мочевой кислоты; концентрация цитратов и экскреция магния снижены в 1,3 раза, повышена осмолярность мочи (р < 0,001). В плазме крови были достоверно повышены уровни ионизированного кальция (в 1,2 раза) и мочевой кислоты (в 1,6 раза), а концентрация магния снижена в 1,3 раза (р < 0,001). Таким образом, изученные показатели можно считать достоверным фактором риска МКБ и критерием эффективности лечения.
В результате обследования пациентов исследуемой группы были обнаружены следующие основные виды метаболических нарушений. Гиперкальциурия наблюдалась у 64,6 % пациентов: абсорбтивный тип – в 51,9 %, резорбтивный – в 29,8 %, почечный – в 9,6 % и идиопатический – в 8,7 % случаев. Гиперурикурия в сочетании с гиперурикемией выявлялена у 28,6 %, гиперфосфатурия у 98,8 %, гипероксалурия у 67,1 % пациентов и почти всегда сопровождалась гиперкальциурией.
При исследовании гормонального статуса 82 мужчин исследуемой группы в возрасте от 30 до 82 лет симптомы возрастного андрогенного дефицита (ВАД) были обнаружены у 43 (52,4 %) пациентов: у 30 (36,6 %) основной и у 13 (15,8 %) контрольной подгрупп. Из них у 19 (23,2 %) (11 в основной и 8 в контрольной подгруппах) уровень тестостерона находился на нижней границе нормы и у 24 (29,2 %) (у 19 в основной и 5 в контрольной подгрупп) был ниже нее. Уровень общего тестостерона у здоровых мужчин находился в пределах средних значений нормы (23,47 ± 0,27 нмоль/л), а у больных уролитиазом – нижних значений нормы (14,63 ± 0,89 нмоль/л), за счет чего при МКБ наблюдалось достоверное снижение индекса свободного тестостерона (р < 0,001).
Показатели глобулина, связывающего половые стероиды и лютеинизирующего гормона, также колебались в пределах нормы, но по сравнению со здоровыми мужчинами были выше в 1,6 и 1,9 раза соответственно (р < 0,001). При ВАД отмечен резорбтивный тип гиперкальциурии с гиперкальциемией у 11 (соответственно 8 и 3 в подгруппах), гиперурикурия и гиперурикемия – у 9 мужчин (соответственно 7 и 2 в подгруппах), и у 4 человек основной подгруппы была смешанная форма с одновременным повышением уровня кальция и мочевой кислоты в крови и моче.
Коррекция гормонального статуса осуществлена по разработанному нами способу (приоритетная справка № 2008144526) 90 пациентам основной подгруппы, из которых 30 получали 50 мг андрогеля при уровне тестостерона на нижней границе нормы (11 мужчин) или 100 мг (по 50 мг 2 раза в сутки) при ВАД (19 мужчин) с контролем за его концентрацией в плазме крови каждые 3–6 месяцев для выбора адекватной поддерживающей дозы препарата, а 60 пациентов получали внутримышечные инъекции 4 мл масляного раствора тестостерона ундеканоата с интервалом 1 раз в 10–14 недель. Всем больным проведено пальцевое ректальное исследование простаты, трансректальное ультразвуковое исследование простаты и определение концентрации простатического специфического антигена сыворотки крови до начала лечения и раз в год на фоне проводимого лечения.
Одновременно с андрогенозаместительной терапией для стимуляции продукции собственного тестостерона клетками Лейдига в течение месяца назначались аналоги коферментов биологического окисления: токоферол ацетат по 0,1 г 2 раза в сутки, Никошпан по 1 таблетке 2 раза в сутки, цитохром С – 0,25 % 4,0 мл 1 раз в сутки внутримышечно и антигипоксант Милдронат по 2 (0,25 г) капсуле 2 раза в день (патент № 2179025), а также хорионический гонадотропин по 1500 МЕ три раза в неделю в течение 30 дней три раза в год с определением объема яичек при помощи ультразвуковой диагностики.
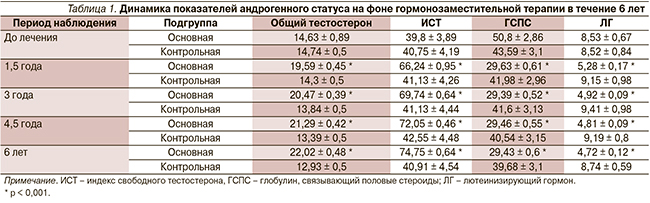
Динамика изменения средних показателей гормонального статуса всех обследованных мужчин на фоне андрогенотерапии представлена в табл. 1. На фоне гормонзаместительной терапии через 1,5 года общий тестостерон в основной подгруппе достоверно повысился до 19,59 ± 0,45 нмоль/л, а в контрольной продолжал снижаться (р < 0,001). Такая тенденция сохранялась в обеих подгруппах в течение последующих 6 лет. Индекс свободного тестостерона в течение 1,5 лет достиг нормального уровня и оставался таким 6 лет, а в контрольной подгруппе он постепенно снижался. Глобулин, связывающий половые стероиды, и лютеинизирующий гормон снизились до уровня здоровых людей (р < 0,001), а в контрольной группе оставались практически без изменения (р ≥ 0,05).
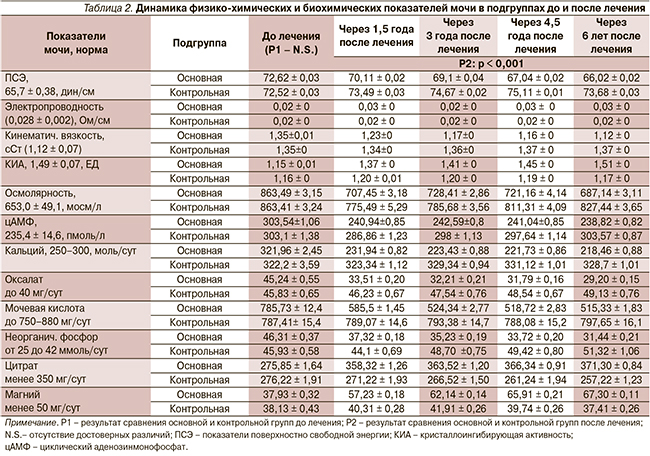
Результаты физико-химических и биохимических показателей мочи до и после тестостеронзаместительной терапии в подгруппах, представленые в табл. 2, демонстрируют снижение литогенности мочи пациентов основной подгруппы (р < 0,001).
В зависимости от вида метаболических нарушений назначалась соответствующая диета и медикаментозная терапия, включающая тиазидные диуретики, аминобисфосфонаты, ортофосфаты, препараты магния и этидроновой кислоты, алкализирующие цитратные смеси, витамин В6, аллопуринол, метионин. Потребление жидкости составляло не менее 2 литров в сутки. При инфекционном уролитиазе проведена антибактериальная терапия.
Одновременно с коррекцией метаболических нарушений у всех пациентов основной подгруппы исследуемой группы для стабилизации коллоидных свойств мочи применен собственный способ профилактики рецидивного камнеобразования (патент № 2320368). Он заключался во внутримышечном введении препарата с протеолитической активностью в суммарной дозе 108000 МЕ в течение 8 месяцев по следующей схеме: первая инъекция выполнена в стационаре за 3 дня до дробления или удаления камня, последующие введения такой же дозы препарата осуществлены после проведенных манипуляций один раз в 3 дня № 5, затем раз в 5 дней № 15 и далее раз в 10 дней № 15 (всего 36 инъекций) в амбулаторном режиме.
Пациенты основной подгруппы получали консервативную, патогенетическую и противорецидивную терапию уролитиаза, а в контрольной подгруппе только традиционные методы лечения (антибиотики, уросептики, спазмолитики, фитопрепараты).
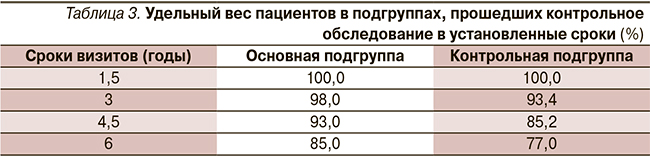
Под диспансерным наблюдением в течение 6 лет находился 181 (81,9 %) пациент исследуемой группы. Хронология визитов и удельный вес пациентов, прошедших контрольное обследование по подгруппам, представлены в табл. 3.
Анализ частоты рецидивного уролитиаза в подгруппах в зависимости от сроков контрольного обследования показал следующее. В отличие от контрольной в основной подгруппе в результате включения в комплексное лечение новых методов коррекции и профилактики МКБ в течение 1,5 лет ни одного рецидива не наблюдалось. В дальнейшем их частота была крайне низкой и при обследовании через 6 лет составила всего лишь 8,6 %.
Причем из 12 пациентов у 9 обнаружены микролиты и только у 3 больных размеры камней варьировались в пределах 11–12 мм. В контрольной подгруппе, где применялись традиционные методы лечения и профилактики МКБ, через 1,5 года рецидивы выявлены у каждого третьего, а через 3 – практически у половины обследованных пациентов. В более поздние сроки частота оставалась на достаточно высоком уровне: через 4,5 и 6,0 лет рецидивные камни были обнаружены у 29 (35,8 %) и 24 (29,6 %) пациентов соответственно. В половине случаев в разные сроки были выявлены микролиты, а у остальных размеры камней превышали 7 мм и колебались от 7 до 12 мм через 1,5 года до 7–30 мм через 6 лет наблюдения.
Выводы
Таким образом, среди метаболических нарушений, выявленных у жителей Санкт-Петербурга, больных уролитиазом, наиболее часто встречаются гиперфосфатурия – 98,8 %, гипероксалурия в сочетании с гиперкальциурией – 67,1 %, гиперкальциурия – 64,6 % и гиперурикурия с гиперурикемией – 28,6 % пациентов. Коррекция метаболических нарушений и разработанная по собственной схеме патогенетическая терапия уролитиаза приводят к достоверному уменьшению частоты рецидивов МКБ. Можно считать, что физико-химические показатели объективно характеризуют камнеобразующие свойства мочи, являются достоверным фактором риска МКБ и критерием эффективности лечения. Возрастной андрогенный дефицит у мужчин остается патогенетическим фактором камнеобразования. При исследовании гормонального статуса он выявлен у 29,2 % мужчин, больных уролитиазом. Заместительная терапия со стимуляцией продукции эндогенного тестостерона у мужчин, больных уролитиазом, с андрогенным дефицитом приводит к снижению литогенных свойств мочи и торможению процесса камнеобразования за счет восстановления гормонального баланса, повышения уровня цитрата, снижения уровня кальция и мочевой кислоты в крови и моче. Диспансерное наблюдение пациентов, страдающих уролитиазом, позволяет своевременно выявлять и воздействовать на главные и второстепенные факторы камнеобразования, способствовать снижению частоты рецидивного уролитиаза.


