Бронхиальная астма (БА) – хроническое заболевание дыхательной системы, поражающее людей всех возрастов, и адекватный контроль симптомов этой патологии представляет собой не только медицинскую, но и социально-экономическую, а также общегуманитарную проблему.
Эпидемиологические данные ВОЗ относительно БА настораживают. Несмотря на появление новых препаратов, постоянное совершенствование лечебных стратегий и профилактических мероприятий, более 300 млн человек в мире страдают БА и рост заболеваемости продолжается. Астма становится одним из наиболее распространенных заболеваний в детской популяции. На БА приходится 1 из 250 летальных исходов во всем мире, более 80 % смертных случаев приходится на страны с низким экономическим развитием. Во всем мире данные официальной статистики БА не соответствуют реальным цифрам заболеваемости, а большая часть пациентов не получают адекватного лечения [1]. В настоящее время контроль БА находится во всех странах на уровне 50 % независимо от экономического положения или доступности медицинской помощи.
К основной цели лечения БА, пропагандируемой Глобальной инициативой по астме (GINA), относится достижение и поддержание оптимального контроля заболевания. Современные руководства по БА декларируют, что большинство пациентов с астмой могут достигать полного контроля заболевания и вести нормальный образ жизни, который не будут ограничивать ни симптомы БА, ни побочные эффекты терапии [2].
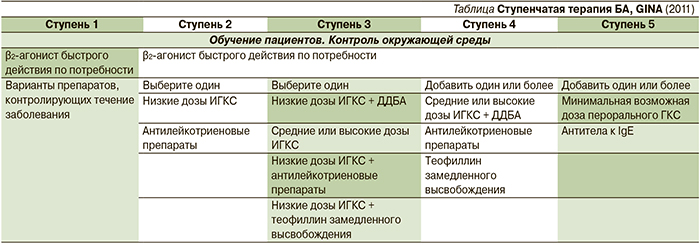
GINA рекомендует ступенчатый подход к лечению БА, который зависит от текущего уровня контроля БА и текущей терапии пациента (см. таблицу). Каждая ступень включает варианты фармакологического воздействия, которые могут служить альтернативой при выборе базисной терапии, но они не одинаковы по эффективности. Эффективность терапии возрастает от ступени 1 к ступени 5.
В настоящее время ИГКС (ингаляционные глюкокортикостероиды) являются самыми эффективными противовоспалительными препаратами в терапии БА, применение которых начинается со 2-й ступени и присутствует в качестве обязательного компонента на всех последующих.
Сегодня существует ряд ИГКС для лечение БА: беклометазона дипропионат (БДП), будесонид (БУД), флутиказона пропионат (ФП), флунисолид, триамцинолона ацетонид, циклесонид, мометазона фуроат. Все ИГКС имеют достаточную для клинического эффекта противовоспалительную активность, и несмотря на некоторые различия в их фармакологических свойствах, определяемых in vitro, в настоящее время отсутствуют четкие доказательства различий в местной активности ИГКС in vivo. Сравнение преимуществ одного ИГКС перед другим затруднительно из-за их дозозависимой эффективности.
Второй группой препаратов, чаще всего используемых в базисной терапии БА, являются ДДБА (длительно действующие β2-агонисты). На сегодняшний день существует два препарата, относящихся к группе ДДБА: формотерола фумарат (ФФ) и салметерола ксинафоат. Однако необходимо отметить, что оба принадлежат к разным химическим классам: ФФ является дериватом фенилэтаноламина, а салметерол структурно напоминает сальбутамол. Существенные различия между ФФ и салметеролом присутствуют и в механизме действия на уровне тканей. Они обладают разной липофильностью. Сальбутамол – β2-агонист короткого действия, который наиболее часто используется как препарат купирования симптомов астмы (по потребности), проникает к рецептору через водную фазу и оказывает быстрый (через 2–3 минуты), но непродолжительный (4–6 часов) эффект. Салметерол, обладая высокой липофильностью, первоначально проникает через клеточную мембрану, а затем взаимодействует с рецептором, что хотя и обеспечивает длительное действие препарата (12 часов), но эффект наступает гораздо медленнее (20–30 минут). ФФ использует оба этих механизма. Благодаря уникальной промежуточной липофильности он действует как быстрый агент, т.е. немедленно (1–3 минуты), но в то же время не теряет продолжительности действия (12 часов). Сочетание быстрого эффекта и возможности многократного дозирования позволило провести соответствующие клинические исследования и рекомендовать ФФ как для базисной терапии БА, так и для быстрого купирования симптомов в режиме «по потребности»[3].
Современные руководства рассматривают в качестве нового «золотого» стандарта терапии БА комбинацию ИГКС и ДДБА. Комбинированные препараты назначают в тех ситуациях, когда течение заболевания не контролируется стандартными дозами ИГКС, начиная с 3-й ступени терапии по схеме GINA. Оказалось, что в подобных соединениях ГКС и пролонгированный β2-агонист обладают комплементарным действием и их клинический эффект существенно превышает таковой в случае монотерапии ИГКС или ДДБА [4].
Безусловным преимуществом этих препаратов, особенно привлекающим пациентов, страдающих БА, считается сочетание двух активно действующих субстанций в одном устройстве для ингаляций. До недавнего времени было доступно два препарата, содержащих комбинацию БУД + ФФ и ФП + салметерол. Третьим представителем этой группы медикаментов на фармакологическом рынке Европы и России стала комбинация БДП + ФФ.
Фиксированная комбинация БДП и ФФ в дозе 100/6 мкг, которая выпускается на основе ингаляционной технологии Модулит®.
Изначально считалось, что вклад периферического сопротивления в общее сопротивление легких минимален. Позднее было показано, что периферическое сопротивление составляет от 50 до 90 % общего сопротивления как в здоровых, так и в легких больных хроническими обструктивными заболеваниями [5].
За периферическое сопротивление отвечают мелкие дыхательные пути, к которым относят бронхи с внутренним диаметром ≤ 2 мм (или окружностью базальной мембраны ≤ 6 мм). В стенке этих дыхательных путей нет хряща, но отмечается значительное количество гладких мышц. Они включают мембранозные и терминальные бронхиолы, служащие воздухопроводящими структурами, и респираторные бронхиолы, имеющие в своей стенке альвеолы. Некоторые воспалительные и структурные изменения в их дистальном отделе распространяются на периваскулярную область и перибронхиальные альвеолы, нарушая нормальное прикрепление последних. Это, вероятно, обусловливает функциональные нарушения на данном уровне – экспираторное закрытие дыхательных путей с формированием «воздушных ловушек» и снижение эластической отдачи легких [6, 7].
В настоящее время активно разрабатываются ингаляционные устройства для улучшения доставки противовоспалительных препаратов на периферию легкого. С этим связана возможность улучшения результатов длительного лечения больных БА.
Основные типы систем доставки:
- дозированные аэрозольные ингаляторы (ДАИ);
- дозированные порошковые ингаляторы;
- небулайзеры.
К достоинствам ДАИ относятся их удобство, портативность, быстрота обращения с ними, низкая стоимость. В клинической практике ДАИ используются уже более 50 лет, классические ДАИ содержат микронизированный препарат в виде суспензии и фреон – пропеллент группы хлорфторуглеводов (ХФУ). Однако ХФУ, содержащиеся в ДАИ, оказывают повреждающее действие на озоновый слой атмосферы и могут быть причиной глобального потепления климата (парниковый эффект). Поэтому в соответствии с Монреальским протоколом (1989) пропеллент на основе ХФУ был заменен на гидрофторалкан (ГФА-134a).
В отличие от ХФУ ГФА-134a не содержит атома хлора и не вызывает разрушения озонового слоя. Для решения технологических проблем, связанных с замещением пропеллентов ХФУ на экологически безопасные пропелленты ГФА, была предложена новая технология – Модулит. Кроме пропеллента ГФА-134a в новой технологии используются этанол (в качестве косолвента) и глицерин или полиэтиленгликоль (в качестве модификатора размера частиц аэрозоля). Особое внимание также уделяется таким конструктивным особенностям ДАИ, как диаметр отверстия актуатора, отмеренный объем дозы и паровое давление пропеллента [5].
Применение технологии Модулит позволяет генерировать частицы аэрозоля с заданными размерами – очень мелкие (0,8–1,2 мкм), способные при вдыхании гомогенно и равномерно распределяться по всему бронхиальному дереву. Благодаря этой технологии в комбинированном препарате БДП + ФФ доза БДП в одном вдохе в 2,5 раза меньше, чем в БДП-ХФУ, а доза ФФ остается без изменений. Заданные размеры частиц БДП и ФФ – 1,4 и 1,5 мкм соответственно. Это способствует равномерному распределению обоих препаратов в одних и тех же отделах бронхиального дерева. Причем совпадение точек локализации откладываемых препаратов приводит к синергизму, усилению суммарного взаимодействия ИГКС и ДДБА в проявлении противовоспалительного действия [5].
Преимущества технологии Модулит:
- Стабильность и эквивалентность каждой дозы, доставляемой в легкие.
- Гибкость в формировании аэрозольного облачка, более вытянутого, медленно передвигающегося, со сниженной «перистой» вязкостью, поступающего в дыхательные пути с меньшей скоростью, что значительно уменьшает инерционное осаждение в крупных дыхательных путях и предотвращает развитие местных нежелательных эффектов, бронхоспазма.
- Увеличение времени после нажатия на клапан для координации вдоха больным.
- Возможность модулировать размер частиц аэрозоля и количество лекарственного средства, достигающего легких (инспирабельную дозу), манипулируя количеством нелетучих компонентов в растворе и размером диаметра отверстия клапана.
- Возможность доставлять лекарственное средство в легкие вне зависимости от состояния бронхиальной проходимости.
Известный пульмонолог Р. Barnes высказал предположение, будто новый комбинированный препарат БДП + ФФ может быть использован в виде стратегии MART, когда пациент получает комбинированный препарата в качестве основной базисной терапии и ситуационно – для купирования симптомов [8]. Поскольку в состав фиксированной комбинации БДП + ФФ входит ДДБА ФФ, который обеспечивает быстрое облегчение симптомов и может быть использован в гибких дозах, D. Singh и соавт. провели рандомизированное исследование, включившее 18 больных БА (средний ОФВ1 – 65 %), регулярно получавших БДП/ФФ Модулит в дозе 100/6 мкг 2 раза в сутки. Этим пациентам назначали либо 10 доз БДП + ФФ 100/6 мкг, либо 10 доз ФФ 6 мкг, либо 10 доз плацебо. К основной задаче исследования относится проверка безопасности высоких доз комбинированного препарата, которые теоретически могут быть использованы больным БА во время MART-терапии. У больных БА не было отмечено различий по уровням лактата, интервала QTc на ЭКГ, пульса и артериального давления после приема высоких доз БДП + ФФ, ФФ и плацебо. Только на фоне ФФ наблюдалось более выраженное снижение сывороточного калия (различие с БДП + ФФ и плацебо 0,11 и -0,15 ммоль/л соответственно; p < 0,05). Таким образом, больные БА хорошо переносили высокие дозы БДП + ФФ Модулит, которые демонстрировали профиль безопасности, сходный с обычно наблюдаемым при приеме высоких доз ФФ [9].
В нескольких исследованиях была проведена оценка влияния ультрамелкодисперсного БДП на мелкие дыхательные пути. Повышение экспираторных потоковых показателей было отмечено при добавлении ультрамелкодисперсного БДП к обычной дозе ИГКС пациентам с плохо контролируемой астмой [10], а также больным БА, которым впервые в жизни был назначен ИГКС (им являлся БДП в виде ДАИ HFA) [11]. Кроме того, в одном из исследований, в котором для оценки плотности легких использовали компьютерную томографию, было показано, что выраженность воздушных ловушек была меньше при терапии ультрамелкодисперсным БДП по сравнению с БДП в виде ДАИ CFC [12]. В другом исследовании изучались последствия перевода больных БА с терапии традиционными ИГКС (БДП и ФП в виде дозированных аэрозольных ингаляторов) на ультрамелкодисперсный БДП [13]. Несмотря на то что сравнивались различные ИГКС, данные этого исследования позволяют сделать следующий вывод: ультрамелкодисперсные препараты ИГКС способны положительно влиять на функциональные и воспалительные изменения мелких дыхательных путей, которые неадекватно контролируются с помощью традиционных препаратов.
Можно предположить, что увеличение депозиции ИГКС может быть связано с повышением частоты развития системных побочных эффектов, таких, например, как супрессия продукции эндогенного кортизола, однако результаты проведенных клинических исследований не подтверждают возрастания их риска при терапии ультрамелкодисперсным БДП [14].
Новая ультрамелкодисперная фиксированная комбинация БДП + ФФ оказалась более эффективным, чем БДП в виде ДАИ CFC, препаратом по влиянию на функциональные показатели, хотя суточные дозы БДП в группе комбинированной терапии были в 2,5 раза ниже [15, 16].
N. Scichilone и соавт. провели сравнение эффективности терапии ультрамелкодисперсной комбинацией БДП + ФФ в дозе 400/24 мкг/сут и ФП/салметерол в дозе 500/100 мкг/сут на протяжении 12 недель 30 больных БА [17]. Оба вида терапии ИГКС/ДДБА привели к значительному приросту ОФВ1 (в среднем на 0,37 литра), однако гиперреактивность дыхательных путей достоверно снизилась только у пациентов, получавших БДП + ФФ, что является признаком улучшения функции дистальных дыхательных путей. В работах, сравнивавших БДП + ФФ с другими фиксированными комбинациями (ФП + салметерол и БУД + ФФ), не было выявлено различий между препаратами по влиянию на функциональные и клинические показатели, числу обострений и нежелательных реакций. Интересно отметить, что терапия БДП + ФФ приводила к достоверно большему увеличению форсированной жизненной емкости легких по сравнению с терапией ФП + салметеролом, что свидетельствует о более «дистальных эффектах». В этих исследованиях номинальные дозы БДП и БУД или ФП имели соотношение 1,0 : 2,5, что указывает на способность комбинации БДП + ФФ обеспечивать большую, чем традиционные препараты, эффективность в перерасчете на 1 мг ИГКС [18, 19]. В дополнение к этому недавно опубликованное исследование G. Huchon и соавт., включившее 596 пациентов со среднетяжелой и тяжелой БА, продемонстрировало, что ультрамелкодисперсная фиксированная комбинация БДП + ФФ позволяет добиваться лучшего, чем свободная комбинация неультрамелкодисперсного БДП и ФФ, контроля над астмой [16]. Тяжелых обострений БА в группе фиксированной комбинации было достоверно меньше.
В данном исследовании доза БДП в комбинации БДП + ФФ также была в 2,5 раза ниже, чем в препаратах сравнения.
Заключение
При неэффективности низких доз ИГКС современные руководства рассматривают в качестве нового «золотого» стандарта терапии БА комбинацию ИГКС и ДДБА, причем лучший эффект имеет место в случае, если два препарата назначаются в одном ингаляторе. комбинированный препарат БДП + ФФ – это комбинация давно изученных лекарственных средств (БДП и ФФ), эффективность которых доказана массой исследований и клиническим опытом. Благодаря технологии Модулит в фиксированной комбинации БДП + ФФ не только произведена замена пропеллента на ГФА и изменен раствор активного препарата, но и усовершенствован способ получения самих частиц аэрозоля, ультрамелкодисперсных по размеру, и увеличена инспирабельная фракция, что дает возможность препарату глубже проникать в дыхательные пути и равномерно распределяться по всему бронхиальному дереву (в центральных и периферических бронхах). Таким образом, клинические эффекты терапии могут быть достигнуты при использовании более низких доз ультрамелкодисперсных ИГКС/ДДБА, что ассоциируется с более низким риском развития нежелательных явлений.


