Население Земли медленно, но неуклонно стареет. Особенно заметен этот процесс в странах Европы и Северной Америки. В связи с такой демографической ситуацией меняется и структура заболеваний, с которыми все чаще приходится сталкиваться прежде всего врачам общей практики. Актуальность проблемы дивертикулярной болезни (ДБ) толстой кишки связана с высокой распространенностью ДБ именно в старших возрастных группах. Частота и количество дивертикулов увеличиваются с возрастом: они выявляются примерно у 10 % лиц до 40 лет и у 66 % в возрасте 80 лет с приблизительно одинаковой частотой среди мужчин и женщин [1, 2]. У 12–17 % больных дивертикулезом толстой кишки развиваются осложнения, самое частое из которых – дивертикулит. Среди больных, перенесших атаку острого дивертикулита, от 10 до 30 % подвергаются экстренному хирургическому вмешательству [3, 4]. Осложнения ДБ ободочной кишки как причина перитонита в настоящее время занимают 4-е место после острого аппендицита, прободной язвы желудка и кишечной непроходимости и как причина наложения кишечных стом – 3-е место, при этом часто диагноз ДБ толстой кишки впервые устанавливается после развития тяжелых осложнений [5]. Ситуация усугубляется тем, что частота развития осложнений ДБ толстой кишки с возрастом увеличивается: 238 на 100 тыс. пациентов в возрасте 65–69 лет; 631 на 100 тыс. пациентов старше 85 лет [3]. Однако правильное и своевременное лечение пациентов с первичной «атакой» острого дивертикулита позволяет снижать процент рецидивов до 13 %, необходимость колэктомии до 7 % [6].
Неосложненная симптоматическая ДБ у 20–35 % больных пожилого и старческого возраста протекает с выраженным болевым синдромом, метеоризмом и/или нарушением стула, что приводит к снижению качества жизни и помимо диетических рекомендаций требует назначения лекарственных препаратов различных фармакологических групп. Особенность терапии больных пожилого и старческого возраста состоит в необходимости у одного больного одновременно лечить 2–3 и более нозологий [7], учитывая синергизм и антагонизм одновременно принимаемых лекарственных препаратов, а также их побочное действие. Эффективность стандартной терапии спазмолитиками и средствами, нормализующими двигательную активность кишки, для этой категории больных не во всех случаях высока, что заставляет многих исследователей сделать следующее заключение: больные ДБ толстой кишки представляют неоднородную группу, а ДБ толстой кишки – это полиэтиологическое заболевание, требующее дифференцированного подхода к коррекции как системных причин, так и клинических проявлений и осложнений [8]. Выбор диеты и вида лечения (консервативное, оперативное) зависит от формы ДБ.
Бессимптомный дивертикулез
При выявлении дивертикулов в толстой кишке у пациентов, не предъявляющих жалобы на боли и/или дискинезию кишки, назначения фармацевтических препаратов не требуется. Больной должен быть информирован о наличии у него дивертикулов, ему должны быть разъяснены суть заболевания, возможность развития осложнений и необходимость профилактических мер, первая из которых – достаточное потребление пищевых волокон. Несмотря на появление в последние годы работ, ставящих под сомнение прямую связь недостаточного потребления пищевых волокон с развитием и прогрессированием дивертикулов в толстой кишке [9–11], рекомендации по потреблению достаточного их количества по-прежнему актуальны. Теория, будто активная терапия диетой с высоким содержанием клетчатки может предупреждать развитие дивертикулеза и его осложнений подтверждается крупным проспективным контролируемым исследованием Health Professionals Follow-up Study, в котором наблюдались 47 678 американцев. При этом наилучший результат имел место у индивидуумов, употреблявших в среднем 32 грамма клетчатки в день [12–15]. Помимо рекомендаций по увеличению в суточном рационе количества жидкости, овощей и фруктов для профилактики прогрессирования ДБ и предотвращения осложнений используют пшеничные отруби (суточная доза – от 12 до 6–8 столовых ложек в зависимости от степени нарушения функции кишечника [16]), морскую капусту, льняное семя, метилцеллюлозу, псиллиум. Физиологическое действие пищевых волокон определяется их способностью связывать воду, набухать и увеличивать объем и массу стула, тем самым ускоряя транзит по кишечнику и снижая внутрипросветное давление в кишке. Однако этим действие нерастворимой клетчатки не ограничивается. Пищевые волокна являются пищевым субстратом для сахаролитических бактерий, ферментируются кишечными микробами с образованием короткоцепочечных жирных кислот, подавляют рост протеолитических бактерий. Они также обладают умеренно выраженным гиполипидемическим эффектом, уменьшают всасывание жиров и холестерина [17, 18], связывают и выводят желчные кислоты, соли тяжелых металлов, канцерогены, радионуклиды. Весьма важным аспектом действия этой группы веществ остается их свойство способствовать снижению веса, поскольку есть данные, что при усвоении 30 г пищевых волокон расходуется столько же ккал, сколько при 20-минутной пробежке, а за счет задержки воды в желудке создается иллюзия насыщения, что способствует подавлению чувства голода и уменьшению объема потребляемой пищи. Этот факт принципиален для больных ДБ толстой кишки, т.к. ожирение является самостоятельным фактором риска формирования дивертикулов, прогрессирования заболевания и его осложненного течения [19–22]. Начинать введение отрубей в рацион нужно постепенно (в течение 1,0–1,5 месяцев) во избежание вздутия живота, абдоминальных болей и дискомфорта.
Для больных бессимптомным дивертикулезом актуальны и рекомендации по увеличению физической активности, но без избыточных нагрузок, т.к. малая физическая активность тоже является фактором риска осложненного течения ДБ толстой кишки [23, 24]. Основной контингент больных ДБ толстой кишки – это пациенты пожилого и старческого возраста с бессимптомным дивертикулезом, избыточной массой тела, гиперлипидемией, остеоартрозом. Среди прочих рекомендаций нужно разъяснять больным необходимость соблюдения гиполипидемической диеты, снижения (по возможности) количества потребляемых безрецептурных нестероидных противовоспалительных средств как фактора риска перфорации дивертикула [25]. Даже у больных с бессимптомным дивертикулезом может быть выявлен низкий уровень микроскопического воспаления слизистой оболочки толстой кишки, ассоциированного с дивертикулами [26], поэтому пациентам с бессимптомным дивертикулезом можно рекомендовать препараты масляной кислоты, обладающей противовоспалительным и антиатрофическим действиями с восстановлением барьерных функций слизистой оболочки [27]. Масляная кислота при употреблении внутрь быстро разлагается и всасывается. Проблема доставки неизмененного действующего препарата в заинтересованную область (толстую кишку, особенно в ее дистальные отделы) решена с помощью полимерной мультиматриксной системы в препарате Закофальк с рН-зависимым высвобождением микрогранул. На сегодняшний день на нашем рынке это единственный препарат таргетированной доставки масляной кислоты в толстую кишку. В состав Закофалька входит инулин – растительный полисахарид, который увеличивает всасывание кальция и магния, способствует нормализации липидного и углеводного обменов, снижает концентрацию холестерина и глюкозы в крови. Инулин положительно влияет на кишечную флору, являясь пребиотиком и стимулируя рост бифидобактерий. Закофальк применяется взрослыми от 1–2 до 3–4 таблеток в день за 20–30 минут до еды не разжевывая. Длительность приема препа-рата – не менее 30 дней.
Симптоматическая неосложненная ДБ
К этой группе относятся пациенты с различными клиническими симптомами и синдромами, ассоциированными с наличием у них дивертикулов, но без эндоскопических признаков воспаления слизистой оболочки толстой кишки. Наиболее частыми жалобами этих больных являются различной степени выраженности болевой абдоминальный синдром и нарушения стула. Боли в животе могут носить различный характер: боли, подобные таковым при синдроме раздраженного кишечника (локализация преимущественно в левой подвздошной области, усиление болевого синдрома перед позывом на дефекацию, облегчение после опорожнения кишечника, отсутствие болевого синдрома ночью) или ишемический синдром (возникновение болей через 1–2 часа после приема пищи, отсутствие четкой связи с опорожнением кишки, возможно возникновение болевого синдрома в ночные часы) [28]. Во втором случае прием спазмолитиков без соблюдения режима питания (частого, малыми порциями) может быть неэффективным. Из группы спазмолитиков для достижения быстрого терапевтического эффекта при интенсивном болевом синдроме коротким курсом можно использовать М-холиноблокаторы (атропин, платифиллин, метацин) или неселективные миоспазмолитики (ингибиторы фосфодиэстеразы: дротаверин, папаверин, альверин).
Атропина сульфат вводится п/к, в/м и в/в – по 0,25–1,00 мг (0,25–1,00 мл раствора). Миоспазмолитический эффект достигается очень быстро, однако из-за множества побочных действий (сухость во рту, расширение зрачка, парез аккомодации, тахикардия, затруднение мочеиспускания, атония кишечника, головокружение, головная боль) и широко распространенных противопоказаний (глаукома, обструктивные заболевания кишечника и мочевыводящих путей, паралитический илеус) его применение ограничено, а длительность лечения составляет в среднем 2–3 дня. Платифиллина гидротартрат по сравнению с атропином оказывает менее выраженное влияние на периферические М-холинорецепторы (по действию на гладкомышечные клетки органов желудочно-кишечного тракта и циркулярной мышцы радужки в 5–10 раз слабее атропина), после приема внутрь хорошо абсорбируется. Применяется п/к по 2–4 мг 3 раза в день или внутрь по 1 таблетке (5 мг) 3–4 раза в день. Рекомендуемая длительность приема – не более 4–6 дней. Для более длительного приема (до 10–14 дней) рекомендуется прием неселективных миоспазмолитиков, эффект которых обусловлен ингибированием фосфодиэстеразы, накоплением в клетке циклического 3,5-АМФ и понижением уровня кальция. Папаверина гидрохлорид вводится в/м по 2 мл в виде 2 %-ного раствора 2–3 раза в день или внутрь по 40 мг (1 таблетка) 3–4 раза в день. При применении пожилыми больными следует учитывать такие побочные действия препарата, как AV-блокада, глаукома, желудочковая экстрасистолия, гипотензия, запор, сонливость, повышение в крови уровня трансаминаз, эозинофилия. Дротаверин противопоказан при закрытоугольной глаукоме, гиперплазии предстательной железы. Его с осторожностью применяют при лечении пациентов с артериальной гипотензией и выраженным атеросклерозом коронарных сосудов. Для взрослых пациентов обычная средняя доза дротаверина составляет 1–2 (40–80 мг) таблетки 2–3 раза в сутки. Альверин не обладает М-холиноблокирующей активностью, и поэтому, при необходимости, его можно применять пациентам с глаукомой и доброкачественной гиперплазией предстательной железы. Для пожилых больных с повышенным газообразованием наиболее эффективен комбинированный препарат Метеоспазмил, в состав которого помимо 60 мг альверина цитрата входит пеногаситель симетикон в дозе 300 мг. Применяется Метеоспазмил по 1 капсуле 2–3 раза в день перед едой. При необходимости длительного (более двух недель) приема с целью купирования болевого синдрома используют селективные миотропные спазмолитики (мебеверин, пинаверия бромид), не обладающие системными антихолинергическими эффектами, не оказывающими влияния на сердечно-сосудистую систему и двигательную функцию кишки. Спазмолитический эффект пинаверия бромида осуществляется за счет ингибирования поступления кальция в клетки гладкой мускулатуры кишечника. Препарат следует принимать во время еды, запивая большим количеством воды, не рассасывая и не разжевывая, по 50 мг 3–4 раза в день. Для купирования абдоминального болевого синдрома используют и препарат мебеверин, обладающий, как показали экспериментальные исследования, двумя эффектами. Первый из них сводится к блокаде быстрых натриевых каналов клеточной мембраны миоцита, что нарушает процессы поступление натрия в клетку, замедляет процессы деполяризации и прекращает вход кальция в клетку через медленные каналы. В результате снижаются процессы фосфорилирования миозина и снимается спазм мышечного волокна (антиспастический эффект). Второй эффект обусловлен снижением пополнения внутриклеточных кальциевых депо, что приводит лишь к кратковременному выходу ионов калия из клетки и ее гиперполяризации. Последняя предупреждает развитие гипотонии мышечной стенки. Этот эффект мебеверина выгодно отличает его от действия других миотропных спазмолитиков, вызывающих длительную гипотонию [29]. Применяется в виде капсул по 200 мг 2 раза за 20 минут до еды (суточная доза – 400 мг).
Тримебутин, действуя на энкефалинергическую систему кишечника, служит регулятором его перистальтики. Известно, что эндогенные опиоидные пептиды и серотонин играют двоякую роль в сократительной активности миоцитов желудочно-кишечного тракта. При стимуляции m- и d-опиоидных рецепторов, а также 5-НТ4-(серотониновых)-рецепторов миоцитов происходит усиление, а при стимуляции k-опиоидных и 5-НТ3-(серотониновых)-рецепторов – замедление моторики пищеварительного тракта. Обладая сродством к рецепторам возбуждения и подавления, тримебутин оказывает стимулирующее действие при гипокинетических состояниях гладкой мускулатуры кишечника и спазмолитическое – при гиперкинетических. Препарат назначают внутрь по 100–200 мг 3 раза в день. При необходимости длительность приема тримебутина может составлять до 12 недель. Прием спазмолитиков, даже длительный, может быть неэффективным для ряда больных без нормализации стула. У большинства больных (около 35–40 %) с симптоматической ДБ толстой кишки нарушение стула проявляется в виде запора. Еще около 15–20 % больных жалуются на чувство неполного опорожнения кишки и вздутие живота. Приблизительно у 7–10 % больных наблюдается чередование запора и поноса.
Группа слабительных неоднородна, они классифицируются по механизму их действия:
- увеличивающие объем кишечного содержимого (отруби, псиллиум, метилцеллюлоза, семя льна);
- размягчающие каловые массы (вазелиновое масло);
- осмотические (магния сульфат, глицерол, макроголь);
- слабоабсорбируемые ди- и полисахариды (лактулоза);
- стимулирующие (раздражающие): бисакодил, касторовое масло, антрахиноны (сенна, крушина), желчные кислоты.
При выборе слабительных средств нужно четко определить предполагаемые сроки лечения, поскольку прием пожилыми больными ДБ и запорами стимулирующих (раздражающих), осмотических и размягчающих средств возможен лишь эпизодически и эти группы препаратов не могут быть рекомендованы в качестве основной терапии длительного приема. В лечении пожилых больных необходимо учитывать принцип многоцелевой монотерапии, когда используется одно лекарство с несколькими точками приложения [30], что особенно важно при долгосрочном приеме препарата. Примерами таких препаратов могут служить лактулоза и псиллиум. Лактулоза характеризуется низкой абсорбцией; не всасываясь доходит до толстого кишечника, где расщепляется кишечной флорой на низкомолекулярные органические кислоты, которые приводят к снижению pH и за счет повышения осмотического давления – к увеличению объема кишечного содержимого, смягчению консистенции стула. Указанные эффекты стимулируют перистальтику кишечника, при этом лактулоза оказывает и пребиотическое действие посредством увеличения количества ацидофильных бактерий (лактобактерий) и ингибирования роста сальмонелл в кишечнике. Применяется в дозе 15–45 мл/день. Необходимо помнить, что из-за механизма действия лактулозы, заключающегося в снижении pH в толстой кишке, лекарственные средства, высвобождение которых зависит от pH кишки (такие как препараты 5-аминосалициловой кислоты [5-АСК]) могут быть инактивированы. Препарат псиллиум представляет собой водорастворимое, неперевариваемое пищевое волокно из оболочки высушенных семян подорожника овального Plantago ovata Forssk, поэтому может быть включен в схему лечения больных ДБ уже на этапе диетических рекомендаций. Гидрофильные волокна удерживают жидкость в просвете кишки, увеличивая объем и размягчая консистенцию стула. Кроме того, псиллиум обладает прямым стимулирующим действием на моторику кишечника через воздействие на мускариновые и 5-HT4-рецепторы (прокинетическое действие), что вносит дополнительный вклад в слабительное действие псиллиума. Несмотря на то что формально псиллиум относится к группе слабительных, его можно успешно использовать при неустойчивом стуле или диарее, принимая в виде сухого порошка. Абсорбция жидкости в просвете кишки приводит к формированию гелеобразной субстанции, а торможение моторной активности при диарее частично реализуется и через блокаду кальциевых каналов, и активацию NO-циклической гуанозинмонофосфатазы. Таким образом, псиллиум оказывает нормокинетическое действие [31]. Клетчатка, входящая в состав псиллиума, замедляет усвоение углеводов и жиров, что приводит к снижению секреции инсулина и вследствие этого не происходит набора лишнего веса, а также на сегодняшний день псиллиум обладает доказанным гиполипидемическим действием, что делает этот препарат приоритетным в лечении пожилых больных запорами и гиперлипидемией [17, 18]. Некоторые исследователи связывают формирование болевого абдоминального синдрома у больных ДБ толстой кишки с наличием у них дисбиоза [32]. Подходить к назначению кишечных антисептиков необходимо индивидуально, показанием к этому служат наличие стойкого болевого синдрома и клинические признаки дисбиоза (диарея, диспепсия, запоры, метеоризм, тошнота, отрыжка, рвота, аллергические кожные реакции). В случае симптоматической неосложненной ДБ предпочтение нужно отдавать противомикробным средствам с широким спектром действия, не всасывающимся из желудочно-кишечного тракта и не имеющим системных побочных эффектов, таким как рифаксимин или нифуроксазид. Нифуроксазид практически не абсорбируется из желудочно-кишечного тракта, 99 % принятой дозы остаются в кишечнике и оказывают там свое антимикробное действие. Нифуроксазид выводится кишечником, 20 % в неизмененном виде. Взрослым рекомендуют прием по 4 капс./сут (800 мг), разделенные на 2–4 приема. Длительность лечения не должна превышать 7–10 дней. Рифаксимин относится к антибиотикам широкого спектра с бактерицидным действием, являясь полусинтетическим производным рифамицина. Препарат ингибирует ДНК-зависимую РНК полимеразу бактериальных клеток, подавляет образование бактериями аммиака и других токсических соединений. В дивертикулах ободочной кишки снижает число бактерий, которые могут участвовать в воспалении вокруг дивертикулярного мешка и, возможно, играют ключевую роль в развитии симптомов и осложнений ДБ. Практически не всасывается при приеме внутрь (99,5 % рифаксимина, поступившего внутрь, находятся в просвете кишки, где достигаются высокие концентрации препарата). Выводится с фекалиями в неизмененном виде, в моче обнаруживается не более 0,5 % принятой дозы, что может вызывать окрашивание мочи в красноватый цвет. Взрослым рекомендуется прием внутрь по 600 мг каждые 8 часов или 1200 мг каждые 8–12 часов. Продолжительность лечения не должна превышать 7 дней. Препарат может быть использован в качестве противорецидивного лечения дивертикулита.
По современным представлениям о коррекции нарушений микробиоценоза кишечника после проведения селективной деконтаминации антибиотиками или кишечными антисептиками предполагаются следующие этапы: «стимуляция» штаммов нормальной микрофлоры (назначение пребиотиков) и заместительная терапия (пробиотики). Пробиотики – препараты или продукты питания, содержащие живые штаммы нормальной кишечной микрофлоры. Препараты, содержащие лакто- и бифидобактерии Lactobacillus bulgaricus, L. acidophilus, Bifidobacterium ssp., Streptococcus thermophilus, нормализуют состав микробиоты кишечника, способствуют угнетению роста патогенных и условно-патогенных видов микроорганизмов и увеличению колонизационной резистентности, оказывают иммуностимулирующее действие за счет повышения выработки иммуноглобулина А и активации фагоцитарной функции лейкоцитов [33]. Лактобактерии разлагают углеводы с образованием молочной кислоты. Создаваемая ими кислая среда способствует росту бифидобактерий, составляющих 85–95 % кишечной микрофлоры человеческого организма. Культуры L. bulgaricus и Streptococcus thermophilus проявляют симбиоз, компенсируя метаболизм друг друга и стимулируя взаимный рост, активизируют пристеночное пищеварение, участвуют в ферментативном расщеплении белков, жиров, углеводов, в процессах метаболизма желчных кислот и холестерина (проявляют гипохолестеринемическое действие) [34]. Бифидумбактерин форте порошок для приема внутрь представляет собой микробную массу живых бактерий антагонистически активного штамма Bifidobacterium bifidum № 1.
Сорбированные бифидобактерии активизируют восстановительные процессы в слизистых оболочках, пристеночное пищеварение, синтез витаминов и аминокислот, усиливают иммунную защиту организма. Препарат принимают независимо от приема пищи по 2 пакета 2–3 раза в сутки. Курс лечения определяется характером и тяжестью заболевания и составляет в среднем 15–21 день. При необходимости курсы лечения можно повторить 2–3 раза, каждый курс проводится через месяц после окончания предыдущего курса лечения. При одновременном приеме с антибиотиками возможно снижение терапевтической эффективности препарата. Пробиотик Бифиформ представлен кишечнорастворимыми капсулами, каждая из которых содержит Enterococcus faecium 1 × 107 КОЕ Bifidobacterium longum 1 × 107 КОЕ. Для нормализации микрофлоры кишечника и поддержки иммунной системы препарат назначают в дозе 2–3 капсулы в сутки 10–21 день. Одна капсула препарата Линекс содержит не менее 1,2 × 107 живых лиофилизированных молочнокислых бактерий: L. acidophilus, B. infantis, Enterococcus faecium. Принимается внутрь после еды с небольшим количеством жидкости по 2 капсуле 3 раза в день. Длительность лечения зависит от причины развития дисбактериоза и индивидуальных особенностей организма, составляет от 5–7 до 15–21 дня. Пробиотические дрожжи Saccharomyces boulardii, входящие в состав Энтерола, обладают естественной устойчивостью ко всем антибиотикам, поэтому данный препарат можно принимать со дня приема антибиотика и до окончания курса лечения. Взрослые принимают 1–2 капсулы 2 раза в день в течение 7–10 дней.
Острый дивертикулит. Обострение хронического дивертикулита
Острый дивертикулит, как и обострение хронического дивертикулита, характеризуется интенсивным болевым синдромом, чаще всего локализованным в левой половине живота или левой подвздошной области. Стойкий абдоминальный болевой синдром сопровождается болезненностью живота при пальпации, расстройством стула (смена запоров диареей) и признаками воспаления (лихорадка и лейкоцитоз), что помогает в дифференциальной диагностике дивертикулита и синдрома раздраженной кишки.
У пациентов, получающих иммуносупрессивную терапию, а также у пожилых пациентов клинические симптомы заболевания часто могут быть стертыми. При прогрессировании дивертикулита и микроперфорации может формироваться внутрибрюшной абсцесс. Правильное и своевременное лечение дивертикулита позволяет предотвращать осложнения и снижать частоту рецидивов в будущем.
В остром периоде больным назначается бесшлаковая диета. Для обеспечения функционального «покоя» кишки на первые 1–3 дня рекомендуют лечебное голодание. При первых симптомах заболевания назначают антибиотики широкого спектра действия (фторхинолоны, цефалоспорины 2-го или 3-го поколения), инфузионную дезинтоксикационую терапию, адекватное обезболивание. Для 70 % больных консервативная терапия острого дивертикулита оказывается успешной [35]. В случае сохранения на протяжении 6–12 месяцев болевого синдрома и расстройства функций кишечника без лихорадки и лейкоцитоза предложено использовать термин «тлеющий дивертикулит». К осложненным формам ДБ относят кишечный абсцесс, частичную и полную кишечную непроходимость, перфорацию, перитонит, кровотечение. В этом случае больному обеспечиваются функциональный «покой» кишки и наблюдение в хирургическом стационаре с выбором тактики оперативного вмешательства в зависимости от формы и тяжести заболевания.
Противорецидивное лечение дивертикулита
Окончательно вопрос об эффективном противорецидивном лечении дивертикулита не решен. Доказательств эффективности применения антибиотиков в легких и среднетяжелых случаях дивертикулита как меры профилактики его рецидива на сегодняшний день недостаточно [36]. В настоящее время предпочтение отдается препаратам 5-АСК, в частности месалазину. Его противовоспалительный эффект объясняют не только ингибированием липооксигеназного пути метаболизма арахидоновой кислоты с последующим торможением синтеза и освобождения провоспалительных простагландинов и лейкотриенов, но и восстановлением барьерной функции кишечника за счет активации γ-рецепторов, активированных пролифератором пероксисомы (PPAR-γ), играющих ключевую роль в поддержании целостности слизистой оболочки кишечника. В дополнение месалазин обладает антимикробными свойствами в отношении различных бактериальных штаммов (он ингибирует бактериальный рост, подавляя активность генов, ответственных за метаболизм, рост и ответ кишечных бактерий). Проводились различные исследования, в которых эффективность месалазина сравнивалась с плацебо, препаратами лактобактерий, с рифаксимином. Три исследования были проведены на пациентах с неосложненным дивертикулитом и три исследования выполнены на пациентах с симптоматической ДБ. Терапия месалазином приводит к лучшим результатам лечения (снижение числа рецидивов в следующие 24 месяца наблюдения), чем терапия в контрольных группах с дивертикулезом [37, 38, 39].
В мета-анализе 2010 г. 6 рандомизированных контролируемых исследований, проведенных суммарно на 818 пациентах, сравнивалась эффективность различных схем приема месалазина в лечении пациентов с ДБ. Авторы пришли к следующему заключению: назначение месалазина по постоянной схеме (ежедневный прием в течение 2 месяцев) в отличие от циклического приема (первые 7 дней каждого месяца в течение года) оказывало более выраженное противорецидивное действие [40]. Частые рецидивы острого дивертикулита (более 3 раз в течение 2 лет) являются показанием к плановому хирургическому вмешательству, которое рекомендуется проводить спустя 6 недель после стихания признаков острого дивертикулита.
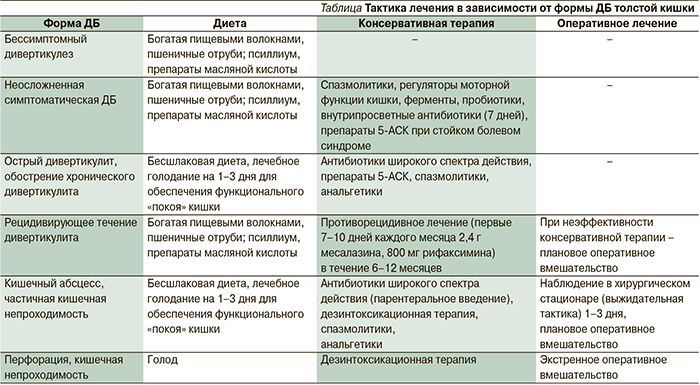
В заключение в таблице приведены суммарные данные вышеизложенного материала.


