Введение
Артериальная гипертeнзия (АГ) – хроническое заболевание, основным клиническим признаком которого является длительное и стойкое повышение артериального давления (АД) выше 140/90 мм рт. ст., представляет собой актуальную социально-медицинской проблему не только в России, но и во всем мире. По данным эпидемиологического исследования, проведенного в РФ, среди взрослых повышенные показатели АД регистрировались у 42,5 млн человек (среди женщин – в 41,1 % случаев, среди мужчин – в 39,2 %). АГ – основной независимый модифицируемый фактор риска сердечно-сосудистых осложнений (ССО; острый коронарный синдром, инфаркт миокарда, мозговой инсульт), определяющий структуру инвалидизации и летальности при сердечнососудистых заболеваниях (ССЗ).
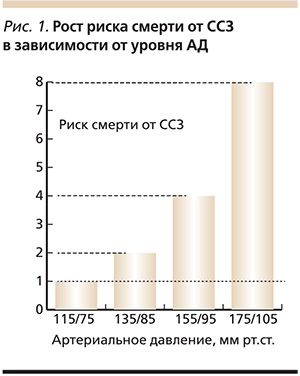
По данным проспективных исследований, проведенных в ГНИЦ профилактической медицины, риск смерти от ССЗ для лиц в возрасте 40–70 лет удваивается с увеличением АД на каждые 20/10 мм рт. ст., начиная с уровня систолического АД (САД) ≤ 115 мм рт. ст. (рис. 1). Мужчины и женщины, имеющие САД ≥ 180 мм рт. ст., живут на 10 лет меньше по сравнению с пациентами с САД ≤ 120 мм рт. ст. [2, 16]. В то же время мета-анализ 61 обсервационного исследования (1 млн пациентов, 12,7 млн пациенто-лет) показал, что снижение САД всего лишь на 2 см рт. ст. способствует уменьшению риска смерти от инфаркта миокарда на 7 %, а от мозгового инсульта – на 10 %; снижение САД – на 20, а диастолического АД (ДАД) – на 10 мм рт. ст. обеспечивает уменьшение сердечно-сосудистой смертности в 2 раза [22].
Достижение целевого уровня АД (< 140/90 мм рт. ст.) пациентами с АГ регистрируется только в 21,5 % наблюдений, несмотря на увеличение доли охваченности лечением пациентов до 50 % и осведомленности о наличии заболевания до 70 %. Результаты недавно опубликованного крупномасштабного эпидемиологического исследования (BP-CARE), проведенного в центрально- и восточно-европейских странах, показали, что контроль за целевым уровнем АД по-прежнему недостаточен даже для больных, получающих антигипертензивную терапию (АГТ) [4]. Подсчитано, что при эффективном лечении АГ теоретически можно было бы сохранить примерно треть жизней мужчин и женщин.
Современные принципы АГТ
 Согласно рекомендациям Всероссийского научного общества кардиологов (ВНОК) по диагностике и лечению АГ четвертого пересмотра, при лечении пациентов с АГ целевой уровень АД должен быть ниже 140/90 мм рт. ст. Пациентам с высоким и очень высоким риском ССО (табл. 1) необходимо снижать АД до более низких значений в течение 4 недель (до 130–139/80–89 мм рт. ст.). При плохой переносимости снижения АД его рекомендуется проводить в несколько этапов: на каждой ступени (2–4 недели) АД следует уменьшать на 10–15 % от исходного уровня с последующим перерывом для адаптации пациента к более низким его показателям [1, 2, 10, 11].
Согласно рекомендациям Всероссийского научного общества кардиологов (ВНОК) по диагностике и лечению АГ четвертого пересмотра, при лечении пациентов с АГ целевой уровень АД должен быть ниже 140/90 мм рт. ст. Пациентам с высоким и очень высоким риском ССО (табл. 1) необходимо снижать АД до более низких значений в течение 4 недель (до 130–139/80–89 мм рт. ст.). При плохой переносимости снижения АД его рекомендуется проводить в несколько этапов: на каждой ступени (2–4 недели) АД следует уменьшать на 10–15 % от исходного уровня с последующим перерывом для адаптации пациента к более низким его показателям [1, 2, 10, 11].
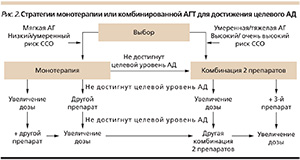
В новых рекомендациях Российского медицинского общества по артериальной гипертонии (РМОАГ) и ВНОК назначение комбинации двух антигипертензивных препаратов (АГП) рассматривается как альтернатива монотерапии уже в начале лечения, а медикаментозное лечение пациентов высокого и очень высокого риска развития ССО при любой степени подъема АД следует начинать с комбинированной терапии, желательно – с фиксированных комбинаций АГП (рис. 2).
Современный алгоритм АГТ оставляет возможность лечения одним препаратом только больных АГ 1-й ст. (160/100 мм рт. ст.) из группы низкого и умеренного риска. При неэффективности монотерапии авторы предлагают либо замену на АГП другой группы, либо назначение комбинированной терапии [10]. Стратегия последовательной замены АГП в рамках монотерапии, которая зачастую используется врачами первичного звена, имеет ряд недостатков. Как известно, представители всех классов АГП в эквивалентных дозировках обладают примерно равной эффективностью [10], поэтому повторные попытки лечения АГ только одним препаратом зачастую обречены на неудачу, а следовательно, снижают уверенность пациента в успешности лечения. Более того, в мета-анализе более 40 исследований показано, что комбинация двух препаратов любых двух классов АГП чаще приводит к нормализации АД, нежели увеличение дозы одного препарата до максимальной [2]. Таким образом, вопрос заключается не в том, нужна ли комбинированная АГТ, а в том, в каких случаях можно начинать с монотерапии, прежде чем назначать комбинированное лечение [10, 11].
Комбинированная АГТ имеет следующие преимущества перед монотерапией:
- увеличение антигипертензивного эффекта за счет разнонаправленного воздействия препаратов на различные патогенетические механизмы, формирующие высокий уровень АД;
- увеличение числа респондеров (больных, у которых отмечается достижение целевого уровня АД);
- уменьшение частоты побочных эффектов терапии за счет как применения меньших доз АГП, входящих в состав комбинации, так и их взаимной нейтрализации в ряде случаев;
- обеспечение более выраженного органопротективного эффекта, уменьшение риска и числа ССО [2, 3, 6, 10, 12, 13].
В соответствии с рекомендациями РМОАГ комбинации лекарственных АГП подразделяют на рациональные (эффективные), возможные и нерациональные. Комбинация АГП должна отвечать следующим требованиям: взаимодополняющее действие (аддитивность), наличие близких фармакодинамических и фармакокинетических показателей, наличие реверсивного нивелирования отрицательных биологических эффектов.
Все преимущества комбинированной терапии в полной мере реализуются только при применении рациональных комбинаций АГП, к числу которых на сегодняшний день относят ингибитор ангиотензинпревращающего фермента (ИАПФ) + блокатор кальциевых каналов (БКК), блокатор ангиотензиновых рецепторов 1-го типа (БАР) + БКК, ИАПФ + диуретик, БАР + диуретик, БКК + диуретик, β-адреноблокатор (БАБ) + диуретик. Для комбинированной терапии АГ рекомендованы нефиксированные и фиксированные комбинации АГП, причем последние более перспективны [5, 10, 12, 13].
Традиционно используемые комбинации БАБ с дигидропиридиновыми БКК или блокаторами ренин-ангиотензин-альдостероновой системы (РААС) не рассматриваются рекомендациями в качестве рациональных, т. к. отсутствуют данные крупных исследований об их влиянии на прогноз.
В то же время в реальной клинической практике они вполне допустимы.
 Важным аспектом комбинированной АГТ остается нецелесообразность комбинации двух блокаторов РААС в любых сочетаниях. Это относится как к комбинации ИАПФ с БАР, так и к сочетанию любого из них с блокатором ренина алискиреном. Доказательная база этого положения основывается на результатах исследований ONTARGET и ALTITUDE [4, 10, 11, 14]: в первом из них сочетание рамиприла с телмисартаном увеличивало частоту случаев гипотонии и почечной недостаточности, во втором – комбинация алискирена с любым блокатором РААС повышала частоту инсультов и новых случаев почечной недостаточности [10, 11].
Важным аспектом комбинированной АГТ остается нецелесообразность комбинации двух блокаторов РААС в любых сочетаниях. Это относится как к комбинации ИАПФ с БАР, так и к сочетанию любого из них с блокатором ренина алискиреном. Доказательная база этого положения основывается на результатах исследований ONTARGET и ALTITUDE [4, 10, 11, 14]: в первом из них сочетание рамиприла с телмисартаном увеличивало частоту случаев гипотонии и почечной недостаточности, во втором – комбинация алискирена с любым блокатором РААС повышала частоту инсультов и новых случаев почечной недостаточности [10, 11].
Исследования последних лет все чаще посвящены не столько изучению эффективности монотерапии АГ, сколько влиянию комбинаций АГП на прогноз больных. Среди них следует отметить исследование ADVANCE, в котором комбинацию ИАПФ и тиазидного диуретика сравнивали с плацебо (на фоне базовой терапии), и FEVER, в котором комбинацию БКК и диуретика сравнивали с монотерапией диуретиком в сочетании с плацебо [10, 11]. Наибольший интерес представляет исследование ACCOMPLISH, т. к. в нем впервые сравнивали две фиксированные комбинации ИАПФ (беназеприл) с БКК (амлодипин) или диуретиком (гидрохлоротиазид) в отношении влияния на частоту ССО и смертность. Работа была прекращена досрочно, поскольку в группе, получавшей комбинацию ИАПФ + БКК, отмечено 20 %-ное снижение сердечно-сосудистого риска при одинаковом снижении АД. Кроме того, комбинация ИАПФ и БКК достоверно уменьшала прогрессирование хронической болезни почек, снижала сердечно-сосудистую и общую смертность среди больных высокого риска [3, 5, 10, 21].
Таким образом, с позиций клинических рекомендаций Европейского общества кардиологов 2013 г. большинству больных АГ для достижения целевого АД необходима комбинированная АГТ [10]. В частности, современная фиксированная комбинация дигидропиридинового БКК (лерканидипин) и ИАПФ (эналаприл) отвечает всем требованиям фармакотерапии АГ: обеспечивает не только адекватное гипотензивное действие, но и максимальную органопротекцию.
Место ИАПФ и БКК в лечении АГ
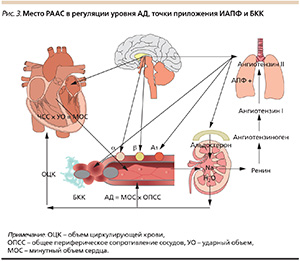
Место РААС в регуляции АД и механизмы действия ИАПФ интенсивно изучаются с середины ХХ столетия и представлены на рис. 3.
В 1965 г. бразильский исследователь Ferreira обнаружил способность яда гремучей змеи Bothrops Jararaca стабилизировать брадикинин. В последующем ряд научно-биологических лабораторий показал, что фермент, стабилизирующий брадикинин, идентичен ИАПФ.
В 1971 г. в лаборатории фирмы «Squibb» был синтезирован первый ИАПФ – тепротид, выделенный непосредственно из яда змеи Bothrops Jararaca, токсичность которого явилась препятствием для его применения в клинической практике. В 1975 г. в той же лаборатории был создан первый пероральный ИАПФ SQ14.225, получивший название каптоприл, а вскоре (1980) был синтезирован другой ИАПФ – эналаприл, который на протяжении нескольких десятилетий остается эффективным средством контроля АД [3].
В настоящее время известно более 20 ИАПФ, которые подразделяются на 4 группы, различающиеся по химической структуре, ответственной за связывание с ионами цинка в активных центрах системного и тканевого АПФ: 1) содержащие сульфгидрильную группу (каптоприл, зофеноприл); 2) содержащие карбоксиалкильную группу – карбоксиалкилдипептиды (эналаприл, лизиноприл, квинаприл, рамиприл, периндоприл, целазаприл, беназаприл); 3) содержащие фосфильную группу (фозиноприл); 4) содержащие гидроксамоновую группу (идраприл).
Среди ИАПФ выделяют активные лекарственные формы (каптоприл, лизиноприл и либензаприл) и пролекарства, которые после всасывания в желудочно-кишечном тракте и пассажа через печень становятся активными (эналаприл → эналаприлат), подвергшись гидролизу до диацидных метаболитов.
По продолжительности антигипертензивного действия ИАПФ принято классифицировать на препараты короткого действия, которые необходимо назначать 2–3 раза в сутки (каптоприл), и препараты пролонгированного действия, обеспечивающие круглосуточный контроль уровня АД при приеме 1–2 раза в день (эналаприл, лизиноприл, фозиноприл, рамиприл, периндоприл и др.). Таким образом, эналаприл – это ИАПФ длительного действия, метаболизирующийся в печени до активной лекарственной фор-мы – энаприлата.
Все ИАПФ обладают кардио-, вазо-, нефропротективными и метаболическими эффектами. Их кардиопротективное действие определяется восстановлением баланса между потребностью и обеспечением миокарда кислородом, снижением пред- и постнагрузки на левый желудочек (ЛЖ), уменьшением объема и массы ЛЖ, замедлением ремоделирования ЛЖ, ослаблением симпатической стимуляции, антиаритмическими эффектами. К вазопротективным эффектам относятся прямое антиатерогенное действие, антипролиферативное и антимиграционное влияние на гладкомышечные клетки сосудистой стенки, восстановление и улучшение эндотелиальной функции, антитромбоцитарный эффект, усиление эндогенного фибринолиза. В число нефропротективных эффектов входят снижение внутриклубочковой гипертензии, увеличение скорости клубочковой фильтрации и натрийуреза, уменьшение калийуреза и протеинурии, увеличение диуреза (снижение объема циркулирующей крови). Метаболические эффекты включают усиление распада липопротеидов очень низкой плотности, снижение синтеза триглицеридов, повышение продукции липопротеидов высокой плотности, увеличение чувствительности клеточных рецепторов к инсулину и усиление потребления глюкозы [8, 14, 27]. Многопрофильность действия ИАПФ позволила назвать их «золотым» стандартом в терапии ССЗ [3, 12, 27].
Антигипертензивное действие ИАПФ основано на их суммарном воздействии непосредственно на сердечно-сосудистую систему и опосредовано улучшением реологических параметров крови (вязкость, агрегационная активность тромбоцитов и эритроцитов).
К числу основных групп АГП также относятся БКК, эффективность которых в лечении АГ была подтверждена данными ряда завершившихся исследований – ASCOT, ACCOMPLISH, ALLHAT [1, 3, 9, 15]. БКК тормозят проникновение ионов Ca2+ из межклеточного пространства в мышечные клетки через медленные кальциевые каналы L-типа, тем самым расширяя артерии и артериолы.
Внутриклеточная кинетика Са2+, механизмы его обмена с внеклеточной средой и функционирование «кальциевых насосов» контролируются тремя клеточными мембранными системами: сарколеммой, саркоплазматическим ретикулумом и митохондриями. Поступление избыточного количества Са2+ или нарушение его выведения из клетки сопровождается нарушением специфических функций клеток сердечно-сосудистой системы (проведение, сокращение), что интегрально приводит к дефекту насосной деятельности сердца или подъему АД.
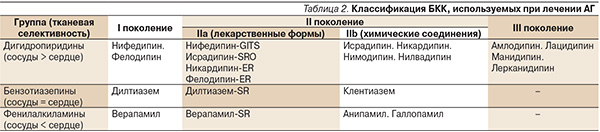
 В клетках имеется 3 типа кальциевых каналов: L-тип – медленные каналы, локализованные в кардиомиоцитах и миоцитах сосудов; Т-тип – быстрые каналы, расположенные в проводящей системе сердца и нейронах; N-тип – обнаруживаемые в окончаниях сенсорных нейронов и блокируемые кадмием [8]. Из числа кальциевых каналов лишь L-каналы ингибируются органическими соединениями – дегидропиридинами, бензотиазепинами и фенилалкиламинами, блокирующими вхождение Са2+ в клетку, получившими название БКК и применяющимися при лечении ишемической болезни сердца, АГ, метаболического синдрома, в профилактике инсультов. В США один из БКК – амлодипин – входит в десятку наиболее часто назначаемых лекарственных препаратов [15]. По химической структуре БКК подразделяются на дигидропиридиновые (ДПБКК) и недигидропиридиновые (НДПБКК). ДПБКК специфично связываются кальциевыми каналами L-типа, которые в основном расположены в гладкомышечных клетках сосудов на уровне артериол. НДПБКК специфично взаимодействуют с каналами этого типа, локализующимися в кардиомицитах, клетках синоатриального и атриовентрикулярного узлов [8]. В 1996 г. T. ToyaOka и W. Nayler, основываясь на фармакокинетических и фармакодинамических свойствах БКК, предложили классифицировать их на три поколения (табл. 2) [29].
В клетках имеется 3 типа кальциевых каналов: L-тип – медленные каналы, локализованные в кардиомиоцитах и миоцитах сосудов; Т-тип – быстрые каналы, расположенные в проводящей системе сердца и нейронах; N-тип – обнаруживаемые в окончаниях сенсорных нейронов и блокируемые кадмием [8]. Из числа кальциевых каналов лишь L-каналы ингибируются органическими соединениями – дегидропиридинами, бензотиазепинами и фенилалкиламинами, блокирующими вхождение Са2+ в клетку, получившими название БКК и применяющимися при лечении ишемической болезни сердца, АГ, метаболического синдрома, в профилактике инсультов. В США один из БКК – амлодипин – входит в десятку наиболее часто назначаемых лекарственных препаратов [15]. По химической структуре БКК подразделяются на дигидропиридиновые (ДПБКК) и недигидропиридиновые (НДПБКК). ДПБКК специфично связываются кальциевыми каналами L-типа, которые в основном расположены в гладкомышечных клетках сосудов на уровне артериол. НДПБКК специфично взаимодействуют с каналами этого типа, локализующимися в кардиомицитах, клетках синоатриального и атриовентрикулярного узлов [8]. В 1996 г. T. ToyaOka и W. Nayler, основываясь на фармакокинетических и фармакодинамических свойствах БКК, предложили классифицировать их на три поколения (табл. 2) [29].
БКК I поколения имеют короткий период действия, характеризуются отрицательным инотропным влиянием на миокард, замедляют атриовентрикулярную проводимость, не имеют или имеют недостаточную тканевую специфичность к сосудистому руслу, что снижает их терапевтическую ценность при лечении АГ.
БКК II поколения отличаются от препаратов I поколения улучшенными фармакокинетическими свойствами и более высокой вазоселективностью, подразделяются на два подкласса – IIа и IIb. Ретардные формы БКК IIа подкласса реже вызывают побочные эффекты, связанные с вазодилатацией, поэтому лучше переносятся пациентами. Препараты IIb-подкласса характеризуются продолжительным действием и более высокой вазоселективностью [20].
БКК III поколения характеризуются более высокой специфичностью к кальциевым каналам и выраженной тканевой селективностью, обладая следующими важными для клинической практики фармакологическими особенностями:
- предсказуемость эффективности за счет высокой биодоступности (60–80 %) и незначительных колебаний суточной концентрации в плазме крови;
- высокая вазотканевая селективность, что исключает влияние на сократимость миокарда, функцию синусового узла и атриовентрикулярную проводимость;
- длительность биологического действия (24–36 часов), что исключает необходимость создания ретардных форм.
Лерканидипин существенно отличается от амлодипина выраженной липофильностью и вазо/кардиальной селективностью: коэффициент вазоселективности лерканидипина составляет 730/1, лацидипина – 193/1, амлодипина – 95/1. В отличие от амлодипина и лацидипина лерканидипин оказывает одновременный вазодилатационный эффект на афферентные и эфферентные артериолы почечного клубочка, способствует снижению внутриклубочкового давления, что является основой его выраженного нефропротективного действия [1, 2, 6, 9, 14, 30]. Установлено, что лерканидипин – наиболее эффективный и безопасный АГП при лечении АГ или ишемической болезни сердца у пациентов с систолической дисфункцией ЛЖ. Благодаря высокой вазоселективности препарат оказывает минимальное кардиодепрессивное и тахитропное действия.
Клинические эффекты фиксированной комбинации эналаприла и лерканидипина (Корипрен®)
Механизмы антигипертензивного действия ИАПФ и БКК различаются, что и определяет потенциирующее действие представителей данных классов АГП при их совместном применении больными АГ [11, 13]. Вазодилатирующее действие БКК реализуется за счет блокады входа ионов кальция в клетку, а эффект ИАПФ опосредуется через РААС. Данная комбинация эффективна среди самого широкого круга пациентов как с высоко-, так и с низкорениновыми формами АГ [11, 30]. Совместное применение ИАПФ и БКК позволяет «нейтрализовать» контррегуляторные механизмы, снижающие эффективность каждого препарата в отдельности. В частности, ИАПФ подавляют активность РААС и симпато-адреналовой системы, активация которых снижает эффекты БКК [14, 30].
До недавнего времени на российском фармацевтическом рынке имелось лишь две фиксированные комбинации ИАПФ с дигидропиридиновым БКК: лизиноприл + амлодипин (Экватор) и периндоприл + амлодипин (Престанс). Теперь практикующие врачи располагают возможностью еще одной, фиксированной комбинации ИАПФ эналаприла с дигидропиридиновым БКК лерканидипином (Корипрен®, Recordati).
Комбинированное назначение препаратов этих классов позволяет уменьшать число побочных эффектов терапии. Например, отеки нижних конечностей, являющиеся побочным эффектом дигидропиридиновых БКК, при их совместном применении с ИАПФ исчезают либо их выраженность значительно уменьшается [11, 14, 17]. С другой стороны, комбинация с БКК позволяет уменьшать частоту возникновения сухого кашля — наиболее частого побочного эффекта ИАПФ [14, 19, 22].
Cвоеобразной «визитной карточкой» данной комбинации является мощное органопротективное действие, особенно ренопротективное, обусловленное эффектами как ИАПФ, так и БКК. Совместное применение препаратов этих классов приводит к уменьшению клубочкового давления и экскреции альбумина, поэтому такая комбинация может быть рекомендована пациентам с микроальбуминурией, диабетической и недиабетической нефропатией [11, 19]. Следует отметить, что ИАПФ и БКК относятся к «метаболически нейтральным» АГП, что делает их комбинацию особенно привлекательной при лечении пациентов с метаболическим синдром [7, 15, 18].
В исследовании DIAL (Diabete, hIpertensione, Albuminuria, Lercani-dipin) [11,23] при сравнении влияния лерканидипина и рамиприла на уровень экскреции альбумина у пациентов с сахарным диабетом и АГ было установлено, что оба препарата помимо хорошего антигипертензивного эффекта значительно уменьшают альбуминурию. В исследовании TOMHS (Treatment Оf Mild Hypertension Study) больные АГ в течение 4 лет получали терапию одним из 5 АГП из разных групп [16]. Уже через год при сопоставимом антигипертензивном эффекте обнаружились существенные различия в нефропротективном действии в пользу ИАПФ эналаприла [16]. Поэтому комбинация лерканидипина c эналаприлом представляется высокоэффективной и перспективной в плане нефропротекции.
Сочетание ИАПФ с БКК предлагается как комбинация первого выбора для лечения больных АГ с гипертрофией ЛЖ [1, 11, 26]. Лерканидипин обладает выраженным кардиопротективным действием: лечение этим препаратом в суточной дозе 10–20 мг вызывает уменьшение гипертрофии ЛЖ уже в течение первого года терапии [11, 26]. В свою очередь в исследовании PRESERVE (Prospective Randomized Enalapril Study Evaluating Regression of Ventricular Enlargement) [19] прием эналаприла по 20 мг один раз в сутки обеспечил больным АГ с гипертрофией ЛЖ статистически значимое снижение АД и уменьшение гипертрофии с нормализацией индекса массы миокарда ЛЖ в 56 % случаев [11, 19]. Следовательно, комбинация лерканидипина и эналаприла будет усиливать кардиопротективные эффекты обоих компонентов.
Высокая антигипертензивная эффективность фиксированной комбинации эналаприла и 10 мг лерканидипина была продемонстрирована в ряде рандомизированных клинических исследований [22–26]. Особый интерес представляют данные об эффективности этой комбинации для 8440 больных в условиях реальной клинической практики (40 % пациентов получали 20/10 мг, 60 % – 10/10 мг соот-ветственно эналаприла и лерканидипина). Анализ результатов продемонстрировал снижение АД в среднем на 28,4/13,5 мм рт. ст. от исходного (162,5/94,5 мм рт. ст.) и достижение целевых уровней АД почти в 80 % случаев [25].
Еще в одном проспективном открытом многоцентровом исследовании, также в условиях реальной клинической практики, эффективность и безопасность фиксированной комбинации эналаприла и лерканидипина 20/10 мг для 622 пациентов с АГ (средний возраст – 61,3 ± 13,3 года, 54,2 % мужчин) оценивали по данным не только рутинного измерения АД, но и его самоизмерения и суточного мониторирования. Период наблюдения составил 3 месяца.
Было отмечено, что снижение АД на фоне лечения фиксированной комбинацией лерканидипина с эналаприлом составляло в среднем 29,2/14,2 мм рт. ст. (по данным рутинного измерения) от исходного уровня 164,4/95,2 мм рт. ст. с уменьшением пульсового АД на 15,0 ± 16,4 мм рт. ст. Особую важность представляют данные об уменьшении частоты микроальбуминурии через 3 месяца после начала терапии с 14,6 до 6,5 % (p < 0,001). Частота достижения целевых уровней АД составила 63,5 % по данным рутинного измерения АД, 56,2 % – по данным его самоизмерения и 39,0 % – по результатам суточного мониторирования АД [26].
Ряд авторов [22–26] сообщают о хорошей переносимости Корипрена®: частота побочных явлений при его применении составила 1,8–5,0 %. Так, J. Scholze и соавт. выявили низкую частоту побочных эффектов данной комбинации – 3,4 %, причем частота кашля составила менее 1 %, а отеки нижних конечностей не были зафиксированы ни в одном случае [26]. Сходные данные получены L. Rump и соавт.: побочные эффекты отмечены в 1,8 % случаев, серьезные – лишь в 0,2 % [25].
Таким образом, новая фиксированная комбинация БКК III поколения (лерканидипин) и ИАПФ (эналаприл) – Корипрен® – характеризуется высокой антигипертензивной эффективностью, хорошей переносимостью, значительным органопротективным эффектом и метаболически нейтральна. Особый интерес представляет ее применение в лечении пациентов с АГ пожилого возраста с метаболическим синдромом, сахарным диабетом, при наличии поражений органов-мишеней (гипертрофия ЛЖ, микроальбуминурия).


