Инфекция мочевых путей (ИМП) – одно из самых распространенных бактериально-воспалительных заболеваний детского возраста. В неонатальном периоде ИМП могут быть фатальными из-за высокого риска развития сепсиса и менингита. В более старшем возрасте ИМП протекают менее тяжело, однако при прогрессировании рефлюкс-нефропатии возможно развитие гипертонии и хронической почечной недостаточности. Как правило, ИМП чаще встречаются среди девочек 1-го года жизни. Было подсчитано, что в возрасте до 11 лет риск развития ИМП выше у девочек (3 %), чем у мальчиков (1,1 %) [1]. По данным нашей клиники за ряд лет, среди детей раннего возраста (0–3 года), госпитализированных по поводу лихорадочного заболевания, пациенты с ИМП составляли 12,2 %, а среди больных бактериальной инфекцией – самую большую группу (40 %) [2].
К факторам риска развития ИМП относят женский пол, наличие ПМР (пузырно-мочеточникового рефлюкса), обструкцию мочевыводящих путей, запоры, семейный анамнез и, по некоторым данным, отсутствие обрезания у мальчиков. Второй эпизод ИМП следует за первым в течение первого года у 50 % девочек, в течение 2 лет – у 75 % [3]. В течение 1–2 лет после 1-го ИМП у 5–15 % пациентов выявляется нефросклероз, в 32–70 % случаев данное осложнение диагностируется уже при первом обследовании [4].
Точная распространенность мочевых инфекций неизвестна, поскольку инфекция может протекать субклинически (без лихорадки) или иметь расплывчатые неспецифические клинические признаки (без повышения уровня лейкоцитов в крови и существенной лейкоцитурии). Частота афебрильных ИМП у детей от 2 месяцев до 2 лет составляет около 5 % [5]. Особенности сбора мочи у детей, не контролирующих мочевой пузырь, также подразумевают некоторую погрешность в установлении диагноза. И наконец назначение антибактериальной терапии (АБТ) детям с фебрильным заболеванием, протекающим с катаральными явлениями или отсутствием четкого очага инфекции до получения анализа мочи и посева, может маскировать точный диагноз.
Топическая диагностика бактериального воспаления необходима для обоснования длительности АБТ. ИМП разделяют по уровню поражения, наличию или отсутствию осложняющих факторов (обструктивные и необструктивные), по месту возникновения инфекции (внебольничная и нозокомиальная), характеру инфекционного процесса (острая, рецидивирующая, хроническая и др.). К неосложненным (необструктивным) ИМП относятся только цистит и острый пиелонефрит без структурных уропатий и неврологических нарушений (незаторможенный мочевой пузырь и т. д.). Обструктивные уропатии (мочекаменная болезнь, аномалии развития и расположения почек, стриктуры мочеточника, уретриты, ПМР) – прерогатива урологов.
Острый неосложненный цистит – наиболее распространенный вариант ИМП у девочек 2–6 лет. Классическими симптомами являются рези при мочеиспускании, частое мочеиспускание, императивные позывы, гематурия, лейкоцитурия, бактериурия, нефебрильная лихорадка.
Маленькие пациенты не могут четко описать характер дизурии, поэтому в детском возрасте часто используется термин “цистоуретрит”. Некоторые авторы подчеркивают, что уретрит – заболевание, передающееся половым путем, носит специфическую природу, следовательно, должен рассматриваться отдельно от ИМП [6].
Острый осложненный цистит чаще бывает у взрослых, а у детей он развивается при наличии иммунодефицитных состояний, метаболических нарушениях, анатомических дефектах (чаще у мальчиков), нейрогенной дисфункции мочевого пузыря. Об осложненном цистите следует думать при сохранении или возобновлении симптомов в течение 7 дней. Разграничение этих двух нозологий необходимо в связи с различной длительностью терапии.
Пиелонефрит – бактериальное воспалительное заболевание почечной паренхимы и лоханки. В клинике ведущими симптомами являются фебрильная лихорадка, интоксикция, боли в животе и/или пояснице, лейкоцитурия и лейкоцитоз, бактериурия, повышение уровня острофазовых белков крови. У новорожденных, склонных к диссеминации бактериального процесса, симптомы малоспецифичны: субнормальная или слегка повышенная температура, апатия, анорексия, потеря массы тела или плоская весовая кривая; интоксикация проявляется серым колоритом кожных покровов [7].
Хронический пиелонефрит – длительно текущий воспалительный процесс на фоне аномалий развития органов мочевыделения, обструктивных уропатий, приводящий к фиброзированию и деформации чашечно-лоханочного аппарата и паренхимы почек (пиелонефротическое сморщивание).
Острая лобарная нефрония (acute lobar nephronia) или острый очаговый пиелонефрит (фокальный бактериальный нефрит) – острая бактериальная паренхиматозная инфекция, поражающая одну или более ренальных долей [8]. Клинические и лабораторные признаки сходны с острым пиелонефритом или абсцессом почки [9]. Многие нефрологи считают, что острый очаговый пиелонефрит – это и есть истинный пиелонефрит. Выделение его в подобную нозологию избыточно стало возможным в связи с появлением новых возможностей визуализации. Дифференциальная диагностика проводится посредством ультразвукового сканирования, подтверждается компьютерной томографией с контрастным усилением [10].
Асимптоматическая бактериурия (АСБ) обычно обнаруживается при диспансеризации или исследовании для выяснения причины субфебрилитета без каких-либо жалоб и клиники со стороны мочевого тракта. АСБ характеризуется наличием роста в моче более 10 тыс. КОЕ/мл одного и того же микроорганизма по крайней мере в двух посевах, собранных по правилам асептики, в отсутствие каких-либо изменений со стороны органов мочевыделения [11]. В клинической практике отсутствуют достоверные критерии риска формирования ИМП в случаях длительной и/или массивной АСБ [12, 13].
Острое воспалительное заболевание мочевых путей в педиатрии – одно из инфекционных заболеваний, представляющее диагностические трудности, особенно для детей раннего возраста, ввиду недостаточно характерной клинической картины. Часто причиной госпитализации таких больных является только лихорадка без каких-либо других симптомов [7].
“Золотым стандартом” в диагностике ИМП считается посев мочи. Диагностическим является титр 105 или 104 КОЕ/мл с преимуществом монокультуры. Однако по рекомендациям Европейской ассоциации урологов [14] менее выраженная бактериурия также клинически значима, даже если моча не собралась уретральным катетером. Так, согласно этим рекомендациям, бактериурия ≥ 103 КОЕ/мл в средней порции мочи при самостоятельном мочеиспускании свидетельствует о неосложненном цистите. Бактериурия ≥ 104 в средней порции указывает на неосложненный пиелонефрит. При получении мочи с помощью надлобковой пункции мочевого пузыря любая степень бактериурии считается патологической.
В настоящее время широко используются скрининговые тесты, включающие определение эстеразы лейкоцитов, нитритов и прямую микроскопию. Эти тесты имеют преимущества по скорости выполнения анализов, низкой стоимости, отсутствию необходимости технической экспертизы (участия врача-лаборанта). Ограничением по использованию нитритного теста является необходимость наличия определенной концентрации мочи (утренняя моча), что мало выполнимо для младенцев.
Наиболее достоверным методом является прямая микроскопия с выявлением лейкоцитов и бактерий в пробе мочи. В нескольких клинических испытаниях сравнивали результаты исследования мочи тест-полосками и количественным культуральным методом. При этом чувствительность и специфичность экспресс-методики была весьма скромной (80%) [15, 16]. Забор мочи у детей, неконтролирующих мочевой пузырь мочеприемниками, приводит к тому, что истинная бактериурия выявляется только в 7,5 % образцов [17]. Поэтому при сомнительных результатах, сохранении подозрения на ИМП забор мочи должен проводиться надлобковой пункцией или мочевым катетером.
Обычно считается, что ИМП являются восходящими: из области уретры патогенные микроорганизмы достигают нижних или более высокорасположенных мочевых путей. Кроме восходящего (преимущественно энтеробактерии) инфекции могут возникать и гематогенным (бактериемия, сепсис), per continuitatem (при внутрибрюшных поражениях) или лимфогенным (кишечный лимфатический дренаж) путем. Гематогенно преимущественно распространяется стафилококк. При этом возникает карбункул почки (субкапсульный абсцесс). Другие возбудители при гематогенном распространении – кандиды и микобактерии туберкулеза [18]. По нашим наблюдениям, у пациентов с явно гематогенным путем инфицирования (острый очаговый пиелонефрит, острый кортико-медулярный пиелонефрит, карбункул почки) в посевах мочи и крови выделялись Escherichia coli или Klebsiella pneumoniaе (кишечная палочка значительно чаще).
Согласно данным ESGNI (European Study Group on Nosocomial Infection), основным патогеном, вызывающим ИМП, является E. coli (35,6 %), реже встречаются Enterococcusspp. (15,8 %), Candida spp. (9,4 %), Klebsiella spp. (8,3 %), Proteus spp. (7,9 %), Pseudomonas aerugenosa (6,9 %). В России 80 % случаев неосложненных острых ИМП вызывает E. coli; Proteus spp. – 8,2 %, Klebsiella spp. – 3,7 %, Staphylococcus saprophyticus – 3 %, Enterobacter spp. – 2,2 %, Pseudomonas aerugenosa – 0,7 % [19]. В наших собственных наблюдениях E. coli была выявлена в 70 % случаев ИМП у пациентов педиатрических и в 32 % случаев ИМП в урологических отделениях (осложненные ИМП). Структура возбудителей ИМП у детей, госпитализированных в педиатрическое и урологическое отделения НЦЗД РАМН, представлена в табл. 1.
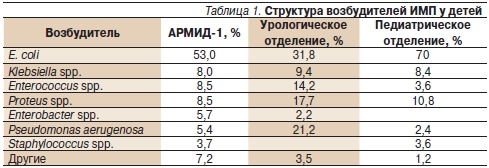
При назначении антибиотиков помимо глобальных тенденций резистентности необходимо учитывать достоверные локальные данные об устойчивости наиболее частых возбудителей амбулаторных и нозокомиальных инфекций мочевой системы.
В составе хромосом энтеробактерий есть гены, кодирующие β-лактамазы классов А и С [20]. У E. сoli и Proteus mirabilis продукция хромосомных β-лактамаз класса С или не определяется, или минимальна. Они обладают природной чувствительностью ко всем β-лактамным антибиотикам, кроме природных и полусинтетических. Эти микроорганизмы чувствительны к цефалоспоринам 1-го поколения, но высокая резистентности не позволяет рассматривать эти препараты как средство эмпирического лечения соответствующих инфекций. Препаратом выбора при выявлении вышеуказанных возбудителей являются ингибиторозащищенные пенициллины или цефалоспорины II–IV поколений [21].
Klebsiellaspp., Proteusvulgaris, Citrobacter diversus также продуцируют в незначительном количестве хромосомные β-лактамазы, но класса А. У перечисленных выше возбудителей наибольшая чувствительность определяется к ингибиторозащищенным пенициллинам, цефалоспоринам II–IV поколений, монобактамам и карбопинемам [18].
Частота выделения чувствительных микроорганизмов у E. coli к оральным формам антибактериальных препаратов, рекомендуемых в лечении ИМП, отображены в табл. 2.
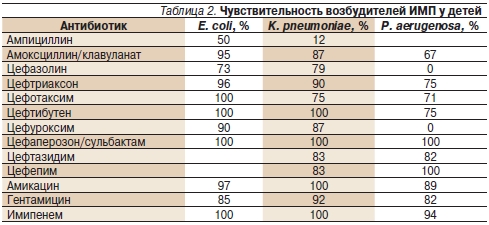
Как видно из представленных данных, наибольший процент резистентности отмечается у кишечной палочки к ампициллину (33,1 %) и ко-тримаксозолу (19,4 %), наименьший – к цефтибутену, нитрофурантоину и фосфомицину (0 %). Enterobacterspp., Citrobacterfreundii, Serraciaspp., Morganella morganii, Providencia stuartii – типичные госпитальные патогенны, возбудители осложненных ИМП – являются одной из наиболее сложных групп для лечения β-лактамными антибиотиками. У этих микроорганизмов индуцибельная продукция хромосомных β-лактамаз класса С. Индукторами являются аминопенициллины, цефалоспорины I поколения, в меньшей степени – цефалоспорины II поколения. Карбапинемы относятся к сильным индукторам, но их высокая природная активность позволяет использовать эти препараты в терапии инфекций, вызванных перечисленными выше бактериями. К низкоиндуцирующим относят цефалоспорины III–IV поколений, монобактамы, карбокси- и уреидопенициллины [18].
Чувствительность флоры у детей с ИМП за последнее десятилетие претерпела значительные изменения. Если в конце 1990-х гг. кишечная палочка была чаще всего чувствительна к амоксициллину, который и был препаратом первого выбора, то сейчас, по нашим данным, к амоксициллину чувствительны всего 48,5 % ее штаммов. К цефалоспоринам сохраняется высокая чувствительность (от 96,1 к цефуроксиму до 100 % к цефтибутену). Устойчивость E. сoli к цефалоспоринам III поколения остается в пределах 5 % для внебольничных ИМП (по нашим данным, 4 % в педиатрических отделениях и 9 % в урологических). Чувствительность основных возбудителей ИМП у детей педиатрического отделения НЦЗД РАМН представлена в табл. 2.
При осложненных ИМС (в 63 % случаев) частота выделения E. coli снижается и чаще выявляются P. aeroginosa, Enterococcusspp. и Proteusspp.
Амоксициллин в отношении Proteus spp. и Klebsiella spp. более активен, чем цефуроксим, цефотаксим и цефоперазон. Низкая активность цефураксима в отношении Proteus spp. (54–56 %) требует осторожного назначения этого препарата в связи с высокой частотой выявления указанного патогена. Применение цефалоспоринов при ИМП может ограничивать высокий уровень распространения Enterococcus spp., резистентных к данной группе препаратов.
Целью терапии ИМП являются снижение выраженности симптомов острого заболевания, устранение возбудителя, снижение риска развития рецидивов и поражения почек, а также отдаленных осложнений. Назначение АБТ внутрь обычно приводит к быстрому разрешению мочевой инфекции. Парентеральное введение препаратов показано младенцам или при подозрении на пиелонефрит. Особенности современного микробного спектра ИМП и чувствительности флоры определяют выбор препаратов. Очевидно, что амоксициллин больше не является препаратом первого выбора. В качестве начальной терапии при развитии неосложненного острого пиелонефрита Европейской ассоциацией урологов (2011) рекомендовано использовать фторхинолоны (у взрослых) или цефалоспорины III поколения курсами по 7–10 дней. К альтернативным препаратам относятся аминогликозиды и амоксициллин/клавуланат. При тяжелых формах ИМП эмпирическую терапию рекомендовано начинать парентерально в течение 2–4 дней с продолжением перорально после стабилизации состояния больного и достижения лабораторной ремиссии.
Согласно Федеральному руководству для врачей по использованию лекарственных средств в России (раздел 5 “Противомикробные средства”), при лечении острого цистита на 5–7 дней назначаются следующие препараты:
• амоксициллин/клавуланат (препарат выбора);
• оральные цефалоспорины II–III поколений (цефуроксим аксетил, цефаклор, цефтибутен);
• ко-тримоксазол, налидиксовая кислота, нитрофурантоин.
При лечении неосложненного пиелонефрита рекомендуются:
• амоксициллин/клавуланат, ампициллин/ сульбактам;
• цефалоспорины III–IV поколений (цефотаксим, цефтриаксон, цефоперазон, цефепим, цефоперазон сульбактам).
Альтернативные препараты:
• аминогликозиды (гентамицин, нетилмицин, амикацин);
• карбапинемы (имипенем, меропенем).
При терапии кортикального абсцесса:
• препаратом выбора является оксациллин;
• альтернативные препараты – цефазолин и ванкомицин.
Амоксициллин/клавуланат (90 мг/кг/сут) с амикацином (15 мг/кг/сут) – комбинация, успешно применяемая для консервативного лечения гнойных пиелонефритов, по cобственным данным НЦЗД РАМН.
При терапии медуллярного абсцесса и апостематозного пиелонефрита рекомендовано:
• амоксициллин/клавуланат, ампициллин/ сульбактам;
• цефалоспорины III–IV поколений (цефотаксим, цефтриаксон, цефоперазон, цефепим, цефоперазон/сульбактам).
Альтернативные препараты:
• цефоперазон/сульбактам;
• карбапинемы (имипенем, меропенем);
• тикарциллин/клавуланат;
• ампициллин + аминогликозиды.
При подозрении на метициллинорезистентные стафилококки применяют ванкомицин и линезолид. Курс лечения составляет не менее 21–28 дней (до 6 недель), первые 7–10 дней препарат вводится парентерально.
Целями противорецидивной терапии являются создание субингибиторной концентрации препарата в крови и моче (когда действие антибиотика бактериостатическое), снижение адгезивных свойств уропатогена, подготовка бактерий к фагоцитозу и его усиление.
Противорецидивная терапия назначается [22]:
• при подозрении или подтверждении ПМР;
• при рецидивирующем течении ИМП (даже при неподтвержденном ПМР);
• при подозрении на аномалию органов мочевыделения на основании данных УЗИ.
Целесообразность проведения противорецидивной терапии продолжает обсуждаться [23], т. к. наличие ПМР 1–3-й степени у пациентов до 6 лет не влияет на риск рецидивирования ИМП, а применение уросептиков или антибиотиков в профилактических дозах приводит к повышенному риску развития резистентной инфекции в дальнейшем.
Независимо от метода лечения ИМП частота развития нефросклероза у детей моложе 2 лет выше, чем у детей старшего возраста [24]. Частота рубцовых изменений в почках зависит от наличия ПМР и не зависит от длительности проведения парентеральной терапии [25]. Ранняя адекватная терапия ИМП (первые 2 дня от начала заболевания) снижает вероятность вовлечения почечной паренхимы в воспалительный процесс, но не предотвращает ее рубцевания [26].
Одним из цефалоспоринов III поколения для приема внутрь является цефтибутен, обладающий широким спектром антибактериальной активности in vitro. Цефтибутен эффективен в отношении большинства грамотрицательных микроорганизмов и стрептококков и обладает высокой устойчивостью по сравнению с другими цефалоспоринами к бактериям, продуцирующим β-лактамазы расширенного спектра, благодаря добавлению карбоксиэтилидиновой группы в 7-ю позицию ациллярной части β-цепи. Цефтибутен обладает хорошими фармакокинетическими характеристиками – высокой биодоступностью при приеме внутрь, периодом полувыведения 2–3 часа (что превосходит данный показатель других цефалоспоринов, в т. ч. цефалексина, цефаклора, цефуроксима аксетила); терапевтическая концентрация препарата сохраняется при приеме внутрь 1–2 раза в сутки. Более того, препарат хорошо переносится как взрослыми, так и детьми, вызывает меньшее, чем амоксициллин/клавуланат, количество желудочно-кишечных расстройств.
По сравнению с другими цефалоспоринами (в т. ч. цефаклором, цефтазидимом, цефуроксимом и цефалексином) цефтибутен более активен и обладает сходной или большей, чем цефиксим и цефотаксим, активностью в отношении энтеробактерий, продуцирующих β-лактамазы расширенного спектра, кодированные плазмидами. Так же как и другие цефалоспорины, цефтибутен не активен по отношению к Pseudomonas spp., в т. ч. P. cepacia и P. aeruginosa, хотя в одном исследовании было показано, что 50 % культуры Р. cepacia было подавлено цефтибутеном в дозе 2 мг/л [27]. Штаммы E. coil, K. pneumoniae, M. morganii, P. vulgaris, P. rettgeri и P. stuartii были более чувствительны к цефтибутену, чем к амоксициллину/клавуланату и ко-тримоксазолу (триметоприм/сульфаметоксазол) [28]. В клинических исследованиях было показано, что цефтибутен в дозе 9 мг/кг/сут, назначаемый детям 1 раз в день, эффективен при лечении острых ИМП, как осложненных, так и неосложненных.
На основании рандомизированного открытого многоцетрового исследования, проведенного в Швеции (2008–2009), показана бактериологическая и клиническая эффективность и безопасность перорального применения цефтибутена в дозе 9 мг/кг один раз в день детьми от месяца до 12 лет с первым эпизодом фебрильной ИМП. Кишечная палочка была выявлена в 96 % случаев, устойчивости к цефтибутену у нее выявлено не было. Показатели эффективности цефтибутена были значительно выше, чем у ко-тримоксазола, в группе сравнения (93 и 83% соответственно). Побочные явления были одинаковыми для обоих препаратов и в основном состояли из желудочно-кишечных расстройств [21]. Следует отметить, что связывать симптомы раздражения ЖКТ только с приемом препаратов некорректно, т. к. известно, что одним из возможных симптомов ИМП у детей раннего возраста являются рвота, диарея и боли в животе.
В других исследованиях было показано, что цефтибутен хорошо переносится детьми. Нежелательные явления наблюдались у 3 % пациентов и чаще всего проявлялись легкой диареей, которая чаще всего развивалась в случае пролонгирования терапии [29]. Прием цефтибутена не влияет на агрегацию тромбоцитов и витамин К-опосредованные показатели свертывания крови, что делает возможным его прием пациентами с очаговым поражением почек, в т. ч. с абцессами [30].



