Желудочно-кишечный тракт (ЖКТ) человека представляет собой открытую биологическую систему, которая находится в постоянном контакте с внешней средой, в т. ч. с различными микроорганизмами. На слизистой оболочке кишечника концентрация микроорганизмов составляет более 1010-12 колониеобразующих единиц (КОЕ)/г, в то время как на коже она достигает 105-6 КОЕ/г. Видовой состав микробиологического пейзажа в кишечнике представлен более 450–500 видами бактерий, не считая персистирующих вирусов, простейших, а также грибов. Соотношение строго анаэробных бактерий (Lactobacillus, Вifidobacterium, Clostridium, Bacteroides, Prevotella, Actinimyces, Fusobacteriaи др.) к аэробным (Enterococcus, Staphylococcus, Escherichiaи др.) в толстой кишке составляет 1000/1 [1, 2]. Количественные соотношения между различными микробными популяциями характеризуются определенной стабильностью и формируются с первых дней жизни ребенка.
Первоначальная колонизация кишечника ребенка имеет большое значение для формирования биоценоза взрослого человека. Продемонстрировано, что бактерии, первыми прикрепившиеся к эпителию кишечника и ставшие резидентами, могут изменять экспрессию генов энтероцитов хозяина, создавая благоприятные условия для собственного существования и препятствуя колонизации другими микроорганизмами. Например, Bacteriodes thetaiotaomicron модифицируют степень гликозилирования слизистой оболочки за счет изменения активности гена колоноцита, кодирующего гликозилтрансферазу, и тем самым создают наиболее оптимальную для себя экологическую нишу [3, 4].
Колонизация пищеварительного тракта ребенка происходит во время родов – при прохождении через родовые пути матери, в которых у здоровой женщины колонизированы преимущественно лактобациллы и бифидобактерии. Характер родоразрешения в значительной мере влияет на видовой состав заселяющейся микрофлоры. У детей, рожденных путем кесарева сечения, нарушается процесс формирования нормального биоцноза: отмечается снижение уровня бифидобактерий, повышение клостридий и бактероидов. После рождения продолжается колонизация ЖКТ новорожденного различными микроорганизмами от матери, персонала и окружающей среды [5].
“Идеальными” условиями для правильного формирования биоценоза кишечника можно считать совместное пребывание матери и ребенка с первых часов жизни и естественное вскармливание. В этом случае ребенок контактирует с микроорганизмами, с которыми уже взаимодействовала иммунная система матери.
Основными механизмами, участвующими в контроле качественного и количественного состава микробиоцeноза в кишечнике, являются неспецифические и специфические факторы иммунологической защиты (табл. 1), созревание которых в свою очередь происходит под воздействием микрофлоры кишечника.
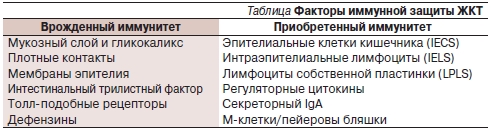
Местная иммунная система пищеварительного тракта представлена лимфоидной тканью кишечника (GALT – gut-associated lymphoid tissue), которая включает различные клетки или скопления клеток, расположенных как в эпителии собственной пластинки слизистой оболочки, так и в подслизистом слое. Эффективность работы GALT-системы зависит от заселения кишечника индигенной микрофлорой. M-клетки, расположенные в слизистой оболочке кишечника, путем эндоцитоза осуществляют доставку микробных антигенов из просвета кишечника в лимфоидную ткань с последующей презентацией этого антигена лимфоцитам [6]. После презентации антигенов Т-хелперам и макрофагам происходит трансформация Th0-клеток в Th1 или в Th2. Трансфорация в Th1 сопровождается выработкой провоспалительных цитокинов: интерлейкина-1 (ИЛ-1), фактора некроза опухоли α и интерферона γ, активацией фагоцитоза, миграцией нейтрофилов, усилением окислительных реакций и синтезом иммуноглобулина А (IgA). Все эти реакции направлены на элиминацию антигена. Дифференцировка в Th2 способствует выработке противовоспалительных цитокинов: ИЛ-4, ИЛ-5 и ИЛ-10. С одной стороны, с помощью такого механизма осуществляется контролируемое противостояние чужеродному для организма антигенному материалу, с другой – одновременное сосуществование с собственной микрофлорой [7, 8].
К компонентам иммунной системы ЖКТ также относят мукозный слой (муцин), покрывающий эпителиальные клетки (см. рисунок). Секреты бокаловидных клеток – слизистые гликопротеиды и интестинальный трилистный фактор (ITF), образуют слизистый гель, который служит серьезной преградой для микроорганизмов. Антимикробные пептиды и протеины, секретируемые клетками Панета, также представлены в муцине. Клетки Панета играют важную роль в иммунной защите слизистой оболочки кишки. Это специализированные эпителиальные клетки, расположенные в основании мелких интестинальных крипт и контролирующих просвет кишечника. Они способствуют защите организма и поддержанию гастроинтестинального барьера посредством секреции в просвет кишечника ряда антибактериальных белков (дефензинов, лизоцима и секреторной фосфолипазы А2) [9, 10], которые защищают близлежащие клетки и контролируют плотность микроорганизмов. Часть этих белков содержится в клетках Панета в виде гранул и ресинтезируется по мере использования, другие секретируются непосредственно в муцин. В норме клетки Панета присутствуют только в тонкой кишке, но при воспалительных заболеваниях толстой кишки они могут обнаруживаться в слизистой оболочке толстой кишки, повышая противомикробную защиту пораженного органа [11].
Важную роль в поддержании местного иммунитета играет секреторный IgA, продуцируемый в кишечнике. Основная функция IgA заключается в связывании антигенов на поверхности слизистой оболочки, что препятствует их проникновению внутрь организма, таким образом предотвращая развитие воспаления.
Интересные данные получены при изучении механизмов продукции IgA, в которых было выявлено существование путей примитивного не зависимого от Т-клеток IgA-ответа на бактерии-комменсалы ЖКТ [12]. Так, было показано, что антигены клеточной стенки и белки эшерихий способны у мышей индуцировать T-независимый синтез IgA В-клетками, диффузно локализованными на собственной пластинке (lamina propria).
Пищеварительный тракт является самым большим иммунологическим органом в организме, в котором клетки иммунной системы непрерывно взаимодействуют с интестинальной микрофлорой. В настоящее время получены многочисленные данные, раскрывающие взаимодействие микрофлоры с клетками слизистой оболочки кишечника. Доказано, что иммунный ответ слизистой оболочки пищеварительного тракта обусловлен распознаванием микробных компонентов, известных как патоген-ассоциированные молекулярные паттерны (PAMPs) специфических паттерн-распознающих рецепторов (PRR) [13, 14].
К PAMPs относятся липополисахариды (ЛПС), капсульные полисахариды (зимозан), тейхоевые кислоты, мананны, пептидогликаны, липопротеиды, поверхностные белки (флагеллины), бактериальные ДНК, глюканы. Несмотря на значительные химические различия этих веществ, все РАМРs имеют общие свойства [15]. Во-первых, все РАМРs образуются только микробами, а не их хозяином. Например, липополисахарид синтезируется только бактериями, PRR распознают его, сигнализируя хозяину о присутствии в организме инфекции. Во-вторых, структуры, узнаваемые врожденной иммунной системой, обычно важны для выживания или патогенности микроорганизмов. В-третьих, РАМРs – обычно инвариантные структуры, присущие всему классу патогенов. Например, все грамотрицательные бактерии содержат ЛПС, следовательно, рецепторы хозяина, распознающие образ ЛПС, фактически выявляют любую грамотрицательную инфекцию.
PRR-рецепторы идентифицированы на антиген-презентирующих клетках (интестинальных эпителиальных клетках – IEC), клетках Панета, макрофагах, дендритных клетках и моноцитах. Двумя главными системами PRR, способными распознавать патогенные и непатогенные бактерии, являются семейство Toll-like-рецепторов (TLR – Toll-like receptor) и молекулы NOD/CARD. Изучено несколько путей передачи сигналов, индуцированных этими рецепторами, и описаны ответы эффекторов [16, 17]. Белки TLR и NOD в кишечнике играют ключевую роль во взаимодействии бактерий и организма-хозяина. У мышей с дефектными TLR по сравнению с животными, имеющими TLR дикого типа, отмечены замедленная пролиферация энтероцитов и сниженный уровень факторов-цитопротекторов, что может иметь клиническое значение в развитии хронического воспаления в кишечнике [18].
В ряде исследований показано, что мутации в генах TLR увеличивают вероятность инфекционных заболеваний, а также хронических воспалительных болезней [19, 20].
В настоящее время у человека изучено десять известных TLRs (TLR1-10), четыре из которых являются очень важными для обнаружения бактерий (TLR2, TLR4, TLR5 и TLR9). TLR2 идентифицирует пептидогликаны, липотейхоевые кислоты и различные гликопротеиды, которыми богаты грамположительные бактерии. TLR4 распознает липополисахариды, специфичные для грамотрицательных бактерий, термически шоковых протеинов и фибронектина. TLR5 распознает флагеллин жгутиков энтероинвазивных бактерий, в то время как TLR9 идентифицирует бактериальную ДНК, богатую неметилированными CpG соединениями. Распознавание PAMPs микроорганизмов семейством TLR позволяет иммунной системе адекватно реагировать на различные микробные продукты патогенных микроорганизмов. Активация иммунного ответа через TLR происходит при обнаружении возбудителя, в то время как собственные антигены не распознаются рецепторами врожденной иммунной системы. Распознавание врожденной иммунной системой контролирует все основные аспекты приобретенного иммунного ответа через узнавание микроорганизмов и индукции сигналов для запуска адаптивного иммунитета. Таким образом, взаимодействие PAMPs с TLR необходимо для поддержания тканевого гомеостаза и предотвращения развития нежелательных иммунных реакций на непатогенные комменсальные бактерии.
Эффективность интестинальной иммунной системы зависит от заселения кишечника нормальной микрофлорой. Наглядным примером огромного значения, которое оказывает нормальная микрофлора кишечника на созревание иммунной системы, служат результаты исследований на животных, выращенных в стерильных условиях, – гнотобионтах. В отсутствие микробов у экспериментальных животных отмечено низкое количество пейеровых бляшек и более чем 10-кратное снижение числа В-лимфоцитов, продуцирующихIgA. Также у этих животных было снижено число гранулоцитов, а имеющиеся гранулоциты были не способны к фагоцитозу. Лимфоидные структуры организма оставались рудиментарными, также была нарушена или снижена реакция гиперчувствительности замедленного типа Т-клеток. Но после имплантации стерильным животным представителей нормальной кишечной микрофлоры (лактобацилл, бифидобактерий и энтерококков) у них развивались иммунные структуры кишечника [21]. Эта экспериментальная модель отражает нормальные онтогенетические процессы параллельного становления микробиоценоза и созревания иммунной системы кишечника.
Установлено, что нормальная микрофлора кишечника выполняет несколько чрезвычайно важных для организма хозяина функций. Первая функция связана с формированием колонизационной резистентности в кишечнике, предотвращающей его заселение экзогенными микроорганизмами и их избыточное размножение. В итоге это обеспечивает устойчивость человека к инфекционным заболеваниям, вызываемым различными патогенными микроорганизмами. Представители нормальной микрофлоры ЖКТ обеспечивают его защиту от экзогенных инфекционных агентов за счет синтеза различных веществ, подавляющих рост и размножение этих микроорганизмов, а также путем успешной конкуренции с ними за места прикрепления на поверхности слизистой оболочки кишечника и за источники питания. Другой механизм обеспечения колонизационной резистентности представителей нормальной микрофлоры кишечника связан с их способностью вызывать значимую неспецифическую стимуляцию гуморального и клеточного иммунитета.
Вторая важная для организма хозяина функция микрофлоры кишечника обусловлена ее высокой метаболической активностью. Одну из важнейших функций кишечной микрофлоры представляет синтез короткоцепочечных жирных кислот (КЖК): уксусной, пропионовой, масляной, валериановой, капроновой, и их изомеров. Эти метаболиты играют особую роль и выполняют много разнообразных функций как в регуляции кишечного микробиоценоза, так и в поддержании гомеостаза организма. При распаде КЖК образуется масса энергии, поэтому они служат дополнительным автономным источником энергообеспечения кишечного эпителия, следовательно, являются важным фактором регуляции пролиферации и дифференцировки эпителия толстой кишки. В результате усиления энергетических процессов в кишечном эпителии усиливается всасывание некоторых микроэлементов, например кальция, магния, железа. Это относится прежде всего к масляной кислоте. Пропионовая кислота регулирует микроциркуляцию в слизистой оболочке и поддерживает в ней трофические процессы, участвует в глюконеогенезе и синтезе биогенных аминов, блокирует адгезию патогенов. Уксусная кислота участвует главным образом в липогенезе и регуляции местного иммунитета. Она же обеспечивает антимикробный эффект, регулирует уровень рН и моторную и секреторную активность кишечника, благодаря чему тормозится рост и размножение патогенных и гнилостных микроорганизмов в ЖКТ, создаются оптимальные условия для роста и размножения нормальных симбионтов [22].
Крайне важно понимать, что положительные эффекты нормальной микрофлоры являются строго видо-, а чаще типоспецифическими, т. е. характерными для определенного штамма бактерий.
В настоящее время доказано и хорошо изучено иммуностимулирующее действие на систему местного иммунитета кишечника Bifidobacteriumbifidum, LactobacillusGGи Lactobacillusacidophilus [23].
Доказано, что лактобациллы как in vitro, так и in vivo подавляют размножение Klebsiellapneumoniae, Proteusvulgaris, Pseudomonasaeruginosa, Pseudomonasfluorescens, Salmonellatyphosa, Salmonellaschottmuelleri, Sarcinalutea, Shigelladysenteriae, Shigellaparadysenteriae, Serratiamarcescens, Staphylococcusaureus, Streptococcusfaecalis, Streptococcuslactis, Vibriocomma. В то же время молочнокислые бактерии необходимы для жизнедеятельности не менее важной популяции бифидобактерий. В экспериментах на крысах замечено, что при удалении лактобацилл или недостатке их в кишечнике рано или поздно происходило значимое снижение числа бифидобактерий [24, 25].
Благотворное влияние пробиотических штаммов доказано во многих двойных слепых плацебо-контролируемых исследованиях. Доказательной базой обладают B. bifidum, L. acidophilus, Lactobacillus GG. В последние годы было проведено несколько многоцентровых плацебо-контролируемых исследований, результаты которых подтвердили многолетний эмпирический опыт положительного влияния пробиотических препаратов при синдроме раздраженного кишечника с преобладанием диареи и других заболеваниях кишечника [26, 27].
Лактобациллы играют важную роль в иммуномодуляции, в т. ч. стимулируют фагоцитарную активность нейтрофилов, макрофагов, синтез иммуноглобулинов и участвуют в образовании интерферонов [28–30].
Недавно было показано, что бактерии рода Lactobacillus способны активировать клеточный иммунитет и подавлять продукцию IgE. Так, штамм Lactobacillus casei Shirоta обладал свойством изменять фенотип Т-хелперов (Th) от неонатально предоминированных Тh2, участвующих в реакциях гуморального иммунитета, на Thl, участвующих в клеточном иммунитете [31, 32].
В онлайновой публикации Nature Medicine от 19.12.2006 показано, что пероральный прием штамма L. acidophilus индуцирует экспрессию μ-опиоидных рецепторов и каннабиноидных рецепторов 2 в клетках кишечного эпителия, опосредующих анальгезирующие эффекты в кишечнике, что вносит свой вклад в модуляцию и восстановление нормальной перцепции висцеральной боли.
Некоторые пробиотические штаммы, например Bifidobacterium lactis, имеют т. н. статус GRAS (Generally Recognized as Safe), т. е. считаются безусловно безопасными для здоровья человека. Такие штаммы используют в целях обогащения детских смесей и кисломолочных продуктов. Codex Alimantarius разрешает включение пробиотиков в детские смеси, если имеются научные доказательства эффективности их действия. Адаптированным молочным смесям, содержащим пробиотики, свойственны хорошая переносимость, переваривание и высокая усвояемость.
На рынке в России в настоящее время имеются сухие и жидкие адаптированные молочные смеси с пробиотиками: смеси НАН (Нестле) содержат Bifidobacterium longum, Lactobacillus rhamnosus GG; НАН кисломолочный (Нестле) содержит B. lactis (bb12), S. thermophilus; Хипп 2 содержит B. lactis(bb12). В производстве жидкой адаптированной кисломолочной смеси Агуша кисломолочная (Россия) используются культуры B. lactis и Streptococcus thermophilus. Помимо смесей, содержащих пробиотические штаммы бактерий, и кисломолочных продуктов, в клинической практике у детей используются биологически активные добавки (БАД).
Выраженным клиническим эффектом обладает БАД Наринэ – лиофилизированные живые культуры L. acidophilus ИНМИА 9602 (Штамм Er 317/402). Наринэ обладает устойчивостью к действию соляной кислоты и желчи, высокой антагонистической активностью по отношению к условно-патогенной и патогенной микрофлоре (клебсиелле, протею, стафилококку, патогенной кишечной палочке, сальмонелле и др.), стимулирует иммунную защиту организма, эффект действия препарата клинически подтвержден.
Бактерицидные и бактериостатические свойства по отношению к широкому спектру патогенных микроорганизмов, стимуляция роста нормальной микрофлоры и выработки интерферонов – основные свойства БАДа Наринэ, предназначенной как для непосредственного употребления, так и в качестве закваски для приготовления кисломолочного продукта. Готовый кисломолочный продукт является продуктом питания для взрослых и детей с первого года жизни, может храниться до 3 суток в любом количестве. Продолжительность приема – не менее 20 дней.
Наринэ можно применять в комплексном лечении больных в следующих случаях:
• после и во время антибиотикотерапии;
• при острых и хронических кишечных инфекциях (дизентерии, брюшном тифе, сальмонеллезе и т. п.);
• при диспепсии различной этиологии;
• при иммунологической недостаточности, иммунопатологии, аллергии;
• для поддержания нормальной микрофлоры и повышения иммунологической активности.
Заключение
Выше были изложены современные представления о механизмах влияния микрофлоры на местную иммунную систему кишечника и воздействия микрофлоры на эту полифункциональную жизненно важную систему организма.
На основании серьезных научных исследований, доказывающих многогранный положительный эффект пробиотических штаммов на организм, применение их в современных условиях показано в педиатрической практике. Применение Наринэ, содержащей L. acidophilus, вполне обоснованно, т. к. она является эффективным методом восстановления как состава нормальной микрофлоры, так и функций ЖКТ.



