Введение
Рак молочной железы (РМЖ) занимает первое место в структуре заболеваемости и смертности от злокачественных новообразований среди женщин (20 и 17,3 % соответственно). В 2010 г. в России диагностирован 57 241 новый случай РМЖ, умерли от него 23 282 человека [1]. Несмотря на распространенность и совершенствование методов ранней диагностики РМЖ, у значительной доли больных заболевание выявляется на поздних стадиях. Результаты лечения метастатического РМЖ (мРМЖ) остаются неудовлетворительными. Методов радикальной терапии не существует;
современные препараты позволяют облегчить симптомы заболевания, улучшив качество жизни, и, возможно, увеличить продолжительность жизни [4].
В начале 1990-х гг. появление нового класса химиопрепаратов – таксанов – стало значительным достижением в лечении РМЖ. Первый препарат этой группы, паклитаксел, показал высокую эффективность при РМЖ как в терапии второй линии, так и в качестве стартовой терапии. Изначально
было предложено применение паклитаксела в дозах 135–175 мг/м2 каждые 3 недели (в виде внутривенной инфузии продолжительностью 3–24 часа). Монотерапия в этих дозах больных мРМЖ позволяет добиваться эффекта у 23–51 % больных (значительный разброс результатов связан с различиями в дозах и продолжительности инфузии в разных исследованиях, а также использовавшимися критериями оценки и особенностями включения больных). Токсичность такой терапии весьма значительна – нежелательные явления (НЯ) 1–4-й степеней, в первую очередь нейтропения и сенсорная невропатия, развиваются у 30–45 % больных [2, 5, 9, 10].
В последние годы более широкое распространение получила схема применения паклитаксела с еженедельным введением пониженных (60–100 мг/м2) доз препарата в виде внутривенной инфузии продолжительностью 1 час. Эффективность при этом не уступает или даже превосходит таковую для схемы с введением высоких доз каждые 3 недели, а токсичность существенно снижается [7, 8, 11, 12].
Для оценки эффективности и безопасности еженедельного введения 80 мг/м2 паклитаксела больным мРМЖ (Таксакад®, ЗАО “Биокад”, Россия) в виде внутривенной инфузии продолжительностью 1 час мы провели данное проспективное многоцентровое клиническое исследование.
Материал и методы
Критерии включения и исключения
В исследование включали женщин в возрасте 18–70 лет, больных мРМЖ, гистологически или цитологически подтвержденным (стадия по классификации TNM – любое Т, любое N, M1), имеющих измеряемые проявления заболевания. Оценка общего физического состояния больных по шкале ECOG (Eastern Cooperative Oncology Group) не должна была быть более 2 баллов. Ожидаемая продолжительность жизни на момент включения в исследование должна была составлять более 20 недель. В случае экспрессии опухолью рецепторов эстрогенов и/или прогестерона допускалась адъювантная терапия тамоксифеном или ингибиторами ароматазы. Все включенные больные дали информированное письменное согласие на участие в исследовании.
В исследование не включались больные с тяжелыми сопутствующими заболеваниями и хроническими
инфекциями, нарушениями функции внутренних органов, больные, получающие или получавшие в течение предшествующих 5 недель другие химиопрепараты лечения РМЖ, и больные, имевшие другие злокачественные новообразования в предшествующие 5 лет. Больных не включали в исследование, если единственным измеримым опухолевым очагом у них был метастаз в головной мозг, если при скрининговом обследовании у них выявлялась периферическая невропатия 2-й степени и выше. Не включали беременных и кормящих грудью женщин, больных с известной аллергией на препарат или
на входящие в его состав вещества, и больных, которые не могли выполнять требования протокола, включая лиц с психическими нарушениями, алкогольной и/или наркотической зависимостью.
Организация исследования
Паклитаксел (Таксакад®) в дозе 80 мг/м2 вводили еженедельно внутривенно в виде инфузии продолжительностью 1 час. Перед каждым введением препарата проводили премедикацию с целью профилактики развития аллергических реакций: 20 мг дексаметазона за 12 и 6 часов до введения паклитаксела, 50 мг дифенгидрамина и 50 мг ранитидина (или 300 мг циметидина) в 200 мл 0,9 %-ного раствора натрия хлорида внутривенно за 30 минут до введения паклитаксела.
Всего было запланировано 3 цикла по 8 еженедельных введений, т. е. в общей сложности 24 введения паклитаксела. Оценка противоопухолевого эффекта терапии проводилась по данным компьютерной томографии после каждого цикла химиотерапии, т. е. после 2, 4 и 6 месяцев лечения, а также при обследовании спустя 9 и 12 месяцев после начала лечения. По завершении всех трех циклов химиотерапии исследователь принимал решение о дальнейшем лечении. При наличии ответа на терапию лечение проводилось по той же схеме до прогрессирования заболевания или развития ток-
сических явлений, не позволяющих продолжать введение паклитаксела.
Сцинтиграфия для выявления метастазов в кости проведена однократно не более чем за 2 недели до начала терапии. Компьютерная томография (КТ) с контрастированием выполнялась для определения размера опухолевых очагов не более чем за 2 недели до начала терапии, на протяжении исследования после каждого 8-недельного цикла и спустя 9 и 12 месяцев после начала терапии. На протяжении исследования регулярно проводили физикальный осмотр, оценивали неврологический
статус, выполняли общий и биохими- ческий анализы крови, электрокардиографию и оценку общего физического состояния по шкале ECOG.
За больными наблюдали до прогрессирования или до 12 месяцев после начала терапии. При прогрессировании заболевания введение препарата прекращали и больная из исследования исключалась.
Исследование проведено в соответствии с требованиями Хельсинкской декларации, национального стандарта “Надлежащая клиническая практика”, ICH GCP, постановлениями государственных регуляторных органов и законами Российской Федерации.
Оценка безопасности и эффективности
Анализ безопасности терапии проведен всем больным, получившим хотя бы одну дозу исследуемого препарата. Оценивали общее число нежелательных явлений (НЯ) и серьезных нежелательных явлений (СНЯ), связанных с исследуемыми препаратами, число больных, досрочно завершивших исследование из-за возникновения НЯ/СНЯ, число больных с клинико-лабораторными отклонениями, возникшими или усилившимися в ходе исследования. НЯ определялось как новое неблагоприятное для больного состояние или усугубление имевшегося у больного состояния/заболевания, развившееся после начала приема исследуемого препарата или в период до 28 дней после прекращения приема исследуемой терапии. НЯ расценивали как серьезное в том случае, если оно приводило к смерти больного, потенциально угрожало жизни больного, потребовало госпитализации или продлило сроки текущей
госпитализации или если оно приводило к инвалидности или недееспособности больного. Тяжесть НЯ оценивали в соответствии с критериями NCI-CTC (National Cancer Institute Common Toxity Criteria, версия 2.0 от 1999 г.).
Для оценки эффективности терапии исследовали частоту объективных клинических ответов на проводимую терапию и время до прогрессирования (ВДП).
Ответ на лечение определяли на основании результатов КТ и оценивали в соответствии с критериями
RECIST (Response Evaluation Criteria In Solid Tumors). Полный ответ определяли как исчезновение всех целевых и нецелевых очагов, частичный ответ – как уменьшение общего объема опухоли по сравнению с базовой оценкой не менее чем на 30 %, прогрессирование – как увеличение общего
объема опухоли по сравнению с наименьшей суммой в течение исследования (включая базовую оценку, если она является наименьшей) минимум на 20 %, но не менее чем на 5 мм в абсолютном измерении (появление одного или более новых очагов является прогрессированием), стабилизация – как уменьшение по сравнению с базовой оценкой, недостаточное, чтобы классифицировать ответ как частичный, или увеличение по сравнению с наименьшим полным объемом опухоли в течение исследования, недостаточное, чтобы зафиксировать прогрессирование. ВДП определялось как время от начала терапии до даты подтвержденного прогрессирования заболевания.
Результаты исследования
Характеристика больных
В исследование были включены 19 женщин, наблюдавшихся в 3 исследовательских центрах. Медиана возраста составила 54,9 года (от 40 до 68). У 3 (15,8 %) больных на момент выявления заболевания диагностирована I стадия РМЖ, у 1 (5,3 %) – II, у 4 (21 %) – IIIа, у 1 (5,3 %) – IIIв, у 1 (5,3 %) – IIIc стадия и у 9 (47,3 %) больных исходно выявлена IV стадия РМЖ. На момент включения в исследование у всех больных имелись отдаленные метастазы. Адъювантную/неоадъювантную химиотерапию и/
или лучевую терапию получали 6 из 19 больных. Медиана продолжительности заболевания на момент включения в исследование по данным анализа 17 больных (у 2 больных точная дата выявления РМЖ неизвестна) составила 2 месяца (от 0 до 104 месяцев). При скрининге (до начала лечения) оценка физического состояния по шкале ECOG соответствовала “0” у 7 (47,3 %) пациенток, “1” у 6 (36,9 %), “2” – у 3 (15,8 %) пациенток.
Безопасность
Нежелательные явления той или иной степени на протяжении лечения наблюдались у 17 (89,5 %) из 19 больных, НЯ 3-й степени – у 6 (31,6 %) больных. НЯ 4-й степени не отмечено (табл. 1).
Таблица 1. Частота НЯ у 19 больных мРМЖ при еженедельном введении 80 мг/м2 паклитаксела
в виде внутривенной инфузии продолжительностью 1 час.
Наиболее частыми и тяжелыми НЯ были нейтропения и периферическая сенсорная невропатия, наблюдавшиеся у 15 и 11 больных соответственно, в т. ч. невропатия 3-й степени – у 3 больных, нейтропения 3-й степени – также у 3 больных. У одной больной отмечено повышение уровня аспартатаминотрансферазы (АСТ) 3-й степени (дальнейшее лечение прекращено в связи с прогрессированием заболевания). Также часто встречалась анемия – у 13 больных, однако у 11 из них это НЯ было спепени 1 и у 2 – степени 2. В целом большинство больных переносили лечение удовлетворительно. Запланированное лечение в полном объеме получили 14 больных; 4 больных выбыли досрочно вследствие прогрессирования, у 1 больной причиной отмены лечения стало развитие периферической невропатии 3-й степени.
Эффективность
Оценить эффективность лечения удалось у 18 из 19 больных. У одной больной после 1-го цикла терапии наблюдалась стабилизация заболевания, однако она не была подтверждена повторным КТ, т. к. больная выбыла из исследования в связи с НЯ.
После 3 циклов химиотерапии частичный ответ на лечение достигнут у 11 (57,9 %) из 19 больных.
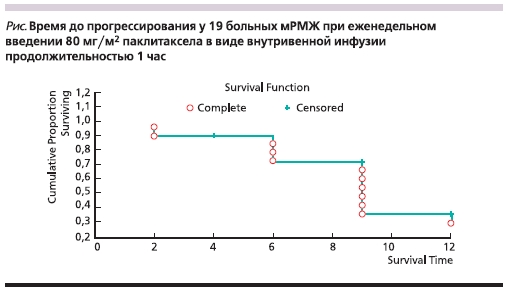
Стабилизация заболевания достигнута у 3 (15,8 %). Прогрессирование на фоне терапии наступило у 4 (21,1 %) больных, в т. ч. у 2 – после первого же цикла терапии паклитакселом, у 2 – после первоначально достигнутого частичного ответа. При медиане срока наблюдения 8,5 (от 2 до 24) месяцев медиана ВДП составила 9 (от 1 до 12) месяцев (см. рисунок).
Обсуждение
Полученные нами результаты свидетельствуют, что применение паклитаксела в дозе 80 мг/м2 еженедельно в виде одночасовой инфузии может быть эффективным и безопасным методом
терапии мРМЖ.
Таблица 2. Сравнение исследований еженедельного введения паклитаксела в режиме монотерапии больных мРМЖ.
Согласно литературным данным, еженедельное введение больным мРМЖ паклитаксела в виде одноча-
совых инфузий в режиме монотерапии в дозе 80–100 мг/м2 сопровождается ответом на терапию 35–50 % пациентов (табл. 2). Полный ответ наблюдается относительно редко – в среднем у 3,5 % больных, однако более чем у 30 % удается добиться частичного ответа. Медиана ВДП при таком лечении в этой группе больных составляет около 6,5 месяцев [7, 8, 11, 12]. Результаты нашего исследования в полной мере соответствуют литературным данным и даже несколько их превосходят – опухолевый ответ зарегистрирован у 57,9 % больных; медиана ВДП – 9 месяцев. Повышенная частота опухолевых ответов может быть объяснена исходно хорошим состоянием включенных пациенток (общее состояние
по шкале ECOG 0–2), отсутствием у большинства из них противоопухолевой терапии в анамнезе (адъювантная химио- и/или лучевая терапия проводилась только 6 больным), а также случайными факторами, связанными с небольшим числом участников исследования.
Безопасность еженедельных введений паклитаксела в дозе 80 мг/м2 в режиме монотерапии в нашем исследовании также была сопоставимой с результатами аналогичных зарубежных исследований. Частота, тяжесть и спектр НЯ соответствовали опубликованным данным. Мы не наблюдали НЯ 4-й степени, а периферическая невропатия и нейтропения наблюдались у 15 % больных каждая. Только у одной больной невропатия 3-й степени стала причиной отмены терапии.
Эти результаты позволяют сделать два важных вывода. Во-первых, полученные данные свидетельствуют о том, что еженедельные введения 80 мг/м2 паклитаксела в режиме монотерапии
могут быть эффективным и безопасным методом терапии больных мРМЖ. Больные этой группы часто получают комбинированные режимы химиотерапии, включающие таксаны, антрациклины и препараты платины, а в последние годы при гиперэкспрессии или наличии амплификации HER2- и анти-HER2-препараты. Однако на сегодняшний день преимущество таких схем перед монотерапией таксанами
больных мРМЖ окончательно не доказано [4]. Комбинированная терапия паклитакселом и карбоплатином больных мРМЖ сопровождается развитием опухолевого ответа в 40–60 % случаев [6], однако увеличение числа химиопрепаратов существенно повышает токсичность лечения. Возможно, у больных мРМЖ в отсутствие быстрого прогрессирования и угрожающих жизни висцеральных метастазов будет более целесообразно проведение менее агрессивной монотерапии, позволяющей
увеличивать выживаемость и сохранять достойное качество жизни [3].
Во-вторых, проведенное исследование продемонстрировало безопасность и эффективность применения отечественного препарата паклитаксела (Таксакад®). Частота и тяжесть реакций на введение паклитаксела российского производства не отличались от токсических явлений, описанных в исследованиях паклитаксела зарубежных производителей. Новых или неожиданных НЯ не наблюдалось. В условиях ограниченных ресурсов системы здравоохранения, характерных для большинства современных стран, производство воспроизведенных препаратов (генериков) является одним из основных способов повышения доступности терапии. Появление высококачественного российского препарата паклитаксела даст возможность проведения эффективного лечения бóльшему числу больных.
Проведенное нами исследование имеет ряд ограничений, связанных с его обсервационным дизайном, однако использование современных критериев оценки эффективности и безопасности терапии допускает примерное сопоставление полученных данных с результатами других авторов. Для определения оптимального режима терапии мРМЖ требуются дальнейшие сравнительные исследования, включающие помимо оценки показателей эффективности и безопасности анализ
качества жизни больных.



