В гастроэнтерологии и абдоминальной хирургии хроническая абдоминальная боль (ХАБ) является одной из основных проблем как с диагностической, так и с лечебной точки зрения. С ней ежедневно сталкиваются врачи многих специальностей, в первую очередь участковые терапевты и врачи скорой помощи. ХАБ в большинстве случаев является основным симптомом гастроэнтерологического заболевания.
Причины возникновения ХАБ многочисленны, а механизмы разнообразны. Вместе с тем основные характеристики боли разной этиологии (интенсивность, локализация, время возникновения, длительность и др.) не имеют строгой специфичности и часто схожи, что может приводить к диагностическим ошибкам и неправильному лечению.
Естественно, что при боли любого генеза традиционно используют анальгезирующие препараты разных групп, в т. ч. наркотические и ненаркотические (трамадол, нестероидные противовоспалительные средства, парацетамол, метамизол натрия и др.). Но, если при болевом синдроме неабдоминального происхождения применение анальгетиков полностью оправданно, при ХАБ их назначение имеет серьезные ограничения и противопоказания. С одной стороны, быстрое купирование боли безусловно является позитивным моментом и способствует улучшению самочувствия больного. С другой стороны, применение анальгетиков при ХАБ часто не оправданно, т. к. назначается врачом только с позиции интенсивности боли без учета механизмов ее возникновения, а часто и без понимания механизма действия лекарственных препаратов. Часто назначение анальгетиков маскирует истинные причины ХАБ, подменяя базисное лечение основного заболевания, вызывающего боль, что способствует его прогрессированию. Кроме того, в ряде случаев необоснованное или неконтролируемое применение анальгетиков ведет к полипрагмазии, лекарственным взаимодействиям и осложняет течение заболевания.
Для успешного воздействия на ХАБ необходимо оценивать болевой синдром с разных позиций. С нашей точки зрения, должны учитываться не только топография, интенсивность боли и другие ее характеристики, но и доминирующий механизм (или механизмы) ее формирования. Абдоминальная боль может быть острой, что свидетельствует скорее всего о катастрофе в брюшной полости. ХАБ может быть органической (воспаление, деструкция) и/или функциональной. В случае органического заболевания при правильно построенной эффективной патогенетической терапии боль купируется в результате базисного лечения и необходимость дополнительного назначения анальгезирующих средств, как правило, не возникает (язвенная болезнь, гастроэзофагеальная рефлюксная болезнь, хронический панкреатит, хронический холецистит, болезнь Крона). Однако рассмотрение ХАБ, обусловленной органическими гастроэнтерологическими заболеваниями, так же как и проблемы острой абдоминальной боли, не входит в задачу настоящей статьи.
С нашей точки зрения, наибольшую сложность для врача представляет трактовка ХАБ функционального характера, т. е. боли, вызванной не органическими, а функциональными расстройствами (ФР) пищеварительной системы. Трудность в этих случаях заключается в том, что при обследовании не обнаруживается видимый органический или морфологический субстрат, вызывающий боль. Это определяет неправильную тактику ведения больных: в лучшем случае их направляют к психотерапевту, в худшем они вообще остаются за пределами внимания врача. Именно этим больным чаще всего необоснованно назначают анальгетики, руководствуясь пониманием боли только как симптома – без учета ее механизмов.
ФР принято называть симптомокомплексы со стороны различных органов пищеварительной системы, возникновение которых нельзя объяснить органическими причинами – воспалением, деструкцией и др. [1]. ФР широко распространены, особенно в промышленно развитых странах. Этими заболеваниями страдают предположительно 20–30 % населения земного шара. Среди больных, обращающихся в гастроэнтерологические кабинеты, от 30 до 50 % имеют симптомы различных ФР [2–4]. В настоящее время ключом к пониманию и трактовке этой патологии является третий пересмотр положений о функциональных гастроинтестинальных расстройствах – Римские критерии III, которые указывают на следующие возможные причины и механизмы ФР: психосоциальные факторы, нарушения центральной, периферической и гуморальной регуляции основных функций желудочно-кишечного тракта (ЖКТ), нарушения моторики и висцеральная гиперчувствительность (гипералгезия) органов пищеварения, воспаление.
Ниже приведена классификация гастроинтестинальных ФР.
Функциональные гастроинтестинальные расстройства (Римские критерии III):
А. Пищеводные расстройства:
А1. Комок в горле.
А2. Регургитация, срыгивание.
А3. Функциональная боль за грудиной преимущественно пищеводного генеза.
А4. Функциональное жжение за грудиной.
А5. Функциональная дисфагия.
А6. Неспецифические (неопределенные) пищеводные дисфункции.
В. Гастродуоденальные расстройства (функциональная диспепсия, аэрофагия, функциональная тошнота и рвота, постпрандиальный дистресс синдром, эпигастральный болевой синдром).
C. Кишечные расстройства:
C1. Синдром раздраженного кишечника (СРК).
C2. Функциональное вздутие живота.
C3. Функциональный запор.
C4. Функциональная диарея.
C5. Неспецифические (неопределенные) функциональные расстройства кишечника.
D. Функциональная абдоминальная боль:
D1. Синдром функциональной абдоминальной боли.
D2. Неспецифическая (неопределенная) абдоминальная боль.
Е. Билиарные расстройства:
Е1. Дисфункция желчного пузыря.
Е2. Дисфункция сфинктера Одди (билиарная, панкреатическая).
F. Аноректальные расстройства.
G. Функциональные расстройства у детей.
Патогенез ФР обычно обусловлен нарушением взаимодействий между больным органом-мишенью и регуляторными системами, т. к. любой висцеральный орган и весь ЖКТ в целом находятся под контролем многочисленных регулирующих влияний (рис. 1) [4–6]. Функциональная патология вызвана нарушением координации на любом из указанных на рис. 1 уровней и всей системы в целом. Взаимозависимость центральных и всех периферических (симпатическая, парасимпатическая и энтеральная системы) влияний приводит не только к непосредственному нарушению функций ЖКТ, но и к различным нейропсихическим отклонениям.
В конечном итоге в основе всех ФР лежат нарушения моторной функции пищеварительной системы, обусловленные несостоятельностью регуляторных взаимоотношений на оси мозг–ЖКТ. В патологических взаимодействиях немаловажную роль играет нарушение баланса нейротрансмиттеров и регуляторных пептидов (ацетилхолин, субстанция Р, холецистокинин, мотилин, серотонин, нейротензин, норадреналин, энкефалины и эндорфины, вазоактивный интестинальный пептид, оксид азота), контролирующих основные кишечные функции [6].
Большая часть ФР из приведенного выше перечня сопровождается ХАБ соответствующей локализации. Самым распространенным и наиболее изученным среди ФР является синдром раздраженного кишечника (СРК). В соответствии с Римскими критериями СРК определяется как рецидивирующая абдоминальная боль (или дискомфорт), уменьшающаяся после дефекации и ассоциированная с изменением частоты и формы стула, возникающая с частотой хотя бы 3 раза в месяц в течение последних 3 месяцев. В зависимости от интенсивности основных симптомов или их комбинации выделяют четыре клинических варианта СРК:
• с преобладанием запоров;
• с преобладанием диареи;
• смешанный вариант (наличие запора и диареи в сравнимых пропорциях);
• неопределенный вариант.
При любом из вариантов СРК ведущим симптомом является боль в животе (или ее эквивалент – абдоминальный дискомфорт). В основе болевого синдрома и кишечной дисфункции лежат моторные и сенсорные нарушения, обусловленные, как было сказано выше, рассогласованием ведущих регуляторных механизмов. Моторные нарушения при СРК в большинстве случаев носят гиперкинетический характер, приводят к спазму гладких мышц и нарушению пассажа содержимого по кишечнику (СРК с запорами; рис. 2). В других случаях возникает усиление пропульсии и ускорение пассажа, что сопровождается не только болью, но и диареей (СРК с диареей). Двигательные нарушения со стороны кишечника могут иметь смешанный тип, т. е. при СРК отмечается дискоординация тонического и пропульсивного компонентов моторики с периодическим усилением или ослаблением каждого из них [4].
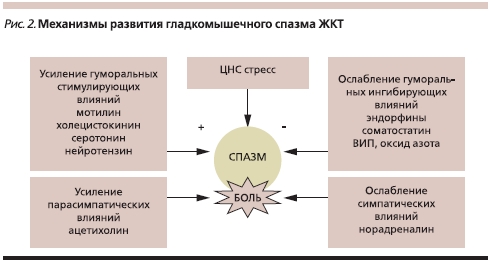
Для ФР, прежде всего для СРК с синдромом ХАБ, кроме моторных весьма типичны сенсорные нарушения, характеризующиеся висцеральной гиперчувствительностью (гипералгезией), т. е. изменением чувствительности рецепторного аппарата к различным раздражителям, что приводит к снижению болевого порога. В развитии гиперчувствительности участвуют те же механизмы, что и в нарушении моторики, причем в реализации болевых ощущений принимают участие как центральные, так и периферические болевые рецепторы. Полагают, что наибольшую роль в развитии гипералгезии играют серотонин и серотониновые рецепторы разных типов, холецистокинин и лиганды опиатных рецепторов (энкефалины и эндорфины) [7–9].
Абдоминальная боль без нарушения кишечных функций также выделяется в отдельную категорию и встречается как самостоятельный синдром приблизительно в 2–5 % случаев (пункт D классификации) [1]. Существенная роль среди причин ХАБ принадлежит билиарным дисфункциям со стороны желчного пузыря или сфинктера Одди (пункт Е классификации) [3]. Нарушения моторной функции желчного пузыря могут протекать по типу гиперкинетических расстройств, но чаще имеет место его гипокинезия. В основе ФР сфинктера Одди лежат спастические сокращения гладкой мускулатуры сфинктерного аппарата. В соответствии с Римскими критериями III выделяют билиарные и панкреатические расстройства сфинктера Одди.
Нарушения моторики при разных ФР также могут протекать по типу гипотонии и атонии. В этих случаях боль обусловлена не спастическим компонентом, а растяжением стенок полого органа с повышением внутрипросветного давления (гипотония желчного пузыря, гастростаз, дуоденостаз). В ряде случаев изменения имеют смешанный характер. Двигательные нарушения со стороны ЖКТ часто сопутствуют органическим заболеваниям и вносят дополнительный вклад в основные механизмы ХАБ при них (например, дуоденоспазм при хроническом панкреатите, язвенной болезни, калькулезном холецистите). В таких случаях они не рассматриваются как самостоятельная патология и не выносятся в диагноз, но должны быть обязательно учтены при назначении лечения.
Лечение ФР, в частности купирование ХАБ при ФР, представляет значительные трудности из-за смешанных механизмов этих нарушений. Лечение должно быть комплексным, направленным на ликвидацию взаимозависимых центральных и висцеральных вредных воздействий, нормализацию моторной и сенсорной функций (рис. 3).
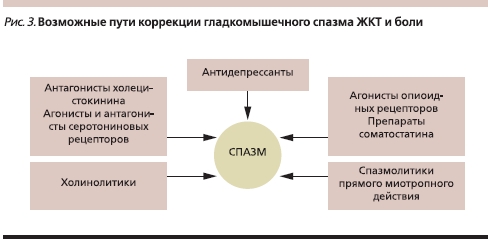
Поскольку гладкомышечный спазм является одной из основных составляющих боли, для снижения сократительной активности гладкой мускулатуры, устранения спазма и восстановления нормального транзита применяют релаксанты гладкой мускулатуры ЖКТ [10, 11]. На настоящий момент препаратом выбора снятия спазма и купирования боли при ФР остаются спазмолитики. Сократительная активность гладких мышц в норме происходит поэтапно. Первый этап инициируется парасимпатической нервной системой и стимуляцией ацетилхолином М-холинорецепторов на клеточной мембране миоцита, вследствие чего открываются натриевые каналы, ионы натрия проникают в клетку и вызывают деполяризацию клеточной мембраны. Изменение мембранного потенциала в свою очередь сопровождается открытием кальциевых каналов и поступлением ионов кальция в миоцит. Процесс мышечных сокращений на конечном этапе зависит от концентрации в клетке ионов кальция, которые участвуют в образования актин-миозинового комплекса. В основном спазмолитики воздействуют на конечный этап формирования гиперкинезии на клеточном уровне независимо от ее локализации, причины и механизма. При этом существует несколько групп спазмолитиков, различающихся по механизму действия: блокирующие холинорецептор, блокирующие натриевые каналы, блокирующие кальциевые каналы и блокаторы фосфодиэстеразы-4 (ФДЭ-4), ингибирующие поступление кальция в цитоплазму миоцита из внутриклеточных депо. В табл. 1 представлены спазмолитики, широко используемые в России. Кроме спазмолитиков для купирования боли используются тримебутин, масло мяты перечной и ряд других, не имеющих хождения на российском рынке препаратов.
Проведенный мета-анализ показал, что, например, при СРК все спазмолитики характеризуются достаточно высокой эффективностью и сравнимой частотой побочных эффектов [11]. Однако каждый из этих препаратов имеет свои особенности и преимущества, позволяющие предпочитать тот или иной из них в разных клинических ситуациях.
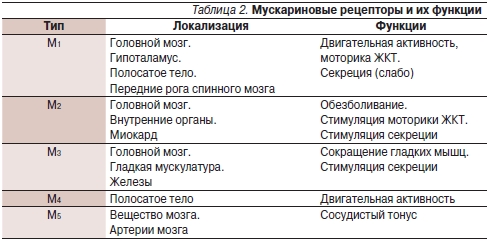
Как было сказано выше, М-холинорецептор является первой структурой, на которую нужно воздействовать, чтобы заблокировать поступление Са2+ в клетку и препятствовать соединению актина и миозина, т. е. вызвать релаксацию гладкой мышцы. Широкая распространенность М-холинорецепторов в организме, в т. ч. в ЖКТ, обеспечивает теоретическое обоснование для применения холинолитиков при ХАБ, вызванной спазмом гладкой мускулатуры. Однако холинолитики группы атропина и пирензепина при хорошей эффективности обладают системным действием и оказывают большое количество хорошо известных побочных эффектов на различные органы и системы, что особенно сильно проявляется при курсовом приеме. Это не позволяет применять их для систематического лечения, в котором нуждаются больные ФР.
В настоящее время идентифицировано пять типов мускариновых рецепторов (табл. 2) [12]. С учетом высокой концентрации М3-холинорецепторов на мембранах гладкомышечных клеток и железистого аппарата ЖКТ можно ожидать, что М3-холиноблокаторы (гиосцина бутилбромид) будут обладать выраженным действием в отношении болевого синдрома [13]. Благодаря этому препарат Бускопан оказывает спазмолитическое действие на гладкую мускулатуру внутренних органов и может снижать секрецию пищеварительных желез.
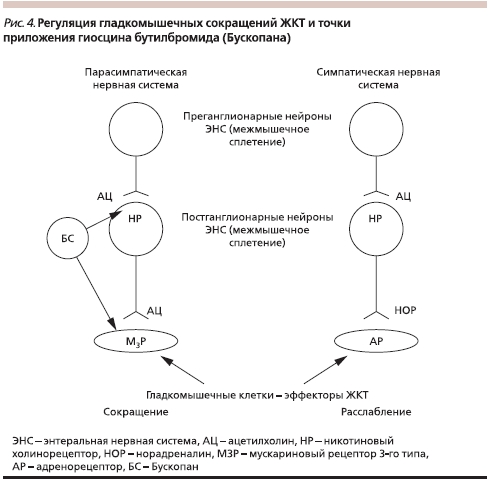
Действие Бускопана опосредуется в основном М3-холинорецепторами, причем он является препаратом направленного действия, тропным к гладкой мускулатуре внутренних органов – ЖКТ, желчевыводящих и мочевыводящих путей. Это значит, что, влияя на все органы, содержащие М3-рецепторы, Бускопан обладает наибольшим сродством к рецепторам, находящимся в активном состоянии, т. е. (в контексте данной темы) в зоне развития спазма. Благодаря направленности действия препарат имеет минимум атропиноподобных побочных эффектов (сухость во рту, тахикардия, спазм аккомодации и мидриаз). В минимальной степени Бускопан влияет на М2-холинорецепторы [14]. Кроме того, он имеет сродство к Н-холинорецепторам (никотиновым) парасимпатических постганглионарных нейронов в межмышечном сплетении энтеральной нервной системы, за счет чего оказывает параллельный ганглиоблокирующий эффект, усиливающий спазмолитическое действие (рис.4) [14]. Будучи четвертичным аммониевым производным, гиосцина бутилбромид в отличие от других холинолитиков в терапевтических дозах не проникает через гематоэнцефалический барьер, поэтому антихолинэргическое влияние на ЦНС у этого препарата отсутствует. Это позволяет применять Бускопан для систематического лечения, а также для терапии “по требованию”.
Показанием к назначению Бускопана служит острый и хронический абдоминальный болевой синдром, вызванный спазмом на любом уровне:
• колики (желчная, кишечная, почечная);
• СРК (любой клинический вариант);
• билиарные дисфункции желчного пузыря и сфинктера Одди;
• пилороспазм, дуоденоспазм;
• хронический панкреатит;
• неязвенная диспепсия.
Многочисленные клинические исследования доказали высокую эффективность и безопасность препарата при ряде патологических состояний. Бускопан может применяться при СРК, функциональной абдоминальной боли и ФР со стороны желчного пузыря и сфинктера Одди, при подготовке к ретроградной панкреатохолангиографии, эндоскопическим исследованиям кишечника [15, 16]. Кроме того, его используют как дополнительное средство при лечении хронического калькулезного холецистита и болевой формы хронического панкреатита. Сравнительное экспериментальное исследование Бускопана и дротаверина показало, что первый из них более чем в 40 раз интенсивнее купирует гладкомышечный спазм, индуцированный ацетилхолином [17]. Сравнение указанных препаратов было проведено и в клиническом исследовании больных СРК, в котором Бускопан также имел значительные преимущества, причем было отмечено его позитивное влияние не только на интенсивность боли и моторную активность толстой кишки, но и на висцеральную гиперчувствительность [18]. В одном из основных исследований, включившем 1637 пациентов, проведено сравнение эффективности и переносимости Бускопана, парацетамола и их комбинации при рецидивирующей спастической абдоминальной боли [19, 20]. Оказалось, что монотерапия обоими препаратами одинаково эффективна и не уступает комбинированному лечению, при этом лучшая переносимость и отсутствие побочных эффектов были отмечены в группе, получавшей только Бускопан. Это исследование подтверждает, что Бускопан может использоваться в качестве препарата первой линии при лечении СРК. В 2009 г. был опубликован cистематический обзор с рекомендациями по использованию спазмолитиков при СРК (American College of Gastroenterology), в котором спазмолитики, в т. ч. гиосцина бутилбромид, рассматриваются как эффективные средства быстрого, кратковременного купирования боли.
Все спазмолитики при функциональной ХАБ применяются курсами по 3–4 недели [21]. Именно при такой продолжительности лечения не только купируется боль, но и обеспечивается восстановление нормального пассажа кишечного (или билиарного) содержимого. В дальнейшем спазмолитики могут использоваться “по требованию” или повторными курсами. Бускопан назначают по 10–20 мг 3 раза в день внутрь сроком от 4–5 дней до 4 недель (при условии отсутствия побочных эффектов) [21]. Наши собственные исследования показали, что при 2-недельном приеме Бускопана побочные эффекты развиваются не более чем у 14 % пациентов, причем лишь у единичных больных возникает необходимость в отмене препарата [21]. При острых эпизодах функциональной боли препарат может применяться разово или короткими курсами. Противопоказания – повышенная чувствительность к препарату, миастения, мегаколон. С осторожностью Бускопан следует применять при закрытоугольной глаукоме, атонии или парезе гладких мышц на любом уровне.
Таким образом, препарат Бускопан (гиосцина бутилбромид) с доказанным профилем эффективности и безопасности показан пациентам с функциональными гастроинтестинальными расстройствами, сопровождающимися спазмом гладких мышц, на которых он оказывает выраженное спазмолитическое действие на первом этапе сокращения мышечного волокна, купирует абдоминальную боль, снижает секрецию пищеварительных желез, не оказывает центрального антихолинергического действия и хорошо переносится при курсовом приеме.



