Основой современной терапии ювенильного ревматоидного артрита (ЮРА) является применение биологических препаратов, в первую очередь антагонистов фактора некроза опухоли α (ФНО-α). В настоящее время в мире официально разрешено 5 антагонистов ФНО-α – инфликсимаб, адалимумаб, этанерцепт, цертолизумаб и голимумаб., однако для детей одобрены к применению, в т. ч. и в России, только этанерсепт и адалимумаб. В отличие от химерного антитела инфликсимаб адалимумаб является гуманизированным генноинженерным моноклональным антителом к ФНО-α, полностью идентичным человеческому, что обеспечивает лучшую переносимость препарата.
В ряде многоцентровых рандомизированных исследований доказана эффективность адалимумаба для взрослых больных [1–7]. С учетом эффективности препарата в терапии РА адалимумаб активно внедряется в педиатрическую практику [8–14].
Целью настоящего исследования являлась оценка эффективности и безопасности лечения блокатором ФНО-α адалимумабом (ХумираR, Эбботт Лэбораториз Лимитед, Великобритания) больных различными вариантами ЮРА.
Материал и методы
Эффективность адалимумаба изучена у 30 детей с ЮРА. На момент начала исследования адалимумаб был зарегистрирован в России только для лечения полиартикулярной формы ЮРА у детей с 13 лет, в связи с чем назначение препарата пациентам с системной формой ЮРА или детям моложе 13 лет проводилось по принципу off label – после заключения консилиума, при наличии информированного согласия родителей, с разрешения независимого этического и формулярного комитетов.
Клинико-демографическая характеристика больных, включенных в исследование, представлена в таблице. Пациенты были разделены на группы по форме ЮРА: 13 (43,3 %) детей имели системную форму, 10 (33,3 %) – полиартикулярную и 7 (23,3 %) олигоартикулярную. Группа больных с системной формой ЮРА была разделена на подгруппы с ранним (длительность заболевания – менее 3 лет) и поздним артритом.
В момент назначения адалимумаба во всех группах пациентов течение заболевания характеризовалось активным суставным синдромом, проявлявшимся наличием болезненных, припухших суставов с нарушением их функций. Нарушение функционального статуса неизбежно приводило к снижению качества жизни детей в группах с системной и полиартикулярной формами ЮРА, что отражали показатели индекса CHAQ. Во всех группах имели место повышение уровней СОЭ и С-реактивного белка (СРБ), анемия, лейкоцитоз и тромбоцитоз, более выраженные в группах с системной и полиартикулярной формами ЮРА, что демонстрирует высокую лабораторную активность заболевания, особенно в подгруппе с ранним системным артритом. У 5 из 7 пациентов этой подгруппы имелись системные проявления в виде лихорадки, сыпи, кардита, лимфоаденопатии, гепатоспленомегалии, тогда как только в подгруппе с поздним системным артритом только у одного пациента отмечалась лихорадка. Отсутствие системных проявлений у части пациентов в момент назначения адалимумаба было обусловлено высокой дозой глюкокортикостероидов (ГКС). В группе с полиартикулярным вариантом ЮРА у 3 пациентов отмечались подъемы температуры тела до субфебрильных значений. У 6 из 7 детей с олигоартикулярной формой ЮРА наблюдался увеит.
Пациентам с ранним системным ЮРА адалимумаб назначался в связи с высокой активностью заболевания. В момент назначения препарата все больные получали ГКС в высокой дозе. Средняя дозировка ГКС составляла 0,73 ± 0,24 мг/кг/сут.
Все больные в подгруппе с поздним системным ЮРА имели стероидозависимое течение заболевания, длительно получали ГКС. Средняя дозировка ГКС была небольшой – 0,34 ± 0,06 мг/кг/сут, однако длительный прием этих препаратов привел к развитию выраженной задержки роста. Адалимумаб назначался данным пациентам не только для контроля активности заболевания, но и с целью отмены гормональной терапии. Двум детям в этой подгруппе адалимумаб назначался в связи с отменой инфликсимаба из-за развития анафилактических реакций на введение и ослабление эффекта последнего.
В группе пациентов с полиартикулярным вариантом ЮРА двумя больным адалимумаб назначался в связи с развитием анафилактических реакций на введение инфликсимаба. У двоих детей после отмены инфликсимаба возникло обострение заболевания, в связи с чем был назначен адалимумаб. Остальные пациенты в данной группе имели не только высокую активность заболевания, но и значительное нарушение функционального статуса, что в совокупности служило причиной начала применения адалимумаба.
У шести детей с олигоартикулярной формой ЮРА причиной назначения адалимумаба в первую очередь послужило наличие увеита. Пациенту с олигоартритом без увеита адалимумаб назначался в связи с неэффективностью предшествующей терапии метотрексатом (МТ).
Все пациенты получали лечение базисными противовоспалительными препаратами (БПВП) в виде монотерапии МТ или комбинации МТ и циклоспорина А или мофетила микофенолата. Адалимумаб вводился по стандартной схеме 1 раз в 2 недели подкожно в дозе 24 мг/м².
Всем больным перед назначением адалимумаба проводилось тщательное обследование на туберкулез. Оно включало туберкулиновый тест (реакция Манту) и рентгенографию грудной клетки. При сомнительном туберкулиновом тесте (гиперемия, папула более 5 мм) ребенок консультировался фтизиатром, проводился тест с разным разведением туберкулина. В случае исключения туберкулезной инфекции и разрешения фтизиатра больному начиналось лечение адалимумабом.
Эффективность терапии адалимумабом оценивалась по показателям клинических и лабораторных данных. Оценка этих параметров проводилась в момент начала исследования, перед каждым введением препарата и после него. Клиническое обследование включало физикальный осмотр и оценку суставного синдрома: количество припухших суставов, количество болезненных суставов, количество суставов с нарушением функций, наличие утренней скованности. Лабораторные показатели активности заболевания включали уровень СРБ, СОЭ, показатели общего анализа крови (количество лейкоцитов, тромбоцитов, уровень гемоглобина). Индивидуальная эффективность терапии адалимумабом оценивалась по критериям ACRpedi. Оценка проводилась после 1-го введения 1-го месяца наблюдения и далее каждые 3 месяца.
Результаты
У всех пациентов уже после первого введения адалимумаба отмечался положительный эффект в виде снижения активности суставного синдрома, лабораторных показателей активности, повышения функциональной активности. Достоверное снижение показателей активности ЮРА отмечалось в течение 12 месяцев наблюдения во всех группах.
В подгруппе с ранним системным артритом к концу первого месяца наблюдения по социальным причинам выбыло 2 пациента. Как следует из рис. 1, к 12 месяцу наблюдения все оставшихся 5 пациентов достигли ремиссии (отсутствие утреней скованности, утомляемости, слабости, болей в суставах, болезненности суставов при пальпации и движении, припухлости мягких тканей в области суставов и сухожилий, нормальные показатели (СОЭ).
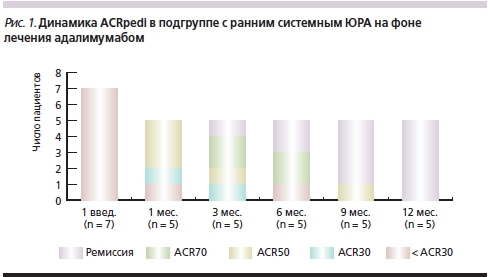
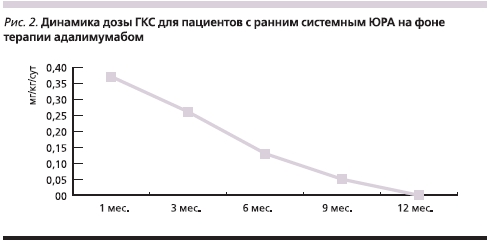
Всем детям с ранним системным артритом после первого же введения адалимумаба было начато снижение дозы ГКС, которая прогрессивно уменьшалась в течение всего периода наблюдения (рис. 2). К 12-му месяцу лечения благодаря применению адалимумаба преднизолон был отменен всем пациентам этой подгруппы.
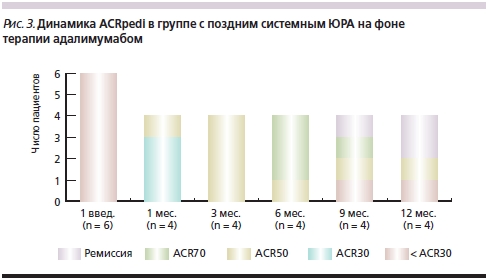
В подгруппе с поздним системным ЮРА к концу первого месяца наблюдения по социальным причинам также выбыли два пациента. У 2 пациентов к 12-му месяцу наблюдения была достигнута ремиссия. У одной больной в течение всего периода наблюдения показатели ACRpedi сохранялись в пределах 50 % (рис. 3). У этих 3 детей преднизолон к 12-му месяцу наблюдения был отменен. У 1 ребенка к 6-му месяцу наблюдения достигнуто 70 %-ное улучшение, однако на фоне снижения дозы ГКС было отмечено нарастание активности заболевания к 9-му месяцу, несмотря на лечение адалимумабом.
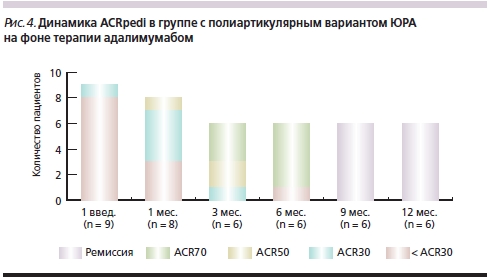
В группе с полиартикулярной формой артрита после первого введения препарата по социальным причинам выбыл 1 ребенок, к 3-му месяцу наблюдения – еще 2 пациента. Один ребенок не имел активности заболевания в момент назначения адалимумаба, т. к. получал лечение инфликсимабом. В течение всего периода наблюдения на фоне терапии адалимумабом у него не было зарегистрировано роста активности ЮРА, в связи с чем индивидуальная оценка эффективности этого препарата по критериям ACRpedi у этого пациента не проводилась.
Как следует из рис. 4, после 2-го введения препарата более половины пациентов ответили на терапию, при этом 30 %-ное улучшение было зафиксировано у 4 (50 %) детей, 50 %-ное – у одного (12,5 %) ребенка. К 3-му месяцу наблюдения у всех пациентов было отмечено улучшение по критериям ACRpedi: 70 % – у половины больных, 50 % – у 2 (33,3 %) детей и 30 % – у одного (16,7 %) ребенка. Через 6 месяцев лечения 70 %-ное улучшение было отмечено у большинства (83,3 %) детей и лишь у одного ребенка не было зафиксировано ответа на терапию. К 9-му и 12-му месяцам наблюдения ремиссия была зарегистрирована у всех пациентов (рис. 4).
На момент назначения адалимумаба ни один пациент с полиартикулярной формой ЮРА не получал ГКС ни внутрь, ни в виде внутрисуставных инъекций. За 12 месяцев наблюдения ни один больной этой группы не нуждался во внутрисуставном введении ГКС.
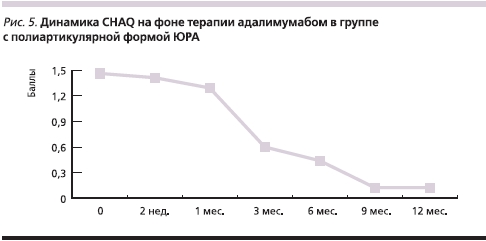
Исходно наиболее выраженные нарушения функционального статуса имели пациенты с полиартикулярным вариантом ЮРА, что неизбежно отражалось на качестве их жизни. В течение всего периода наблюдения на фоне терапии адалимумабом было зарегистрировано прогрессивное улучшение показателей качества жизни (рис. 5).
В группе с олигоартикулярной формой ЮРА купировать проявления суставного синдрома удалось к 3-му месяцу наблюдения. Обострений суставного синдрома за 12 месяцев наблюдения отмечено не было. В отношении увеита ремиссия была достигнута к 1-му месяцу терапии у всех пациентов и сохранялась в течение 12 месяцев наблюдения. Одному ребенку пришлось отменить адалимумаб на 12-м месяце лечения в связи с развитием дерматита и алопеции. У одного больного на этом сроке было зарегистрировано обострение увеита, купировавшееся после очередного введения адалимумаба.
Из всех детей, получавших адалимумаб, только у одной пациентки было отмечено развитие побочных реакций (дерматит и алопеция). У остальных больных каких-либо побочных реакций не отмечалось.
Заключение
Полученные нами результаты подтверждают эффективность и безопасность адалимумаба в терапии различных форм ЮРА. По нашему мнению, раннее назначение адалимумаба позволяет достигнуть лучшего контроля над активностью заболевания, избежать осложнений ГКС-терапии и формирования стероидозависимости.



