На сегодняшний день инсульт, являющийся ведущей причиной инвалидизации населения, стал не только медицинской, но и социальной проблемой общества. Постинсультная инвалидизация достигает 92 %, из которых до 76 % приходится на долю инвалидности тяжелой степени [5, 7, 8, 15]. В Российской Федерации ежегодно тратится 304 млрд руб. на прямую социальную поддержку граждан, ставших инвалидами после перенесенного церебрального инсульта, а также из-за невозможности активной трудовой деятельности родственников, вынужденных ухаживать за близким человеком, перенесшим нарушение мозгового кровообращения. Именно в связи с этим поиск новых методов эффективной терапии острого инсульта на протяжении многих лет не теряет своей актуальности.
В современной медицинской практике единственным критерием, позволяющим аргументировать назначение тех или иных препаратов, становятся данные клинических исследований, выполненных по технологии GCP – Good Clinical Practice [15]. На сегодняшний день рациональное лечение, эффективность которого подтверждена в ходе таких исследований, включает проведение тромболизиса и антиагрегантной терапии [5–10]. Наиболее перспективным направлением, активно разрабатывающимся в последние годы отечественными исследователями, является нейроцитопротекция – система мероприятий, повышающих резистентность организма к экстремальному воздействию [1, 5, 6]. Ишемическое повреждение ткани мозга при инсульте прежде всего нарушает реакции промежуточного обмена веществ [2, 5, 11, 12]. Возникающий дефицит энергии блокирует транспортные системы мембран клеток, ведет к возникновению лигандрецепторного (медиаторного) дисбаланса, повреждающего сигнальные и транспортные медиаторные системы клеток, что блокирует функционирование одних медиаторных систем и стимулирует лавинообразную работу других. Медиаторный дисбаланс, который при ишемии сопровождается усилением активности глутаматергических систем, вызывает одновременный дефицит холинореактивных систем, которые эволюционно ограждают нейроны головного мозга от избыточных катехоламиновых воздействий и поддерживают функционирование нейрональных популяций [13, 14]. На системном уровне холинотропные средства способны увеличивать парциальное давление кислорода в артериальной крови (рО2арт), усиливают перистальтику кишечника и не вызывают артериальной гипертензии, тахикардии [5].
Среди средств холинотропного ряда наиболее фармакологически эффективными считаются препараты, точка приложения которых локализована на пресинаптическом уровне или на уровне холинэстераз [3, 4]. Этим требованиям отвечает препарат Церепро (холина альфосцерат) – предшественник синтеза ацетилхолина и донатор медиатора одновременно.
Целью настоящего исследования явилась оценка эффективности и безопасности применения препарата Церепро больными каротидным ишемическим инсультом в остром периоде заболевания.
Материал и методы
В 2008–2010 гг. проводилось многоцентровое двойное слепое рандомизированное плацебо-контролируемое клиническое исследование по определению эффективности и безопасности применения препарата Церепро® (в виде раствора для внутривенного и внутримышечного введения 250 мг/мл) больными ишемическим каротидным инсультом в остром периоде (IV фазе). Исследование проведено на базе пяти исследовательских центров: ГКБ № 15 им. О.М. Филатова, Москва; ГКБ № 20, Москва; МУЗ “Городская клиническая больница № 3”, Челябинск; ГУЗ “Белгородская областная клиническая больница Святителя Иоасафа”, Белгород; МУ “Больница скорой медицинской помощи”, Уфа.
Больные были отобраны в соответствии с критериями включения и исключения. В исследование включали мужчин и женщин в возрасте 45–75 лет с впервые возникшим ишемическим инсультом в каротидном бассейне, верифицированном с помощью компьютерной или магнитно-резонансной томографии головного мозга, в остром периоде заболевания (в первые 48 часов) с тяжестью неврологического дефицита по шкале NIHSS (National Institutes of Health Stroke Scale) ≥ 10 ≤ 20 баллов, при наличии письменного информированного согласия на проведение исследования.
Критерии исключения:
- геморрагический характер инсульта;
- острое нарушение мозгового кровообращения в анамнезе;
- давность инсульта более 48 часов;
- тяжесть неврологического дефицита по шкале NIHSS ≤ 10 или более 20 баллов;
- глубокая степень двигательного дефицита (гемиплегия);
- тотальная афазия;
- индивидуальная непереносимость препарата Церепро® или его компонентов;
- лечение испытуемым препаратом в течение 3 месяцев до включения в исследование;
- неспособность или нежелание следовать протоколу исследования, отказ от участия на любом этапе;
- участие в другом клиническом исследовании;
- наличие других (не сосудистых) заболеваний нервной системы в стадии декомпенсации, эпилепсия;
- тяжелые, декомпенсированные, нестабильные соматические заболевания (тяжелые формы ишемической болезни сердца, острый инфаркт миокарда, легочная, почечная или печеночная недостаточность, активный туберкулез);
- терминальные состояния;
- острая психотическая продуктивная симптоматика (психоз, галлюцинация, бред);
- хронический алкоголизм;
- онкологические заболевания и иммунодефицитное состояние;
- ВИЧ-инфекция;
- сопутствующая медикаментозная терапия, прием которой может отразиться на истолковании результатов исследования;
- прием ноотропных и метаболических препаратов;
- прием психотропных препаратов (антидепрессантов, нейролептиков, транквилизаторов) в нестабильной дозе в течение 30 дней.
В соответствии с критериями включения и в отсутствие критериев исключения в исследование были включены 106 пациентов, из них: 50 (47,2 %) – женщины и 56 (52,8 %) – мужчины. Средний возраст больных составил 61,17 ± 8,12 года. Из них закончили исследование по протоколу и вошли в статистический анализ 103 человека. Трое выбыли из исследования: один пациент отказался от участия в исследовании, двое нарушили требования протокола.
Все пациенты поступали в неврологические или реанимационные отделения в сроки до 48 часов от начала заболевания, наблюдались в клиниках в течение 21–25 дней и получали максимально унифицированную стандартную терапию, включавшую коррекцию артериального давления (АД), нормоволемическую гемодилюцию, ингаляции кислорода, антиагреганты или антикоагулянты.
Методом простой рандомизации больные были распределены в две группы: I (основную) группу составили 52 больных, получавших препарат Церепро в дозе 2000 мг внутривенно с 1-х по 10-е сутки, 1000 мг внутримышечно с 11-х по 20-е сутки в сочетании с базисной стандартной терапией. Во II группу (сравнения) вошел 51 больной, получавший плацебо-препарат в ампулах аналогичной расфасовки.
Общая длительность исследования составила 20 дней. При поступлении проводился скрининг больных, за время пребывания в стационаре было осуществлено 3 визита.
Оценка состояния пациентов проводилась на 1-е, 10-е и 20-е сутки с определением АД, числа сердечных сокращений (ЧСС), числа дыхательных движений (ЧДД), неврологического статуса по шкале NIH-NIHSS, функционального исхода заболевания по индексу социальной адаптации Бартела и модифицированной шкале Ренкина.
Статистическая обработка данных проведена с использованием программного обеспечения SPSS 17.0. Проводился многофакторный анализ с вращением Viramax. Значимая достоверность принималась при р < 0,05.
Результаты и обсуждение
Завершившие исследование 103 пациента не нарушали режим приема препарата, пропущенных приемов не было, приверженность терапии оценивали как 100 %. Соблюдались интервалы между приемами препарата, дозирование и другие рекомендации, соответствующие протоколу. Все выжившие пациенты полностью прошли запланированный курс приема препарата Церепро® или плацеботерапии.
Распределение больных на этапе скрининга по возрасту, тяжести клинической симптоматики говорит о репрезентативности исследования (табл. 1).
Таблица 1. Распределение больных по возрасту, сопутствующей патологии, соматическим и лабораторным показателям, тяжести состояния по шкалам NIHSS, Ренкина, Бартела.
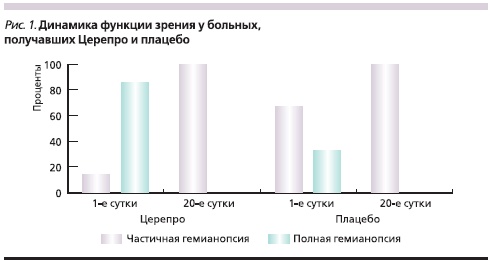
Среди больных с расстройствами зрения по типу гемианопсии, получавших Церепро, число пациентов с регрессом от полной до частичной гемианопсии достоверно увеличилось (р = 0,003) в отличие от группы плацебо (р = 0,068) (рис. 1). Так, в группе Церепро функция зрения к моменту выписки улучшилась у 85,7 % больных, изначально имевших полную гемианопсию, в группе плацебо подобное зарегистрировано лишь у 33,3 % пациентов.
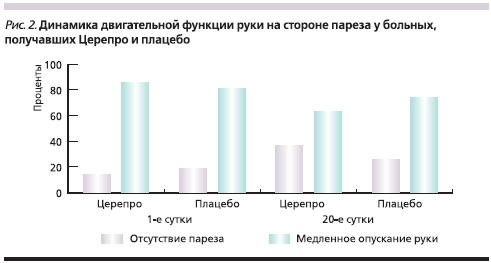
В группе Церепро в конечной точке исследования число пациентов с положительной динамикой двигательной активности (уменьшение пареза руки) увеличилось в 3,25 раз (р = 0,042) по сравнению с группой плацебо (р = 0,482), где число больных с нормализацией двигательной функции в конечностях увеличилось всего в 1,43 раза (рис. 2).
Атаксия в конечностях у пациентов, получавших Церепро, достоверно регрессировала (р = 0,011). К конечной точке исследования в данной группе пациентов число больных, не имевших атактических расстройств, увеличилось в 2,5 раза. В группе плацебо число пациентов с отсутствием атаксии в конечностях увеличилось всего в 1,17 раз (р = 0,140) (рис. 3). При анализе динамики речевых нарушений у пациентов, поступивших в исследование с афазией различной степени тяжести, выявлено выраженное позитивное влияние препарата Церепро на течение ишемического инсульта.

Так, в группе больных, принимавших Церепро, которые изначально имели более выраженные афатические нарушения по сравнению с пациентами группы плацебо (рис. 4), число пациентов с улучшением афазии до легко или умеренно выраженной достоверно (р = 0,020) увеличилось в 2 раза, при этом значимо (в 3 раза) снизилось число больных с тяжелой афазией. В группе плацебо число пациентов с улучшением до легко или умеренно выраженной афазии недостоверно увеличилось в 1,6 раза (р = 0,637), при этом в меньшей степени (в 2,25 раза) снизилось число больных с тяжелой афазией. Таким образом, оценка динамики состояния пациентов по шкале NIHSS показала достоверное позитивное влияние препарата Церепро на такие нарушения, как гемианопсия, парез руки, атаксия в конечностях и афазия.

Оценка динамики состояния пациентов по индексу Бартел показала, что по результатам факторного моделирования отмечается слабой силы связь между частотой применения Церепро и благоприятной динамикой контроля дефекации, мочеиспускания и пересаживания пациентов, отмеченное к 10-м суткам и к конечной точке исследования. В группе больных, получавших Церепро, наблюдался более выраженный сдвиг в сторону положительных изменений на 3-м визите, что оценивается как благоприятная динамика по индексу Бартел.
Проведенный анализ сопутствующей терапии выявил, что отрицательная динамика по шкале NIHSS сильно и прямо взаимосвязана с большей частотой применения анальгина, больших доз сернокислой магнезии, умеренно – эналаприла и не связана с применением Церепро. Это имеет большое значение для оценки эффективности комбинированной лекарственной терапии при лечении больных острым ишемическим каротидным инсультом. Аналогичная тенденция влияния различных видов терапии была выявлена и на уровень социальной адаптации, оцененной по индексу Бартел.
При динамическом наблюдении состояния параметров соматического статуса больных на фоне лечения получены данные о влиянии Церепро на снижение частоты эпизодов нарушения ритма (мерцательной аритмии), которую у больных этой группы удавалось уменьшать к 10-м суткам терапии (рис. 5). Протективное влияние Церепро на состояние сердечной деятельности, оцениваемое по параметру ЧСС, сохранялось до 20 суток острого инсульта. В группе пациентов, получавших плацебо-терапию, аналогичной динамики выявлено не было. При этом отмечена тенденция к более частым эпизодам тахикардии и более значимым колебаниям АД в период от 5-х до 20-х суток инсульта.

Полученные данные подтверждают концепцию о протективном влиянии Церепро на состояние вегетативной сферы пациентов с инсультом за счет нормализации дисбаланса холинергической иннервации сосудистой системы.
При анализе динамики лабораторных показателей, проводимых на этапе скрининга и на 20-е сутки исследования, выявлено, что в группе плацеботерапии имело место достоверное увеличение уровней тромбоцитов, СОЭ, АЛТ (p < 0,05) и снижение показателей гемоглобина, лимфоцитов, нейтрофилов и холестерина (р < 0,05). При этом среднее значение данных показателей к 20-м суткам было ниже нижней границы нормы по показателям СОЭ и лимфоцитов и выше верхней границы нормы – по уровню холестерина. В группе больных, получавших Церепро, достоверные изменения затронули только уровень гемоглобина в сторону его снижения (p < 0,05) в нормальных пределах (табл. 2). Летальные исходы имели место в двух (1,94 %) наблюдениях – по одному (1,89 %) в группе Церепро и группе плацебо (1,92 %) (р > 0,05) – и не были связаны с приемом препарата. Причинами летальных исходов явились: в одном наблюдении (в группе Церепро) – отек головного мозга в результате прогрессирования основного заболевания (ишемического инсульта), расширения зоны ишемии и присоединения полиорганной недостаточности, в другом – повторный инфаркт головного мозга на фоне пароксизма мерцательной аритмии, осложнившегося отеком мозга (в группе плацебо-терапии).
Таблица 2.Сравнительная динамика лабораторных показателей у больных двух групп.
Спектр выявленных побочных эффектов в обеих группах был однотипным (аллергическая реакция, обострение себорейного дерматита, гипергликемия, пневмония) и не отличался по частоте (указанные расстройства наблюдались менее чем у 1 % больных). Это наряду с динамикой скрининговых параметров крови говорит, о безопасности применения препарата Церепро.
Заключение
Проведенное многоцентровое двойное слепое рандомизированное плацебо-контролируемое клиническое исследование показало эффективность и безопасность применения препарата Церепро у больных ишемическим каротидным инсультом в остром периоде заболевания.
Эффективность препарата выражалась в более значимом (по сравнению с плацебо-терапией) позитивном влиянии на регресс таких неврологических расстройств, как гемианопсия, парез, атаксия и афазия; благоприятной динамике функционального исхода, оцениваемого по индексу Бартел, протективном влиянии на такие параметры соматического статуса, как артериальное давление и частота эпизодов тахиаритмии.
Полученные данные позволяют рекомендовать препарат Церепро в качестве нейропротектора в комплексной терапии острого каротидного ишемического инсульта в повседневной практике.
Информация об авторах:
Стаховская Людмила Витальевна – доктор медицинских наук, профессор кафедры
фундаментальной и клинической неврологии с курсом нейрохирургии РГМУ.
E-mail: nabirf@gmail.com;
Румянцева Софья Алексеевна – доктор медицинских наук, профессор кафедры неврологии ФУВ ГОУ ВПО РГМУ
E-mail: sofirum@yandex.ru;
Силина Екатерина Владимировна – кандидат медицинских наук, доцент кафедры патологии человека ГОУ ВПО«Первый МГМУ им. И.М. Сеченова» Минздравсоцразвития РФ.
Бельская Галина Николаевна – доктор медицинских наук, профессор, заведующая кафедрой неврологии,мануальной и рефлексотерапии ГОУ ДПО УГМАДО Росздрава, Челябинск.
E-mail: nervugmado@yandex.ru
Чефранова Жанна Юрьевна – доктор медицинских наук, профессор, руководитель регионального сосудистогоцентра ГУЗ «Белгородская областная клиническая больница Святителя Иоасафа».
E-mail: jannaokbbel@rambler.ru;
Новикова Лилия Бареевна – доктор медицинских наук, профессор, заведующая кафедрой неврологии и нейрохирургии Институтапоследипломного образования Башкирского государственного медицинского института. МУ БСМП № 22.
E-mail: novicova@inbox.ru;
Попов Дмитрий Валентинович – кандидат медицинских наук, заведующий неврологическим отделением для больныхс нарушениями мозгового кровообращениями МУЗ “Городская Клиническая Больница № 3”.
E-mail: dmitry_popov2001@mail.ru



