По данным крупного эпидемиологического исследования, проведенного в 7 городах Российской Федерации, боли в спине (дорсалгии) широко распространены среди населения. На первичном приеме доля пациентов с болями пояснично-крестцовой локализации составляет 23 % [10]. При развитии боли в спине трудоспособность снижается у 50 % пациентов, что ведет к значимым экономическим потерям как для самого больного, так и для общества в целом [6]. У 20 % пациентов боли в спине длятся больше месяца и приобретают хронический характер [7, 13]. Об актуальности и значимости болевых синдромов, в т. ч. локализованных в нижней части спины, как неврологической, так и общемедицинской проблемы говорит тот факт, что 2000–2010 гг. были объявлены ВОЗ Декадой патологии суставов и костей.
В основе развития болей в спине лежат различные причины, которые условно разделяют на вертеброгенные и невертеброгенные. К вертеброгенным причинам дорсалгии относятся протрузия межпозвонкового диска, остеофиты, нестабильность позвоночно-двигательного сегмента, подвывихи, артрозы, переломы позвонков, остеопороз, остеоартроз, опухоли позвонков. Болевой синдром невертеброгенного генеза является более распространенным состоянием и включает миофасциальные болевые синдромы, отраженную боль при заболеваниях внутренних органов, психогенные боли, боли при спинальных опухолях и др. [12, 14, 15].
С широкой распространенностью болевых синдромов в нижней части спины связан рост потребности в эффективных обезболивающих средствах. По данным анализа фармацевтического рынка, самыми популярными препаратами, которые приобретают более 58 % населения, являются безрецептурные анальгетики, при этом 17,3 % больных принимают анальгетики по поводу боли в спине [13]. Проведенные многочисленные рандомизированные контролируемые исследования убедительно доказывают, что нестероидные противовоспалительные средства (НПВС) являются эффективными препаратами лечения хронических болей в спине. Мета-анализ 65 контролируемых исследований показал, что НПВС, в частности селективные ингибиторы циклооксигеназы-2 (ЦОГ-2), достоверно эффективны как при острой боли в спине, так и при обострении хронической боли без корешкового синдрома [26, 34, 40]. Достоверных различий между эффективностью наиболее часто используемых НПВС и ингибиторов ЦОГ-2 не отмечено.
В клинических рекомендациях по диагностике, лечению и предупреждению неспецифической боли в нижней части спины, составленных Ассоциацией ревматологов России и Российским межрегиональным обществом по изучению боли, традиционные НПВС и ингибиторы ЦОГ-2 представлены как препараты первой линии при хронической неспецифической боли в спине, при этом обращается внимание на высокую частоту побочных эффектов при длительном использовании этих средств [6]. Таким образом, при выборе препаратов большую роль играет их безопасность. Ингибиторы ЦОГ-2 по сравнению с традиционными НПВС более безопасны в отношении желудочно-кишечного тракта, хотя в отдельных исследованиях имеются данные о негативном влиянии этих средств на сердечно-сосудистую систему [9, 40]. С целью повышения безопасности терапии при выборе препарата применяют ступенчатый подход к подбору лекарственного средства: от высокой дозы более слабого препарата к низкой дозе более сильного средства [6].
Основным недостатком традиционных НПВС является ограничение длительности приема, что обусловлено развитием побочных эффектов, прежде всего со стороны желудочно-кишечного тракта. У 2–4 % лиц имеется непереносимость НПВС [24, 41]. Наличие у НПВС побочных эффектов во многом определяет активное использование пациентами с хронической дорсалгией дополнительных и альтернативных методов лечения. В исследовании, в которое были включены более 23 тыс. пациентов с различной неврологической патологией, показано, что более 50 % пациентов с хронической болью в спине регулярно используют дополнительные и альтернативные методы терапии [47]. При этом ведущей причиной использования этих методов лечения является неэффективность или непереносимость традиционной фармакотерапии. По данным проведенного исследования, приверженность пациентов с хроническими болями в спине альтернативным и дополнительным методам лечения чрезвычайно высока [28]. Альтернативой применению НПВС у пациентов с хронической болью в спине может быть использование препаратов растительного происхождения с обезболивающим и противовоспалительным действиями [4]. Целью настоящего исследования было изучение эффективности и безопасности НПВС растительного происхождения Зинаксина.
Материал и методы
В исследование вошли 20 пациентов (7 мужчин и 13 женщин) с обострением хронического болевого синдрома пояснично-крестцовой локализации, обусловленным скелетно-мышечными расстройствами с длительностью болевого синдрома не менее трех месяцев.
Критерии включения:
- возраст пациента от 18 до 65 лет;
- длительность боли в спине более 12 недель;
- интенсивность боли по визуально-аналоговой шкале (ВАШ) 4 и более баллов.
В исследование не были включены пациенты с наличием (в т. ч. в анамнезе) аллергических реакций на экстракты имбиря; язвенной болезни желудка или двенадцатиперстной кишки, а также больные, принимающие антиконвульсанты, антидепрессанты, анксиолитики. Все пациенты получали базовую терапию (миорелаксанты, лечебная физкультура, массаж), начатую не менее чем за месяц до начала исследования, а также Зинаксин в дозе 510 мг/сут (2 капсулы в сутки) в течение 3 месяцев.
В случае развития интенсивной боли пациенты могли принимать традиционные НПВС (диклофенак). Применяли следующие методы обследования: сбор анамнеза и жалоб, общесоматический и неврологический осмотры. Проводили оценку интенсивности боли в спине по шкале ВАШ до начала лечения Зинаксином, а также через 1, 2 и 3 месяца его приема. Миогенный болевой синдром оценивали с помощью опросника Хабирова. Для оценки качества жизни пациентов использовали опросник Освестри, для выявления эмоционально-аффективных расстройств – шкалу Бека (оценка уровня депрессии) и шкалу Спилебергера (оценка уровня реактивной и личностной тревоги). Субъективная оценка эффективности препарата осуществлялась пациентом по 4-балльной шкале (“отлично”, “хорошо”, “удовлетворительно”, “плохо”). Безопасность препарата исследования оценивали по следующим показателям: доля пациентов с развитием побочных эффектов на фоне приема исследуемого препарата; субъективная оценка безопасности препарата пациентом по 4-балльной шкале (“отлично”, “хорошо”, “удовлетворительно”, “плохо”).
Результаты
Средний возраст пациентов составил 42,6 ± 10,2 года, продолжительность заболевания – 6,2 ± 4,8 года. Обострение в среднем длилось 3,6 ± 2,4 недели. У всех пациентов выявлен мышечно-тонический синдром в мышце, выпрямляющей позвоночник (100 %), квадратной мышце поясницы (85 %), многораздельных мышцах и мышцах – вращателях поясницы (65 %). У 70 % пациентов развитию обострения предшествовала необычная динамическая или статическая физическая нагрузка (начало занятий спортом, непривычная физическая работа, долгое, повторяющееся пребывание в одной позе, например при работе за компьютером). Интенсивность боли составляла 5,4 ± 1,6 балла по ВАШ. На фоне приема Зинаксина интенсивность боли достоверно снижалась в течение первого месяца (рис. 1) и продолжала регрессировать после второго и третьего месяцев приема. Эффективность препарата отметили 85 % пациентов: значимое улучшение после проведенной терапии – 60 %, умеренный эффект – 25 %, у 15 % пациентов положительного эффекта не отмечено.
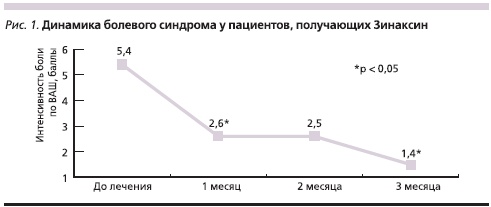
На фоне проведенной терапии также происходило объективное ослабление миогенного болевого синдрома, что выявлялось как клинически, так и при помощи опросника Хабирова. Так, если до начала терапии выраженность миогенного болевого синдрома составляла 10,6 ± 1,3 балла, то после курса терапии происходило достоверное его снижение до 5,4 ± 0,9 балла (р < 0,05).
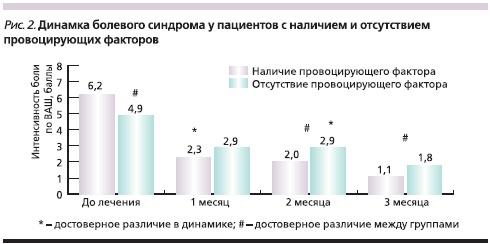
Пациенты исследуемой группы характеризовались низким уровнем депрессии (11,9 ± 4,6 балла), умеренной реактивной (44,6 ± 10,5 балла) и личностной (39,8 ± 9,3 балла) тревогой. Терапия Зинаксином не оказывала значимого влияния на уровень тревоги и депрессии в исследуемой группе пациентов: уровень депрессии уменьшился до 9,5 ± 4,3 балла, уровень реактивной тревоги – до 38,7 ± 9,5, уровень личностной тревоги – до 38,1 ± 8,7 балла. Необходимо отметить, что наличие у пациентов значимых эмоционально-аффективных расстройств, по-видимому, требует назначения дополнительной психотропной терапии. В то же время наличие в анамнезе такого провоцирующего фактора, как непривычная физическая или статическая нагрузка, оказалось предиктором более высокой эффективности Зинаксина (рис. 2).
Положительная терапевтическая динамика у пациентов исследуемой группы привела к улучшению качества их жизни. Так, если до лечения показатель качества жизни составлял 34,8 ± 8,7 балла, то после – он изменился до 14,2 ± 3,9 балла (р < 0,05). Эффективность терапии Зинаксином отметили 85 % пациентов: большинство больных, вошедших в исследование, оценили эффективность Зинаксина как отличное (10 %) и хорошее (55 %); 20 % отметили удовлетворительный и только 15 % – недостаточный эффект.
Проведенное исследование позволило также отметить хорошую переносимость Зинаксина: лишь у 2 (10 %) пациентов на фоне приема препарата имели место побочные эффекты: изжога у одного пациента и диарея – у другого, которые были легкими, не требовали отмены препарата или назначения других лекарственных средств. Пациенты, принимавшие Зинаксин, отметили его переносимость как отличную (60 %), хорошую (25 %) и удовлетворительную (15 %).
Обсуждение
Препарат Зинаксин является НПВС природного происхождения и обладает рядом уникальных фармакологических свойств [4, 16, 25]:
- содержит два специально отобранных экстракта имбиря с доказанным синергичным действием – Alpinia galanga (калган) и Zingiber officinale (имбирь лекарственный);
- поскольку экстракты имбиря имеют низкую биодоступность, второй фармакологической особенностью Зинаксина является уникальная технология производства лекарственной формы – липокап, позволяющая увеличить биодоступность на 34 %, в результате чего в крови быстро создается необходимая терапевтическая концентрация препарата.
Механизм действия Зинаксина связан прежде всего с ингибированием ЦОГ-2 и 5-липооксигеназы (ЛОГ), что в свою очередь ведет к уменьшению образования простагландинов, простациклинов, тромбоксана и лейкотриенов [46]. В отличие от большинства НПВС неселективного действия экстракт имбиря не угнетает ЦОГ-1, следовательно, лишен нежелательных лекарственных реакций, связанных с ее блокадой [35, 48]. Экстракт имбиря также подавляет синтез провоспалительных цитокинов интерлейкина-1β (ИЛ-1β) и фактора некроза опухоли α (ФНО-α) [25, 30], а также стимулирует синтез противовоспалительных ИЛ-4 и ИЛ-10 [29, 32]. Предполагается, что непосредственной мишенью воздействия экстракта имбиря является регуляция экспрессии генов ФНО-α, ИЛ-1β, ИЛ-6, ИЛ-8 и ИЛ-10 через влияние на транскрипционный ядерный фактор NF-κB [25, 33]. Кроме этого экстракт имбиря подавляет экспрессию хемокинов, индуцирующих транспорт макрофагов в зону воспаления [23, 38]. Эффективность экстракта имбиря при хронической боли может быть обусловленной и ингибированием ЦОГ-2 в заднем роге спинного мозга, что может препятствовать развитию невропатической боли [42]. С другой стороны, экстракт имбиря подавляет как острое, так и хроническое воспаление. При этом его эффект связан не только с ингибированием синтеза простагландинов, но и со снижением продукции оксида азота и кальцитонин-ген родственного пептида – важнейших компонентов развития нейрогенного воспаления [44]. Также доказано, что экстракт имбиря подобно капсаицину обладает свойствами антагониста ванилоидных TPRV- и анкириновых TPRA-рецепторов, следовательно, может быть эффективным и при невропатической боли [19, 23].
Эффективность Зинаксина доказана в ряде клинических исследований, отвечающих требованиям доказательной медицины [3, 17, 18, 20, 43]. В рандомизированное двойное слепое плацебо-контролируемое параллельное многоцентровое (10 центров в США) исследование эффективности применения Зинаксина (в дозе 2 капсулы в сутки) на протяжении 6 недель вошел 261 пациент с хроническим болевым синдромом, связанным с остеоартритом [18]. Интенсивность боли оценивали по ВАШ, оценку скованности проводили по шкале WOMAC (Western Ontario and McMaster University Index). Достоверный обезболивающий эффект был отмечен ко второй неделе приема экстракта, а максимально выраженный – к шестой неделе, при этом выраженность боли в группе Зинаксина была на 40 % меньше, чем в группе плацебо (р = 0,005). Уже ко второй неделе приема Зинаксина снижалась скованность, тогда как достоверный эффект был отмечен на шестой неделе лечения (в отличие от плацебо на 31 %; р = 0,018). Во второй части исследования было проведено сравнение анальгетической активности экстракта имбиря с селективным блокатором ЦОГ-2 целекоксибом в различных дозах (100 и 200 мг). Интенсивность боли оценивали по ВАШ. Обезболивающий эффект целекоксиба быстро развивался к концу второй недели приема, тогда как эффект экстракта имбиря нарастал постепенно. Тем не менее начиная со второй и до шестой недели наблюдения клиническая эффективность целекоксиба и экстракта имбиря достоверно не различалась, при этом оба препарата достоверно превосходили эффекты плацебо [18].
В настоящем исследовании показано, что у 85 % пациентов с хронической неспецифической болью в спине Зинаксин демонстрировал положительный эффект: болевой синдром достоверно уменьшался в течение первого месяца приема препарата и продолжал регрессировать спустя 2 и 3 месяца. Вместе с болевым синдромом уменьшалась выраженность мышечно-тонического синдрома. Предиктором эффективности Зинаксина явилось наличие в анамнезе факторов, провоцирующих обострение боли, а именно: нехарактерной для пациента динамической или статической физической нагрузки.
У данной группы пациентов эффект Зинаксина, по-видимому, связан с его противовоспалительным действием. Следует также отметить хорошую переносимость препарата, что позволяет пациентам принимать его в течение длительного времени. Таким образом, Зинаксин может быть рекомендован для лечения пациентов с хронической неспецифической болью в спине как альтернативное или дополнительное средство к традиционным НПВС.
Информация об авторах:
Азимова Юлия Эдвардовна – кандидат медицинских наук, научный сотрудник отдела неврологии и клинической нейрофизиологииНИЦ ГОУ ВПО “Первый МГМУ им. И.М. Сеченова”. Тел. 8 (499) 248-69-44, e-mail: julia_azimova@mtu-net.ru;
Табеева Гюзель Рафкатовна – доктор медицинских наук, заведующая отделом неврологии и клинической нейрофизиологииНИЦ ГОУ ВПО “Первый МГМУ им. И.М. Сеченова”. Тел. 8 (499) 248-69-44, e-mail: taabeev@mars.rags.ru



