Сегодня Кселода (капецитабин) прочно вошла в стандарты лечения рака толстой кишки, рака желудка и рака молочной железы. В комбинациях препарат применяется при раке поджелудочной железы, раке пищевода и других опухолях, заменяя в схемах лечения 5-фторурацил (5-ФУ). За более чем 10-летний период использования в терапии онкологических заболеваний Кселода зарекомендовала себя в качестве эффективного, безопасного и удобного препарата для перорального приема, которым пролечено более 1,8 млн пациентов во всем мире.
Фармакокинетика капецитабина
Капецитабин, являясь пролекарством, проходит под действием ферментов в печени и опухолевой ткани ряд превращений с образованием 5-ФУ и его активных метаболитов. С помощью тимидинфосфорилазы (ТФ), фермента, содержащегося в больших концентрациях в солидных опухолях и ткани печени [1, 2], метаболит капецитабина 5c-дезокси-5-фторуридин (5c-ДФУР) превращается в 5-ФУ. Концентрация ТФ в опухолевых клетках в 3 раза превышает ее уровень в нормальных тканях [3], поэтому большая часть 5-ФУ образуется в опухоли и его влияние на большинство здоровых тканей ослабляется [4]. Таким образом, снижается риск возможных системных побочных эффектов, что было подтверждено в клинических исследованиях [2–4].
В фармакокинетическом исследовании показано, что при приеме капецитабина по 2,5 г/м² в сутки в крови создается концентрация 5-ФУ, аналогичная таковой при его инфузии в суточной дозе 300 мг/м².
Катаболизм 5-ФУ и капецитабина зависит от фермента дегидропиримидиндегидрогеназы (ДПД). Наличие синдрома недостаточности ДПД, который встречается в популяции с частотой от 0,1 до 5,0 %, может привести к тяжелой токсичности при лечении фторпиримидинами [5, 6]. Клинически синдром недостаточности ДПД проявляется диареей, нейтропенией, мукозитами, нейротоксичностью. Скрининговый дыхательный тест после приема урацила внутрь может помочь в определении групп риска указанного синдрома [7].
Применение Кселоды в монотерапии
В первой линии терапии метастатического колоректального рака (КРР) капецитабин изучался в двух больших исследованиях III фазы (SO14695 и SO14796) [8, 9]. Более 1200 пациентов (около 600 в каждой группе) получали капецитабин внутрь (2500 мг/м²/сут в 1–14-й дни 3-недельного цикла) или режим Клиники Мейо (лейковорин 20 мг/м² после 5-ФУ внутривенно 425 мг/м² струйно в 1–5-й дни 4-недельного цикла). В первом исследовании при лечении капецитабином частота объективного ответа (ЧОО) была незначительно выше (18,9 против 15 %). Медианы времени до прогрессирования (МВДП) и общей выживаемости (МОВ) практически не различались. Аналогичные результаты получены и во втором исследовании, хотя ЧОО была заметно выше в группе капецитабина (24,8 против 15,5 %) [8].
При сходной с режимом струйного введения 5-ФУ эффективности капецитабин имел лучший профиль безопасности. При использовании 5-ФУ чаще наблюдались нейтропения III–IV степени (22,8 против 2,3 %; р < 0,001), стоматит III–IV степени (14,7 против 2 %; р < 0,001), диарея (58 против 47,7 %). Развитие фебрильной нейтропении также чаще сопровождало применение 5-ФУ и лейковорина (3,4 против 0,2 %). В группе капецитабина чаще встречались ладонно-подошвенный синдром (ЛПС; 62,0 против 55,5 %; р < 0,001) и гипербилирубинемия III степени (18,3 против 3,3 %).
Причина возникновения гипербилирубинемии до конца не ясна. Возможно, она связана с компенсированной гемолитической анемией, вызванной капецитабином, или метаболизмом в печени 5’-ДФУР в 5-ФУ посредством печеночной ТФ [10]. При этом повышение билирубина чаще всего не сопровождается повышением уровня печеночных ферментов. В настоящее время коррекция дозы капецитабина при повышении содержания билирубина не рекомендуется. При гипербилирубинемии II–IV степени лечение останавливают до нормализации билирубина или снижения гипербилирубинемии до I степени [11].
В монотерапии капецитабин часто назначают пожилым пациентам с распространенным неоперабельным КРР и сопутствующими заболеваниями. В рекомендациях Society of Geriatric Oncology (SIOG) по дозированию химиотерапии у пожилых больных предлагается использовать дозу капецитабина 1000 мг/м² 2 раза в день вместо 1250 мг/м² 2 раза в день, т. к. эти дозы по эффективности часто эквивалентны у данной категории пациентов [12, 13]. Пилотные исследования позволяют предполагать, что уровень экспрессии гена ДПД в опухоли может быть предиктором клинического ответа при лечении капецитабином в монотерапии [14].
Капецитабин успешно используется в комбинациях с оксалиплатином, иринотеканом, митомицином, а также таргетными препаратами, такими как бевацизумаб и цетуксимаб, заменяя 5-ФУ во многих известных комбинациях и новых режимах.
Экспериментально показано, что капецитабин ингибирует белок Bcl-2, препятствующий апоптозу при воздействии иринотекана или оксалиплатина на опухолевые клетки. Комбинация капецитабина и иринотекана показала высокую эффективность в преклинических моделях.
Применение Кселоды в комбинации с оксалиплатином
В нескольких рандомизированных исследованиях III фазы показана сходная эффективность оксалиплатин-содержащих режимов с капецитабином по сравнению с 5-ФУ и лейковорином в 1-й линии терапии метастатического КРР с МВДП около 9 месяцев и МОВ около 19 месяцев [15–19].
В 2008 и 2009 гг. опубликованы результаты двух мета-анализов, каждый из которых включил 6 рандомизированных исследований по оценке различных режимов химиотерапии метастатического КРР. В табл. 1 перечислены исследования, включенные в первый мета-анализ [8, 10].
Частью самого крупномасштабного исследования NO16966 была сравнительная оценка режимов XELOX (оксалиплатин 130 мг/м² в 1-й день и капецитабин 2000 мг/м²/сут в 1–14-й дни каждые 3 недели) и FOLFOX-4 (оксалиплатин 85 мг/м² в 1-й день, лейковорин 200 мг/м², 5-ФУ 400 мг/м² струйно, 5-ФУ 600 мг/м² 22 часа в 1-й и 2-й дни каждые 2 недели) [20]. Результаты оказались сходными по частоте объективных ответов, стабилизации болезни, времени до прогрессирования и общей выживаемости.
В 2007 г. получены результаты AIO-группы по лечению 474 пациентов режимами FUFOX (оксалиплатин 50 мг/м², лейковорин 500 мг/м², 5-ФУ 2000 мг/м² в дни 1, 8, 15, 22 36-дневного цикла) и CAPOX (оксалиплатин 70 мг/м² в 1-й, 8-й дни, капецитабин 2000 мг/м²/сут в дни 1–14). МВДП составила 7,1 и 8,0, МOВ – 16,8 и 18,8 месяца для режимов CAPOX и FUFOX соответственно. Оба режима хорошо переносились, частота ЛПС была выше в группе с капецитабином [21].
В испанском исследовании TTD оценивали режим FUFOX (оксалиплатин 85 мг/м² каждые 2 недели, 5-ФУ 2250 мг/м², 48-часовая инфузия еженедельно 6 недель, 2-недельный перерыв) и XELOX у 342 пациентов. Не было различий во МВДП (8,9 и 9,5 месяцев) и МОВ (18,1 и 20,8 месяца) для режимов XELOX и FUFOX соответственно [22].
В целом мета-анализ включал 3494 пациента, из которых 1750 получали лечение капецитабином и оксалиплатином. При несколько большей ЧОО на лечение оксалиплатином и 5-ФУ МВДП была приблизительно одинаковой – 7,0–9,9 и 5,9–10,3 месяца для групп с 5-ФУ и капецитабином соответственно. МОВ была оценена в 5 исследованиях (3346 пациентов), достоверной разницы в отношении двух групп не установлено [10].
Мета-анализ, опубликованный в 2009 г., включил 2196 пациентов (1105 – в группе капецитабина и оксалиплатина, 1091 – в группе 5-ФУ и оксалиплатина) и подтвердил данные предыдущей работы. В табл. 2 перечислены исследования, включенные в этот мета-анализ [8].

Примечание. Х – капецитабин, ОХ – оксалиплатин, FU – 5-фторурацил, FA – лейковорин.
По данным 4 исследований достоверной разницы в общей выживаемости между двумя группами не отмечено. Выживаемость до прогрессирования оценивалась в трех исследованиях, достоверных различий в сравниваемых группах также не выявлено. ЧОО оценивалась во всех исследованиях, составив 43 % в группе капецитабина/оксалиплатина и 46,4 % в группе 5-ФУ/оксалиплатина (р = 0,097). В трех исследованиях оценивали время до неудачи в лечении. Мета-анализ выявил статистически достоверную разницу в пользу группы капецитабина и оксалиплатина (р = 0,027). Тромбоцитопения III–IV степени и ЛПС III–IV степени достоверно чаще отмечались в группе капецитабина/оксалиплатина, нейтропения III–IV степени – в группе фторурацила/оксалиплатина. В частоте других побочных эффектов (анемия, астения, диарея, тошнота, рвота, нейропатия, стоматит) достоверных различий между группами не обнаружено [8]. Результаты двух мета-анализов подтвердили сходную эффективность двух режимов.
В 2007 г. на ASCO были представлены результаты сравнительного исследования режимов XELOX или FOLFOX-4 во 2-й линии лечения метастатического КРР, включившего 627 пациентов, получавших терапию иринотеканом и 5-ФУ в первой линии химиотерапии [23]. МВДП составила 4,8 и 4,7, МОВ – 11,9 и 12,6 месяца для режимов XELOX и FOLFOX-4 соответственно. Токсичность III–IV степени отмечена в 60,1 % случаев при лечении режимом XELOX и у 72,4 % пациентов при лечении FOLFOX-4. Наиболее частыми побочными эффектам при использовании, соответственно, капецитабина и 5-ФУ были: диарея (20 и 5 %), нейтропения (5 и 35 %), астения (5 и 8 %), парестезия (9 и 8 %), тошнота/рвота (6 и 5 %), ЛПС III степени (3,5 и 0,6 %). Таким образом, была доказана равная эффективность применения режимов XELOX и FOLFOX-4 и во второй линии терапии метастатического КРР. Различия в токсичности соответствовали данным, полученным в других исследованиях.
Применение Кселоды в комбинации с иринотеканом
В 2009 г. опубликован обзор [24], систематизировавший данные 30 нерандомизированных исследований II фазы (1380 пациентов) и 6 рандомизированных исследований II и III фаз (1478 пациентов) по использованию иринотекана и капецитабина. В различных исследованиях дневная доза капецитабина колебалась от 1800 до 2500 мг/м² с продолжительностью применения от 7 до 14 дней цикла, доза иринотекана – от 180 до 350 мг/м². В нерандомизированных исследованиях медиана ЧОО составила 46,75 % (25–78 %), МВДП – 7,9 месяца (5,0–9,9 месяца), МОВ – 15,6 месяца (7,0–24,6 месяца). Среди проявлений токсичности III–IV степени были диарея (21,5 %), нейтропения (12 %), рвота (12,5 %), астения (6 %), ЛПС (6 %). Частота фебрильной нейтропении составила 2,5 %.
В рандомизированных исследованиях сравнивали режимы XELIRI и FOLFIRI. Эффективность режимов была сходной: 39 % (34–56 %) для XELIRI и 47 % (27,0–61,8 %) для FOLFIRI, МВДП – 8,2 и 9,2 месяца соответственно.
В своем исследовании Meropol N.J. и соавт. при изучении комбинации капецитабина и иринотекана оценивали экспрессию тимелатсинтетазы, ТФ и ДПД [25]. Экспрессия ТФ в первичной опухоли, определенная иммуногистохимическим методом, ассоциировалась с более высокой ЧОО (65 против 27 %) и увеличением МВДП (8,7 против 6,0 месяцев), подтвердив значение ТФ как прогностического фактора в соответствии с ее ключевой ролью в активации капецитабина.
Целесообразность продолженного применения фторпиримидинов после прогрессирования КРР показана в рандомизированном исследовании режимов XELOX и XELIRI во 2-й линии химиотерапии. В первой линии больные получали режимы FOLFOX или FOLFIRI, после прогрессирования им назначался режим с Кселодой и ранее не применявшимся препаратом (иринотеканом или оксалиплатином). В исследование были включены 43 пациента, контроль над болезнью (частичная ремиссия + стабилизация) достигнут у 28 больных, МОВ составила 10,3 и 11,2 месяца соответственно [26].
Применение Кселоды в комбинации с митомицином
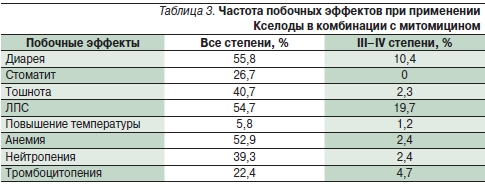
Исследование II фазы было проведено в двух центрах – в Англии и Австралии. Режим применения Кселоды с митомицином (капецитабин 2500 мг/м²/сут в 1–14-й дни 3-недельного курса, митомицин 7 мг/м² каждые 6 недель) был оценен у 92 пациентов с метастатическим КРР в первой линии терапии. ЧОО составила 38 %, частота стабилизации болезни – 33 %, МВДП – 7,1 месяца. Основные побочные эффекты отражены в табл. 3; среди них чаще встречались диарея III–IV степени (10,4 %) и ЛПС III–IV степени (19,7 %); частота всех случаев тромбоцитопении составила 22,4 % [27].
Применение Кселоды с таргетными препаратами
В 2007 г. опубликованы результаты большого рандомизированного исследования II фазы AIO GI-группы по сравнению режимов САРОХ/бевацизумаб и CAPIRI/бевацизумаб у больных метастатическим КРР в первой линии терапии. Схемы лечения: бевацизумаб 7,5 мг/кг в сочетании с оксалиплатином 130 мг/м² в 1-й день курса и капецитабин 2000 мг/м² в дни 1–14 (САРОХ/бевацизумаб) или бевацизумаб 7,5 мг/кг в сочетании с иринотеканом 200 мг/м² в 1-й день и капецитабин 1600 мг/м² в дни 1–14 (CAPIRI/бевацизумаб) 3-недельного цикла. Дозы иринотекана и Кселоды были снижены по сравнению с предыдущими исследованиями в связи с неприемлемой токсичностью (Kohne, ASCO-2005). В исследование были включены 240 больных, токсичность оценена у 228, эффективность – у 185. ЧОО составила 49,0 и 52,7 %, частота контроля над болезнью – 81,4 и 82,0 % для режимов САРОХ/bev и CAPIRI/бевацизумаб соответственно. Различия в токсичности III–IV степени отмечены только в частоте периферической полинейропатии (15,3 против 0 %) и ЛПС (5,9 против 2,7 %). Специфичные для бевацизумаба эффекты (тромбоз – 3,4 и 4,5 % и перфорация желудочно-кишечного тракта – 0,9 и 0,9 %) регистрировались при двух режимах с одинаковой частотой. Таким образом, добавление бевацизумаба в схему лечения метастатического КРР увеличивало эффективность и не повышало существенно токсичность [28].
Сходные результаты получены в исследовании II фазы режима XELIRI-A (иринотекан 200 мг/м² и бевацизумаб 7,5 мг/кг в 1-й день, капецитабин 2000 мг/м² в 1–14-й дни 3-недельного цикла; у пациентов старше 65 лет доза капецитабина была снижена до 1500 мг/м²/сут). У 50 больных эффективность режима была высокой: частота общего контроля над болезнью составила 86 %, ЧОО – 40 %, МВДП – 11,1 месяца. Один год без прогрессирования прожили 49 % больных, 7 пациентов были прооперированы. Наиболее часто встречающимися побочными эффектами III–IV степени были нейтропения, ЛПС, диарея [29].
В исследовании TREE-2 [30] по сравнение режимов FOLFOX, bFOL и CAPEOX с бевацизумабом первичной целью была оценка токсичности III-IV степени в течение 12 недель лечения. Частота всей токсичности III–IV степени составила 66, 59 и 54 % для режимов FOLFOX, bFOL и CAPEOX соответственно.
В 2009 г. появились первые результаты рандомизированного исследования II фазы режимов XELIRI-A (иринотекан 200 мг/м² в 1-й день цикла, капецитабин 1000 мг/м² дважды в 1–14-й дни 3-недельного цикла; у пациентов старше 65 лет доза капецитабина была снижена до 800 мг/м² 2 раза в день) и FOLFIRI-А (иринотекан 200 мг/м², 5-ФУ 400 мг/м² + лейковорин 400 мг/м², затем 5-ФУ 2400 мг/м² в последующие 46 часов и бевацизумаб 7,5 мг/кг в 1-й день 22-дневного цикла) [31]. С 2006 по 2008 г. в исследование были включены 145 больных, из них 35 % – старше 65 лет. ЧОО составила 58 % в обеих группах.
В международное рандомизированное исследование III фазы (AGITG MAX) по сравнительному изучению в первой линии терапии трех режимов – Кселодой в монотерапии, Кселодой в комбинации с бевацизумабом, Кселодой в комбинации с бевацизумабом и митомицином – было набрано 400 пациентов [32]. ЧОО составила 31, 38 и 46 %, стабилизация – 49, 54 и 48 % для вышеперечисленных режимов соответственно. В группах с бевацизумабом МВДП была одинаковой – 8,4 и 8,5 против 5,7 месяца в группе монотерапии Кселодой.
На ASCO-2010 был представлен финальный анализ рандомизированного исследования AIO CRC-группы по изучению режимов XELOX и XELIRI в сочетании с цетуксимабом в первой линии лечения у 177 пациентов с метастатическим ККР. Цетуксимаб применялся в стандартном еженедельном режиме; иринотекан 200 мг/м² – в 1-й день, капецитабин 1600 мг/м²/сут – в 1–14-й дни (XELIRI); оксалиплатин 130 мг/м² – в 1-й день, капецитабин 2000 мг/м²/сут – в 1–14-й дни (XELOX). Высокие ЧОО (46,1 и 47,7 %) и частота контроля над болезнью (74,2 и 77,3 %) доказаны для обеих групп. МВДП и МОВ составили 6,3 и 21,1 месяца для режима XELIRI и 7,7 и 25,5 месяца для режима XELOX. Наиболее частыми побочными эффектами были диарея III–IV степени (15,7 и 19, 3 %), кожная токсичность (12,4 и 20,5 %) и сенсорная нейропатия (1,1 и 15,7 %) для групп XELIRI и XELOX соответственно [33].
В исследовании CAIRO-2 оценивалась возможность использования в одном режиме двух антител [34]. Оно включало 700 пациентов с метастатическим КРР, получивших лечение одним из следующих режимов: XELOX + бевацизумаб или XELOX + бевацизумаб + цетуксимаб. Хотя МОВ между режимами не различалась (20,4 и 20,3 месяца), МВДП было короче в группе пациентов, получавших оба антитела (9,6 против 10,7 месяца). Можно предположить, что на результаты повлияло отсутствие скрининга на наличие мутации гена K-ras в опухоли.
Исследование II фазы AIO 0105 включило 72 пациента с нерезектабельными метастазами КРР, не нуждавшихся в интенсивной химиотерапии. Больные получали капецитабин 1250 мг/м² 2 раза в день в 1–14-й дни и бевацизумаб 7,5 мг/кг 1 раз в 3 недели в первой линии терапии. Медиана возраста составила 70 лет, 35 % больных были старше 74 лет.
Медиана числа курсов составила 8 (1–24). Редукцию дозы Кселоды приходилось производить из-за ЛПС. ЧОО составила 32 %, МВДП – 6,2 (1–24) месяца, у пациентов с ECOG-0 МВДП достигала 9 месяцев. МОВ в целом составляла 18 месяцев (27 месяцев для больных с ECOG-0) [35]. Результаты подтверждают возможность использования бевацизумаба и Кселоды как единственного цитостатика у пациентов с неоперабельной опухолью и статусом ECOG-0.
Заключение
В множестве исследований продемонстрирована клиническая эффективность Кселоды (капецитабин) при метастатическом КРР как в монотерапии, так и в комбинации с оксалиплатином и иринотеканом в 1-й и 2-й линиях лечения. В рандомизированных многоцентровых исследованиях показана равная эффективность комбинированных режимов с Кселодой и режимов, включающих суточные инфузии 5-ФУ. Высокоэффективным и безопасным оказалось включение Кселоды в режимы с таргетными препаратами.
Кселода является опухоль-специфичным препаратом, т. к. уровень ТФ в опухоли превышает таковой в здоровых тканях. ТФ может являться предиктором ответа на терапию Кселодой.
Применение Кселоды не требует венозного доступа, тем самым снижая частоту тромботических осложнений и позволяя проводить лечение амбулаторно.



