Сахарный диабет типа 2 (СД2) является хроническим прогрессирующим заболеванием, распространенность которого растет эпидемическими темпами. Несмотря на значительные возможности современной фармакотерапии этого заболевания, нерешенными остаются многие проблемы, связанные в первую очередь с достижением целевого метаболического контроля. Следует признать, что в России, как и во многих других странах, 2/3 пациентов с СД2 не достигают рекомендованных целей терапии [1, 2]. Ясно, что эффективное лечение гипергликемии – основного фактора развития диабетических осложнений – чрезвычайно важный вопрос с учетом повсеместного стремительного увеличения числа больных СД, их преждевременной инвалидизации и высокой смертности от сосудистых осложнений, частоту которых можно существенно сократить за счет достижения гликемии, близкой к нормальному уровню. К сожалению, при СД2 риск сердечно-сосудистых заболеваний и смертность в 2–5 раз превышают популяционные показатели, причем у этой категории пациентов 80 % смертельных исходов обусловлены кардиоваскулярной патологией [3]. Риск смертельного исхода у пациентов с ишемической болезнью сердца (ИБС) без инфаркта миокарда в анамнезе, страдающих СД2, такой же, как у больных, уже перенесших инфаркт.
Эффективное лечение гипергликемии необходимо проводить с самого начала заболевания в течение всей жизни пациента, т. к. к моменту постановки диагноза СД2 у половины больных уже выявляются два и более его осложнений [4]. Острота проблемы нарастает, поскольку велики экономические последствия, обусловленные сосудистыми осложнениями диабета, развитие которых в среднем удорожает лечение в 3–10 раз [1] (табл. 1).
Осознание необходимости срочного подбора эффективного и быстрообеспечивающего результат лечения основано в первую очередь на современном понимании патофизиологии СД2 – непрерывно прогрессирующего заболевания с прогредиентным ухудшением показателей гликемии. В развитии СД2 имеют значение два фундаментальных патофизиологических механизма: прогрессирующее нарушение функции β-клеток и инсулинорезистентность (ИР) различной степени выраженности. При манифестации СД секреция инсулина в среднем снижается на 50 %, чувствительность к инсулину – на 70 % [5, 6]. В дальнейшем функция β-клеток ухудшается примерно на 4–6 % в год от момента установления диагноза; периферическая чувствительность к инсулину остается относительно сохранной, что определяет необходимость выбора оптимальной терапии на каждом этапе развития заболевания (рис. 1). Важно подчеркнуть, что успех любого варианта терапии СД2 зависит от остаточной функции β-клеток.
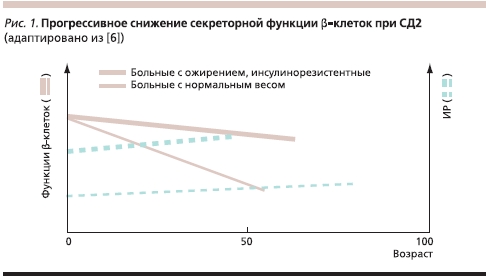
В настоящее время значимость обеспечения гликемического контроля в эффективном лечении СД2 и профилактике его осложнений неопровержима.
В реальной клинической практике врачей интересуют ответы на ряд принципиальных вопросов, касающихся повышения эффективности лечения и улучшения прогноза пациентов:
• до какого предела следует снижать уровень гликированного гемоглобина (HbA1c) у различных категорий пациентов (с учетом его нормативных показателей у лиц без нарушения углеводного обмена);
• какая величина HbA1с будет соответствовать наименьшему риску микро- и макрососудистых осложнений СД2;
• каковы преимущества более жесткого гликемического контроля (HbA1c < 6,5 %) и безопасен ли он в сравнении со стандартным лечением?
Изменив и расширив наши представления о природе, эволюции и последствиях СД2, результаты ключевых клинических исследований (UKPDS, STENO–2, ACCORD, VADT и ADVANCE) внесли важный вклад в понимание и решение проблем ведения больных СД2. Результаты этих исследований заслуживают пристального внимания и должны стать частью повседневной клинической практики.
Напомним, что исследование UKPDS, в котором принимали участие пациенты с впервые выявленным СД2 без тяжелых осложнений, убедительно продемонстрировало достоверные преимущества жесткого и непрерывного контроля гликемии с обеспечением близких к нормальным показателей как надежного метода профилактики хронических диабетических осложнений [7, 8]. В ходе исследования отмечено, что риск макро- и микрососудистых осложнений был ниже именно у тех пациентов, которые более тщательно контролировали гликемию, причем любое снижение уровня HbA1c способствовало уменьшению сосудистого риска. Согласно результатам долговременного наблюдения (20 лет) за пациентами, участвовавшими в UKPDS, лица, изначально получавшие интенсивную сахароснижающую терапию, имели более низкие показатели сердечно-сосудистой смертности по сравнению с больными, у которых применялся стандартный терапевтический подход [9]. Иначе говоря, у пациентов с СД2 без тяжелых осложнений и с достаточно большой ожидаемой продолжительностью жизни отдаленные положительные эффекты интенсивной терапии явно перевешивают риск ее неблагоприятных последствий.
В отличие от Британского проспективного исследования диабета в других работах участвовали пациенты со средней длительностью заболевания 8–10 лет и факторами риска развития сердечно-сосудистой патологии – именно такие больные наиболее часто встречаются в повседневной практике [10–12] (табл. 2).
Как показали результаты исследования VADT, достижение целей гликемического контроля должно осуществляться менее агрессивно [10]. Итоги исследования ACCORD позволяют предположить, что очень интенсивное лечение, направленное на достижение уровня HbA1c ≤ 6 %, может оказаться опасным, по крайней мере у лиц старшего возраста с заболеваниями сердечно-сосудистой системы или многочисленными факторами кардиоваскулярного риска [12]. Тем не менее терапевтическая тактика в исследовании ACCORD характеризовалась достаточно быстрым темпом снижения концентрации HbA1c: в течение года показатель этот снизился с 8,3 до 6,4 % (на 1,9 %).
Напротив, исследование ADVANCE продемонстрировало безопасную и эффективную тактику достижения оптимального гликемического контроля у больных СД2, в т. ч. имеющих высокий сердечно-сосудистый риск [11]. Она заключалась в интенсивном, но не агрессивном, постепенном снижении уровня HbA1c – не более чем на 0,5–0,6 % в год [13].
Большой интерес представляют результаты крупного мета-анализа, проведенного Ray K.K. и соавт., в котором были обобщенны данные, полученные в пяти крупнейших, постоянно цитируемых исследованиях в области диабета за 163 тыс. пациенто-лет наблюдения [14]. Согласно результатам анализа, средний уровень HbA1c оказался на 0,9 % ниже у участников исследований с интенсивным контролем гликемии по сравнению с теми, кто находился на стандартной терапии. Интенсивный контроль гликемии сопровождался снижением частоты нефатального инфаркта миокарда и случаев ИБС соответственно на 17 и 15 %. Кроме того, интенсивный контроль гликемии не влиял на частоту инсультов и смертность от всех причин.
Иначе говоря, стало понятно, что существует метаболическая память организма: годы хорошего или неудовлетворительного гликемического контроля по-разному влияют на сосудистые осложнения и, соответственно, на их исходы. Хорошая метаболическая память крайне обходима для предотвращения хронических осложнений диабета, поэтому так важно назначать эффективную терапию пациентам с СД2 уже в начале лечения [15, 16]. Однако у лиц с длительно существующим диабетом и сердечно-сосудистыми заболеваниями в анамнезе чрезмерно агрессивный гликемический контроль может оказаться даже опасным, возможно из-за связанного с ним учащения гипогликемических состояний [17]. Это должно приниматься в расчет при ведении таких пациентов, у которых при достижении оптимального гликемического контроля следует учитывать состояние здоровья каждого конкретного больного и возможный риск гипогликемий [18].
Согласно рекомендациям ADA/EASD (2009) и стандартам специализированной медицинской помощи больным с СД Российской ассоциации эндокринологов, для снижения риска микро- и макрососудистых осложнений целевой уровень HbA1c для взрослых составляет < 7 % [19]. Согласно более жесткому консенсусу Международной федерации диабета (IDF), этот показатель не должен превышать 6,5 %.
Необходимо учитывать, что эта цель не применима абсолютно ко всем пациентам с СД: для разных групп пациентов должны существовать разные целевые показатели HbA1c. Принципиально важно соизмерять потенциальную пользу и риски фармакотерапии (в первую очередь гипогликемии), но в случае отсутствия должного гликемического контроля безусловно обязательна активизация терапевтического режима у каждого пациента.
Однако, прежде чем интенсифицировать лечебный процесс, должны быть приняты во внимание следующие факторы: возраст пациента, вероятная продолжительность жизни, риск гипогликемических эпизодов, сопутствующая патология (особенно сердечно-сосудистая). Менее строгий целевой уровень HbA1c (чем значение < 7 %) может применяться у пациентов с большим стажем диабета, тяжелой гипогликемией в анамнезе, сниженной предполагаемой продолжительностью жизни, с выраженными сердечно-сосудистыми осложнениями или тяжелыми органными поражениями. Исключение составляют также лица, у которых риск гипогликемических состояний и их последствий превышает ожидаемую пользу от достижения гликемии, близкой к нормальному уровню. И конечно, с учетом повышенного риска гипогликемий следует особенно внимательно относиться к пожилым и старым пациентам. У таких больных с ожидаемой продолжительностью жизни менее 5 лет и выраженными когнитивными нарушениями терапевтической целью являются стабилизация клинического состояния и предупреждение развития гипогликемических состояний, т. е. допускаются более высокие показатели гликемии и HbA1c.
По мере увеличения длительности СД2 у пациентов прогрессирует дефицит инсулина и заболеванием все труднее управлять, поэтому для достижения и поддержания рекомендованных целевых показателей гликемии (HbA1c < 7 %) возникает потребность в инсулине, ибо любая терапия пероральными сахароснижающими препаратами [ПCCП] становится неэффективной при ослаблении остаточной функции β-клетки [20, 21]. Следует отметить, что инсулинотерапия по-прежнему занимает основное место в лечении СД2 и относится к одному из наиболее востребованных фармакологических подходов: у 30–40 % пациентов, как неопровержимо продемонстрировали результаты UKPDS, только она позволяет достигать контроля гликемии [7, 8]. Инсулин – это наиболее эффективный гипогликемизирующий препарат, поскольку при его применении достигается наиболее выраженное снижение HbA1c – до 2,5–3,5 % [20, 21]. В отличие от других сахароснижающих препаратов не существует максимальной дозы инсулина, выше которой не будет увеличения терапевтического эффекта. Следует помнить, что для преодоления ИР при СД2 и снижения HbA1c до целевого уровня в ряде случаев необходимо назначать более высокие дозы инсулина (≥ 1 ЕД/кг), чем для лечения СД типа 1 [20]. Необходимо также подчеркнуть, что по применению инсулина в лечении диабета накоплен самый большой клинический опыт.
Вместе с тем реальная практика свидетельствует о том, что у больных СД2 инсулин часто рассматривается в качестве препарата последнего выбора: инсулинотерапия назначается слишком поздно, и к тому моменту, когда ее начинают, у многих пациентов уже развиваются осложнения [20, 21]. Предметом серьезных дискуссий является тактика назначения инсулина при СД2.
В настоящее время пересматриваются многие традиционные представления о фармакотерапии СД2. Принципиально важно отметить, что показанием к инсулинотерапии становится не стаж диабета, а невозможность достижения рекомендованного целевого уровня гликемии другими терапевтическими методами. Доступность препаратов с разными скоростью наступления эффекта и длительностью действия дает возможность более точно имитировать физиологическую секрецию инсулина и добиваться лучшего метаболического контроля с меньшим риском гипогликемии [19–21].
Поскольку заболевание носит прогрессирующий характер, для больных с неудовлетворительным гликемическим контролем при применении максимальных дозировок ПССП в соответствующих режимах и комбинациях выработан определенный алгоритм перехода на инсулинотерапию. Начало лечения пациента с СД2 базальным инсулином в дополнение к ПССП в уменьшенной до среднетерапевтической дозы может быть осуществлено, начиная с одной инъекции в сутки; в последующем возможна комбинация двух инъекций инсулина средней продолжительности действия и ПССП [19, 22]. У большинства больных СД2 в ночные часы происходит избыточная печеночная продукция глюкозы, в связи с этим вечернее назначение базального инсулина имеет четкое патофизиологическое обоснование. Введенный вечером (или перед сном) базальный инсулин препятствует ночному повышению гликемии, позволяет улучшать контроль гликемии натощак и, что важно, снижать глюкозотоксичность. Инсулинотерапия больных СД2 направлена не только на восполнение дефицита инсулина, но и на устранение ИР. В исследованиях было продемонстрировано, что устранение глюкозотоксичности с помощью инсулина существенно повышает чувствительность организма к инсулину [20].
В целом назначение базального инсулина, добавляемого к ПССП, приводит к значительному улучшению суточного профиля гликемии. Принципиально важно отметить, что адекватный гликемический контроль с помощью базального инсулина требует постепенного титрования дозы препарата, что позволяет достигать рекомендуемых целевых значений HbA1c и одновременно предотвращать развитие гипогликемических эпизодов.
Первоначальная инсулинотерапия предполагает применение инсулинов среднего или длительного действия, но со временем многим пациентам может также потребоваться назначение инсулина короткого действия (ИКД). Следует признать, что на практике назначение инсулина пациентам с СД2 часто вызывает у них страх, связанный с многократными инъекциями, необходимостью изменения привычного уклада жизни и режима питания.
На основании рекомендаций IDF (2005) и стандартов специализированной медицинской помощи больным с СД Российской ассоциации эндокринологов для стартовой инсулинотерапии могут использоваться не только базальные, но и двухфазные инсулины [17, 19, 20] (рис. 2). Так, стартовое назначение базального инсулина (инсулин НПХ, гларгин, детемир) предпочтительнее при уровне HbA1c >7,5 %, но < 8,5 %. При уровне HbA1c > 8,5 % предпочтительнее назначение двухфазного инсулина (готовых смесей инсулина, премикстов).
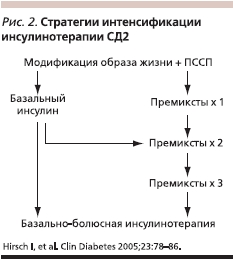
Готовые смеси инсулина наиболее удобны для пациентов со стабильным режимом дня и питания, лиц старшей возрастной группы [21, 22]. Смешанные инсулины в фиксированных пропорциях позволяют при общем сокращении количества ежедневных инъекций достигать и поддерживать целевые показатели гликемического контроля. Характерно, что профиль активности готовых смесей определяется сочетанием фармакологических параметров их составляющих.
Спектр инсулиновых препаратов становится все шире и включает как традиционные инсулины, так и аналоги [23–25]. Ряд международных исследований, проведенных в т. ч. и в России, свидетельствуют об улучшении контроля гликемии на фоне применения инсулиновых аналогов. С фармакокинетических позиций для инсулиновых препаратов наиболее важны начало, максимум и продолжительность действия. Все эти параметры зависят от скорости всасывания инсулина в кровь после инъекции [20, 21]. При подкожной инъекции ИКД их всасывание в кровь начинается с некоторой задержкой: только после диссоциации гексамерной формы на мономеры инсулина. Эта особенность и определяет фармакокинетический профиль ИКД [24].
Говоря о снижение частоты сосудистых осложнений у пациентов с СД2, следует подчеркнуть особую роль контроля постпрандиальной гликемии (ППГ). Сравнительно позднее начало и малая длительность действия ИКД ограничивают их эффективность в плане контроля ППГ. Важно отметить, что присущая ИКД дозозависимая фармакокинетика приводит к изменению временных характеристик препарата, в частности к пролонгированию начала действия, максимума концентрации и продолжительности эффекта при использовании высоких доз ИКД (более 8–10 МЕ), что нередко имеет место у пациентов с СД2 [20, 22].
Преодолеть эту задержку всасывания инсулина в кровь удалось путем создания ультракоротких аналогов, полученных в результате снижения стабильности гексамеров инсулина [25]. Фармакокинетика ультракоротких инсулиновых аналогов предполагает, что после инъекции происходит их быстрая диссоциация на мономеры, поступающие в циркуляцию. Инсулин лизпро (Хумалог) был первым ультракоротким аналогом инсулина, получившим одобрение FDA (Управление по надзору за качеством пищевых продуктов и медикаментов США) [21]. Время до начала действия, достижения максимальной концентрации и длительность действия ультракоротких аналогов примерно вдвое короче, чем у человеческих ИКД: начало действия – через 5–15 минут после инъекции, достижение пика – через 30–90 минут и длительность действия – до 4 часов [20, 22]. Кроме того, менее выражена вариабельность абсорбции и клиренса по сравнению с традиционными ИКД [21].
Смеси из аналогов инсулина более предпочтительны, чем смеси человеческих инсулинов [23, 24]. Одним из предварительно смешанных инсулинов, применяемых в нашей стране, является Хумалог Микс 25 – препарат, содержащий инсулин лизпро и его протаминовую суспензию в соотношении 25 : 75 [22]. Протаминовый компонент обеспечивает базальную потребность, а ультракороткий контролирует ППГ. В практическом плане важно отметить, что применение Хумалога Микс 25 возможно как непосредственно перед едой, так и в течение 20 минут после приема пищи, что улучшает качество жизни больного.
В целом ультракороткие аналоги (Хумалог), входящие в состав смесей инсулина, имеют фармакокинетические и фармакодинамические свойства, наиболее точно воспроизводящие эндогенную секрецию инсулина во время еды, что обеспечивает оптимальную утилизацию глюкозы печенью и периферическими тканями после приема пищи [20–22]. Терапия готовыми аналоговыми смесями дает возможность улучшать общий контроль гликемии и контроль ППГ [26]. Преимуществами терапии готовыми аналоговыми смесями являются не только лучший контроль гликемии, но и снижение частоты гипогликемий, в т. ч. ночных. Смешанные инсулины перед завтраком и ужином – правильное решение в случае, когда пациент с СД2 имеет как гипергликемию натощак, так и высокую ППГ в течение суток [22, 27].
Готовые смеси (Хумалог Микс 25) являются лучшим выбором для следующих категорий пациентов с СД2 [22, 26, 27]:
• с гипергликемией натощак и постпрандиальной гипергликемией, не являющихся кандидатами на назначение интенсифицированной инсулинотерапии;
• имеющих стабильный образ жизни;
• желающих избежать многократных инъекций инсулина в течение суток;
• не способных часто проводить самоконтроль гликемии;
• с постоянным режимом питания с точки зрения времени приема пищи, содержания углеводов и объема пищи, не пропускающих прием пищи в завтрак и ужин.
Готовые смеси, как правило, назначают в дозе 10–12 ЕД перед ужином в случае одной инъекции или перед завтраком и перед ужином при режиме двукратных инъекций. Алгоритм титрации дозы готовой смеси инсулина представлен в табл. 3 [22]. Следует подчеркнуть, что однократная доза не должна превышать 30 ЕД. В случае неэффективности режима одной инъекции используемую дозу смеси необходимо разделить на две инъекции: половина дозы инсулина вводится перед завтраком, столько же перед ужином. Титрация утренней дозы готовой смеси инсулина осуществляется на основании показателей гликемии перед ужином; титрация вечерней дозы – по уровню гликемии натощак. Напомним, что пероральные стимуляторы секреции инсулина должны быть отменены при назначении готовых смесей в режиме двух инъекций.
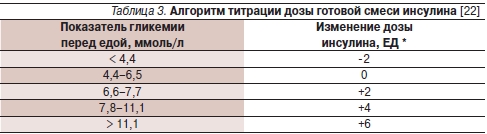
* Доза инсулина перед ужином титруется на основании показателей гликемии натощак, доза перед завтраком – гликемии перед ужином.
Безусловно важно не только своевременно начинать инсулинотерапию, но и интенсифицировать ее в нужный момент, что со временем потребуется большинству пациентов. Традиционная инсулинотерапия при СД2 не всегда обеспечивает полноценный метаболический контроль. Значительное снижение эндогенной секреции инсулина на протяжении прогрессирования СД2 при неэффективности других, ранее применяемых режимов инсулинотерапии требует интенсификации, т. е. базис-болюсного режима (инъекции ИКД/ультракороткого аналога перед основными приемами пищи в комбинации с инъекциями инсулина средней продолжительности действия 2 раза в сутки или аналогами инсулина длительного действия 1–2 раз в сутки) [20, 21]. Итак, при СД2 возможно несколько режимов инсулинотерапии, но принципиально важно, чтобы лечение всегда базировалось на индивидуальном, взвешенном подходе со стороны врача. В каждом случае выбор режима инсулинотерапии определяется исходя из всестороннего анализа состояния пациента и особенностей течения СД2 (длительность, показатели гликемии в течение суток, гипогликемии в анамнезе, осложнения, сопутствующие заболевания), а также зависит от возраста пациента и образа его жизни.
Подводя итоги, следует отметить, что со времени открытия инсулина Бантингом Ф. и Бестом Ч. прошел почти целый век, но инсулин по-прежнему остается наиболее эффективным препаратом в арсенале сахароснижающих средств. Следует также подчеркнут необходимость значительных усилий для повышения эффективности гликемического контроля у пациентов с СД2. Одним из факторов, способствующим улучшению результатов сахароснижающей терапии, может быть внедрение в повседневную практику результатов и выводов клинических исследований, которые четко продемонстрировали, что оптимальные механизм, темп и степень снижения HbA1c в разных популяциях пациентов с СД2 могут быть различными.


