Алкогольная болезнь (АБ) является одной из самых актуальных медико-социальных проблем современного общества. АБ – прогредиентноезаболевание, в основе которого лежатпатологическое влечение к спиртнымнапиткам, развитие абстинентногосиндрома при прекращении употребления алкоголя, психическая деградация личности, стойкие соматическиерасстройства [2, 6, 10, 21].Известно, что при хронической алкогольной интоксикации страдает весьорганизм и тяжесть поражения органовпрямо пропорционально длительностизлоупотребления алкоголем [3, 7, 17]. Динамику этих поражений отражаетконцепция АБ, учитывающая стадийное развитие заболевания [4, 11].
Особую актуальность приобретает проблема влияния алкоголя на развитие патологии гастродуоденальнойзоны, поскольку органы желудочно-кишечного тракта (ЖКТ) выполняютбарьерную функцию на пути проникновения алкоголя в организм и первыми испытывают его негативное воздействие [8, 12, 16, 20].
Лечение алкоголизма – долгий итрудный процесс, больше похожий надлительную реабилитацию после тяжелой операции: человек учится житьпо-новому, принимая неизбежныеограничения и реализуя открывающиеся возможности.
Лечение пациентов с АБ не является строго стандартизированным.Отсутствуют стандарты терапии алкогольиндуцированной соматическойпатологии, в т. ч. заболеваний желудкаи двенадцатиперстной кишки (ДПК). Принципиально важным для эффективного лечения и предупрежденияАБ становится отказ пациента от употребления алкоголя. Медикаментозноелечение АБ направлено на подавление
алкогольной зависимости и устранение нарушений, вызванных хронической алкогольной интоксикацией.
В литературе имеются данные обэффективности препарата Метадоксил в комплексной терапии патологии печени у пациентов с алкогольной зависимостью [1, 24]. Активным веществомМетадоксила является метадоксин(пиридоксин L-2 пирролидон 5-карбоксилат). Пиридоксин – предшественник пиридоксала и пиридоксальфосфата, которые в качестве коферментовучаствуют в печеночном метаболизмеуглеводов, желчных и аминокислот,увеличивают скорость утилизации этанола и ацетальдегида, а пирролидонакарбоксилат является предшественником глутатиона, облегчает синтезАТФ через активацию пуриновогосинтеза и увеличение количества предшественников глицина и глутамина,активирует холин- и ГАМКергические системы [4].
Комбинированное действие этих веществ, входящих в состав препарата, обусловливает возможность восстановления поврежденных клеток после прекращения поступления алкоголя в организм. Метадоксил ускоряет плазменныйклиренс этанола и его метаболитов, в частности ацетальдегида [9, 15].
Вместе с тем эффективность Метадоксила в комплексном леченииэрозивно-язвенных изменений желудкапри АБ практически не изучена. В связис вышеизложенным изучение данной проблемы представляется актуальным.
Цель исследования состояла в определении частоты встречаемости и клинико-морфологических особенностей гастродуоденальной зоны у пациентов с АБ печени (АБП), а также в оценке эффективности Метадоксила в комплексном лечении гастропатий при АБП.
Материал и методы
В исследование были включены 137 пациента (86 мужчин и 48 женщин) в возрасте от 32 до 55 лет (среднийвозраст – 43 ± 0,5 года) с верифицированной наркологом II стадией АБ.Стаж употребления алкоголя составил в среднем 14,73 ± 0,88 года. Наосновании данных удьтразвуковогоисследования, фиброэластометрии“Фиброскан” (Echosens, Франция) ибиохимических тестов пациенты были
разделены на две группы в зависимости от степени поражения печени: первую составили 72 пациента с хроническим алкогольным стеатогепатитом(АСГ), вторая группа – 65 пациентов салкогольным циррозом печени (АЦП)классов А, В и С.
Критерии включения в исследование:
• наличие патологии гастродуоденальной зоны;
• верифицированная наркологом АБII стадии;
• подписанное информированноесогласие на участие в исследовании.
Критерии исключения из исследования:
• острые и хронические вирусные и
аутоиммунные заболевания печени;
• алкогольные психозы;
• алкогольная деменция;
• сахарный диабет;
• онкологические заболевания;
• желчнокаменная болезнь;
• воспалительные заболевания кишечника;
• заболевания сердечно-сосудистой,бронхолегочной и мочевыделительной систем в фазе декомпенсации;
• отказ больного от обследования.Все пациенты с АБ были обследованы на фоне 2–4-недельной абстиненции.
Группу сравнения составили 68 пациентов в возрасте от 26 до 49 лет (средний возраст – 43 ± 0,5 года), из них 50 мужчин и 18 женщин, практически не употребляющих алкоголь, имеющих следующие хронические заболевания органов пищеварения: гастроэзофагеальная рефлюксная болезнь, эндоскопически позитивный вариант – 12 человек (17,6 %); хронический мультифокальный атрофический гастрит – 22 пациента (32,4 %); антральный гастрит (поверхностный и эрозивный) – 30 пациентов (44,1 %); дуоденит – 8 человек (11,8 %); язвенная болезнь желудка и ДПК в фазе обострения – 11 пациентов (16,2 %), в фазе ремиссии – 3 пациента (4,4 %).
Среди лиц, страдающих АБП, были выделены следующие подгруппы: пациенты с язвенной болезнью желудка и ДПК, не ассоциированной с Helicobacter pylori (HР); пациенты с язвенной болезнью желудка и ДПК, ассоциированной с HР; пациенты с эрозивным гастритом, ассоциированным с HР, и эрозивным гастритом, не ассоциированным с HР (табл. 1).
Таблица 1. Распределение пациентов с АБП в зависимости от характера поражения гастродуоденальной зоны.
Пациенты с эрозивно-язвеннымидефектами, не ассоциированными сНР, получали ингибиторы протоннойпомпы (омепразол 40 мг/сут), а пациенты с эрозивно-язвенными дефектами, ассоциированными с НР, – стандартную эрадикационную терапию 1-йлинии: омепразол 40 мг/сут + амоксициллин 2000 мг/сут + кларитромицин 1000 мг/сут. Все пациенты с АБПбыли разделены на 2 подгруппы: одна в составе комплексного лечения получала препарат Метадоксил 1500 мг/сут, другая – лишь стандартную терапию.
Всем пациентам проводилось комплексное обследование, включивщее анкетирование и клинический осмотр, фиброэзофагогастродуоденоскопию (ФЭГДС) с прицельной биопсией слизистой оболочки из дистального отдела пищевода, антрального отдела желудка и луковицы ДПК, с последующим гистологическим исследованием биоптатов по общепринятой методике с окраской гематоксилин-эозином. Степень обсемененности слизистой оболочки антрального отдела желудка HР определяли гистобактериоскопически и с помощью уреазного теста
(CLO-тест). Морфологическое и морфометрическое исследования проводились в отделении патоморфологии НИИ акушерства и гинекологииим. Д.О. Отта РАМН (Санкт-Петербург) при консультации заведующего отделением, заслуженного деятелянауки РФ, д.м.н., профессора Кветно
го И.М. Для идентификации эпителиоцитов желудка, иммунопозитивных к синтазе оксида азота(NO-синтаза) и эндотелину-1, использован иммуногистохимический метод. Короткоживущую, биологически активную молекулу оксида азота иммуногистохимически невозможно идентифицировать в тканях. Адекватным показателем активного синтеза этого вещества служит присутствие егоключевого фермента NO-синтазы. Иммуногистохимическое исследование проведено с использованием моноклональных мышиных антител к NO-синтазе (1:150, Novocastra), эндотелину-1 (Sigma, St. Louis, USA, титр 1 : 200). Морфометрический анализ указанных эпителиоцитов проведен с помощью системы компьютерного подсчета микроскопических изображений Nikon. Для статистической обработки результатов исследования использованы критерии достоверности Стьюдента и Манна–Уитни. Проведенное исследование было одобрено этическим комитетом ГОУ ВПО “Саратовский ГМУ им. В.И. Разумовского” Росздрава.
Результаты и обсуждение
Результаты клинико-эндоскопичес-кого обследования алкогольиндуцированной патологии гастродуоденальной зоны у лиц с АБП печени приведены в табл. 2.
Таблица 2. Клинические признаки поражения гастродуоденальной зоны у пациентов с АБП.
Анализ патологии гастродуоденальнойзоны выявил малосимптомность и “стертость” клинических проявлений. По мере углубления патологического процесса впечени клиническая симптоматика ещеболее минимизировалась, уменьшилась интенсивность болевого синдрома. Так, гастралгию пациенты с АЦП отмечали достоверно реже (р < 0,05), чем пациенты с АСГ: 9 (13,8 %) против 18 (25 %) больных. Синдром желудочной диспепсии также зависел от степени алкогольного поражения печени: при АЦП он отмечен у 47,2 % больных, при АСГ – у 41,7 %. Необходимо подчеркнуть, что для пациентов с АБ независимо от характера патологии печени характерно наличие спонтанной рвоты и анорексии.
По результатам эндоскопического исследования у пациентов с АБ в зависимости от характера патологии печени были выявлены различные варианты поражения гастродуоденальной зоны, представленные на рис. 1.
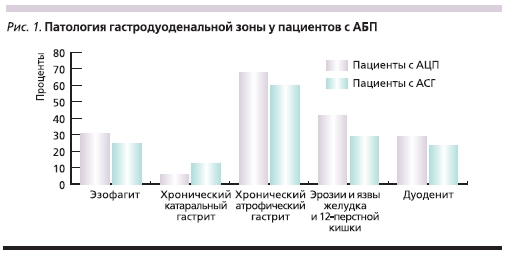
При ФЭГДС картина катаральногоэзофагита достоверно чаще встречаласьсреди пациентов с АЦП – 20 (30,8 %)обследованных, чем среди пациентовс АСГ, – 18 (25 %). Острые эрозии пищевода зарегистрированы не были.
Признаки хронического гастритачаще определялись при АЦП (96,9 %),чем при АСГ (91,7 %). При этом упациентов с АЦП преобладали признаки атрофии слизистой оболочкижелудка, причем очаговый атрофический гастрит отмечен у 38,5 % обследованных, диффузный (мультифокальный) атрофический гастрит – у 36,9 %.Хронический катаральный гастрит былвыявлен лишь у 6,2 % обследованных, апризнаки геморрагического гастрита – у 23,1 %. У пациентов с АСГ признакиатрофии СОЖ были менее выраженными: очаговый атрофический гастрит обнаружен у 27,8 % обследованных,диффузный (мультифокальный) атрофический гастрит – у 31,9 %, поверхностный гастрит – у 12,5 %, признаки геморрагического гастрита – у 19,4 %.Дуоденит выявлен при эндоскопическом исследовании у 17 (23,6 %) пациентов с АСГ, что достоверно реже (р< 0,05), чем у пациентов с АЦП, – 19 пациентов (29,2 %).
Эрозивно-язвенное поражениеслизистой оболочки желудка и ДПКдостоверно чаще (р < 0,05) выявлялось при АЦП (79,9 против 57,0 % при АСГ).Среди пациентов с АСГ и АЦП хронические эрозии и пептические язвыжелудка и ДПК диагностированы у 21(29,2 %) и 27 (41,5 %) больных соответственно, рубцовоязвенная деформация желудка и ДПК – у 8 (11,1 %) и 11 (16,9 %).
Дуоденогастральный рефлюкс регистрировался достоверно чаще (р < 0,05) среди больных АЦП (16 – 24,6 %), чем при АСГ (15 – 20,8 %). Дуоденогастральный рефлюкс – независимый фактор язвообразования: возможно, одной из причин более частого выявления эрозивно-язвенных дефектов слизистой оболочки желудка у пациентов с АЦП является более высокая частота этого рефлюкса.
При сопоставлении клинических проявлений поражения гастродуоденальной зоны с эндоскопической картиной у пациентов, страдающих АБП, бессимптомное течение эрозивно-язвенных дефектов слизистой оболоч-ки эзофагогастродуоденальной зоны при АЦП отмечалось достоверно чаще (р < 0,05), чем при АСГ: 23 (35,4 %) и 11 (15,3 %) обследованных соответственно. При АЦП также достоверно чаще регистрировалось бессимптомное течение хронического гастрита (44,6 против 37,5 %). Синдром желудочной диспепсии без эндоскопических проявлений поражения слизистой оболочки эзофагогастродуоденальной зоны отмечен у 8 (11,1 %) пациентов с АСГ и только у 2 (3,1 %) больных АЦП.
По данным гистобактериоскопического исследования, частота встречаемости HР-инфекции у пациентов с АСГ составила 63,9 %, с АЦП – 80,0 %. Таким образом, при усугублении структурной патологии печени происходило увеличение степени обсемененности слизистой оболочки желудка HР.
Полученные данные можно объяснить тем, что HР способен вырабатывать алкогольдегидрогеназу, с помощью которой он получает из алкоголя в анаэробных условиях необходимуюдля него энергию. При расщепленииалкоголя образуется ацетальдегид, оказывающий повреждающее влияние наслизистую оболочку в результате образования свободных радикалов и усиления процессов перекисного окисления липидов. Это свидетельствует о содружественном неблагоприятном денальную зону, что согласуется с опубликованными в литературе данными [13, 14, 18, 19].
Результаты иммуно-гистохимического и морфометрического исследованийэпителиоцитов желудка представлены в табл. 3.
Таблица 3. Количественная плотность эпителиоцитов желудка, иммунопозитивных к эндотелину-1 и NO-синтазе у пациентов с АБП.
При АБ наблюдается гиперплазия компонентов диффузной эндокринной системы, в частности клеток, иммуно-позитивных к NO-синтазе и эндотелину-1. Необходимо отметить, что более выраженные изменения этих показателей наблюдаются у пациентов с АЦП. В ходе исследования получены данные о тесной корреляционной зависимости количественной характеристики клеток, продуцирующих NO-синтазу и эндотелин-1, с наличием гастрита (r1 = 0,568, r2 = 0,536) и пептических дефектов (r1 = 0,546, r2 = 0,554).
Были выявлены корреляционныесвязи между количественной плотностью эпителиоцитов слизистой оболочки желудка, иммунопозитивных кэндотелину-1 и NO-синтазе, и атрофией слизистой оболочки желудка (r1 = 0,538 и r2 = 0,537).
Очевидно, что нарушение количественной плотности эпителиоцитовслизистой оболочки желудка, иммунопозитивных к NO-синтазе и эндотелину-1, с изменением продукции соответствующих биогенных аминов и гормонов становится значимым факторомподдержания воспаления, регуляцииатрофических изменений слизистойоболочки, а также формирования пептических дефектов гастродуоденальной зоны.
Полученные результаты можно объяснить с позиций физиологическихэффектов гормонов, продуцируемыхклетками слизистой оболочки желудка.Оксид азота – один из наиболее важных биологических медиаторов, участвующих в широком спектре физиологических и патологических процессов. Он регулирует моторику ЖКТ,желудочную секрецию, микроциркуляцию (вазодилатирующий эффект насосуды), оказывает цитопротективное действие на ЖКТ [6].
Эндотелин-1 является мощным ингибитором секреции соляной кислоты и пепсина в желудке, играет определенную роль в процессах регенерации и микроциркуляции. Гиперплазия данных компонентов диффузной нейроэндокринной системы приводит к увеличению перистальтики и снижению тонуса мышц эзофагогастродуоденальной зоны, что в свою очередь усиливает дуодено-гастральный и гастроэзофагеальный рефлюксы.
При небольшом увеличении количеств эндотелина-1 и синтазы оксидаазота в тканях происходят процессывазодилатации, увеличивается проницаемость слизистой оболочки желудка,развиваются диапедез лейкоцитов, отекслизистой оболочки и геморрагии разного объема, что формирует картинугеморрагического эрозивного гастрита. В последующем при увеличении продукции эндотелина-1 происходит подавление действия оксида азота как вазодилататора, нарастает вазоконстрикция сосудов и процессов атрофии.
Результаты комплексного леченияпатологии гастродуоденальной зоныс включением Метадоксила оценивались в динамике через 14 дней отначала терапии. Анализ клиническойкартины уже на 7-е сутки показал, чтов группе пациентов с АБП (АСГ и АЦП) на фоне приема Метадоксилаотмечается купирование гастралгии ижелудочной диспепсии, а также уменьшение спонтанной рвоты и улучшение аппетита (рис. 2).
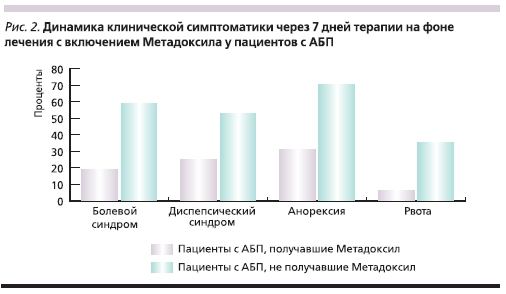
Через 14 дней терапии при ФЭГДСу пациентов с АБП, получавшихМетадоксил, наблюдалась почти полная эпителизация эрозивных дефектов слизистой оболочки, что практически соответствует показателямдинамики эпителизации эрозивно-язвенных дефектов в группе лиц, незлоупотребляющих алкоголем. У пациентов с АБП, которые не принимали Метадоксил, эпителизация эрозийи рубцевания пептических дефектов наблюдалась лишь на 3-й неделе терапии.
Динамика количественной плотности регуляторных факторов – эпителиоцитов, иммунопозитивных кNO-синтазе и эндотелину-1, представлены на рис. 3. При морфометрическом анализе компонентов диффузной эндокринной системы у пациентов с АСГ и АЦП, принимавших Метадоксил, выявлено снижение показателей количественной плотности эпителиоцитов, иммунопозитивных к NO-синтазе, эндотелину-1, мелатонину и глюкагону, по сравнению с исходными данными.
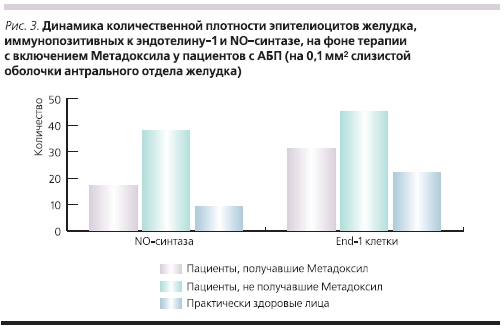
Полученные данные свидетельствуют о высокой эффективностиМетадоксила в комплексном лечении эрозивно-язвенных дефектов приАБП. Препарат обладает не толькогепатотропным действием, связывая ивыводя из организма продукты распадаалкоголя, но и способствует скорейшему заживлению эрозивно-язвенныхдефектов гастродуоденальной зоны, невлияя на обсемененность HР. Однимиз дополнительных эффектов препарата является его позитивное влияниена местный эндокринный гомеостаз в гастродуоденальной зоне.
Выводы
Клинические признаки поражениягастродуоденальной зоны у пациентов со II стадией АБ во многом определяются степенью вовлечения печени впатологический процесс и характеризуются наличием атипичного болевогосиндрома, а также спонтанной рвотыбез предшествующей тошноты и анорексии.
При АЦП эндоскопическая картина гастродуоденальной зоны характеризуется преобладанием атрофических изменений слизистой оболочкижелудка, на фоне которых отмечаются хронические эрозии или пепсические язвы без перифокального воспаления.
Обсемененность слизистой оболочки HР при алкогольных гастропатиях на фоне поражения печени значительно повышается в сравнении спациентами, не злоупотребляющими алкоголем.
Для алкогольиндуцированной патологии гастродуоденальной зоны характерна гиперплазия эпителиоцитов,иммунопозитивных к синтазе оксидаазота и эндотелину-1, что в свою очередь становится фактором риска в формировании и эволюции воспалительных, деструктивных и атрофических изменений гастродуоденальной зоны.
Применение Метадоксила в комплексном лечении эрозивно-язвенныхдефектов слизистой оболочки гастродуоденальной зоны при АБП способствует более быстрой репарации эрозивных дефектов, но не влияет на обсемененность HР.



