Микробы сосуществуют счеловеком в виде сложных многокомпонентных сообществ – биоценозов, и формируют своеобразную экологическую нишу с множеством взаимовыгодных симбиотических отношений. Популяциимикроорганизмов по отдельным биотопам человека хорошо изучены. При этом наиболее густо заселенной экосистемой является кишечник, в которомсконцентрировано около 60 % микрофлоры человека [1].
Микрофлора кишечника человека –довольно устойчивая генетическидетерминированная по многим показателям система. Общая численностьмикробных клеток, колонизирующихорганизм человека, достигает 1014–1015,т. е. их на 1–3 порядка больше собственных клеток хозяина. Верхние отделы тонкой кишки (ТК) в силу своих анатомических особенностей (рецепторы для адгезии преимущественно аэробнойфлоры) незначительно заселены бактериями. В норме содержание микроорганизмов в этом регионе желудочно-кишечного тракта (ЖКТ) колеблется винтервале 101–104 КОЕ/мл кишечного содержимого. Наибольшее количествобактерий находится в толстой кишке. Здесь их концентрация достигает1010–1011 и более на 1 г содержимого. Масса нормальной микрофлоры кишечника взрослого человекасоставляет более 2,5 кг, численность –1014 КОЕ (почти 500 биологическихвидов), а общий геном бактерий –“микробиом” – включает 400 тыс.генов, что в 12 раз больше генома человека [2].
Нормофлору по характеру метаболизма можно разделить на:
• сахаролитическую (бифидобактерии,лактобациллы, пропионобактериии др.), ферментирующую углеводыс выделением короткоцепочечныхжирных кислот (КЖК);
• протеолитическую (протеи, эшерихии, некоторые виды клостридий,фузобактерий, аэробные споровыебациллы и др.), метаболизирующуюбелки и аминокислоты с образованием большого количества аммиака, аминов и других токсических веществ.
По локализации в кишечнике выделяют следующие виды микрофлоры:
• мукозную – плотно связанную смуцином, покрывающим кишечныйэпителий, и являющуюся наиболееважным компонентом в формировании биопленок. Через нее осуществляется постоянный обмен продуктами метаболизма и генетическимматериалом между нормофлорой иорганизмом хозяина;
• пристеночную – неплотно связанную со стенками кишечника;
• просветную – расположенную в просвете и не связанную со стенками кишечника.
Функции микробиоты кишечникамногообразны. Их можно разделить нанесколько направлений:
1. На поверхности слизистой оболочки кишечника микробиота образуетбиопленки, которые являются своеобразным барьером на пути проникновения патогенной и условно-патогенной микрофлоры и ее токсинов в организм человека. Слой слизи,секреторные иммуноглобулины исапрофитная флора представляют собой полноценный надэпителиальный слизистый слой, защищающий слизистую оболочку от дегидратации макромолекул, физической и химической агрессии, а также атак микроорганизмов, бактериальных токсинови паразитов. Бактериостатическоедействие оказывают низкомолекулярные метаболиты сахаролитической микрофлоры, в первую очередь КЖК (пропионовая, масляная,уксусная, муравьиная, молочная идр.), лактат и др. Этот эффект даетвозможность индигенным микроорганизмам заселять соответствующиеэкологические ниши.
2. Присутствие в ЖКТ микроорганизмов стимулирует перистальтику ТК итолстой кишки, опорожнение желудка, сокращает транзитное время дляих содержимого. В основе воздействия микроорганизмов на моторнуюфункцию кишечника лежит несколько механизмов: продукция бактериями микробных простагландинов;изменение метаболизма желчныхкислот с преимущественным накоплением форм, схожих с рициноловой кислотой касторового масла;выработка уксусной, пропионовой имолочной кислот, препятствующихразмножению гнилостных и патогенных микроорганизмов.
3. Исключительно важную роль индигенная микрофлора играет в процессах пищеварения и обмена веществ.Благодаря продукции разнообразныхферментов кишечные бактерии усиливают гидролиз белков, сбраживают углеводы, омыляют жиры, препятствуют микробному декарбоксилированию пищевого гистидина иповышению количества гистамина, участвуют в синтезе аминокислот, витаминов группы В, РР, К, биотина, гормонов, антибиотических идругих веществ. В ряде исследованийполучены доказательства амилазной иказеинолитической активности бифидобактерий и лактобацилл, их участияв метаболизме желчных кислот и ксенобиотиков окружающей среды.
4. Микроорганизмы ЖКТ вмешиваются в холестериновый метаболизм, являются важнейшей метаболической ирегуляторной системой, кооперирующей органы и клетки хозяина вподдержании нормального липидного состава крови. Так, установлено, что бифидобактерии ограничиваютвыход холестерина из гепатоцитов,некоторые штаммы стрептококковусиливают катаболизм холестерина в желчные кислоты.
5. Микробиота пищеварительноготракта участвует в регуляции сорбциии экскреции таких ионов и катионов,как Na, K, Ca, Mg, Zn, Fe, Cu, Mn, P,Cl и др.
6. Детоксицирующая способность индигенной микрофлоры кишечника вполне сопоставима с таковой печени. Эти два основных детоксикационных органа макроорганизмаучаствуют в процессах печеночно-кишечной рециркуляции различныхорганических и неорганических соединений. Принципиальным отличием метаболизма, протекающего вкишечнике, является то обстоятельство, что там доминируют реакциигидролиза и восстановления, тогдакак в печени – окисления и синтеза с образованием водорастворимых продуктов. Ксенобиотики в кишечникемогут подвергаться биотрансформации с образованием нетоксическихпродуктов и изоформ с ускореннойэлиминацией из организма.
7. Бактерии, населяющие толстыйкишечник, участвуют в реализациииммунологических защитных механизмов, в т. ч. антиканцерогенного. Кишечная микрофлора играетактивную роль в индукции пищевойтолерантности к пищевым аллергенам, в основе которой лежит баланс в системе Th1/Th2. Если имеетсясдвиг в сторону преобладания грамположительных микроорганизмов –это фактор риска развития пищевой аллергии, т. к. отсутствует выработкалипополисахаридов (продукт метаболизма грамотрицательных бактерий),ответственных за формированиепищевой толерантности. Другой важный эффект – стимуляция локального иммунитета, в первую очередьон обусловлен усилением секрециисекреторного IgA [3].
Существует ряд факторов, позволяющих поддерживать количественное ивидовое постоянство микробного пейзажа кишечника человека:
• генофонд;
• кислая желудочная среда;
• нормальная моторно-эвакуаторнаяфункция ЖКТ;
• анатомические сфинктеры ЖКТ;
• постоянный уровень внутрипросветного рН в разных биотопах;
• состояние иммунной системы слизистых оболочек;
• бактерицидные вещества, вырабатываемые слизистыми оболочками(лизоцим, лактоферрин и др.);
• фагоцитарная активность макрофагов слизистой оболочки;
• секреторный IgA;
• бактериальные колицины и микроцины (эндогенные пептидные антибиотики микробного происхождения) [4].
Выполнение основных функцийнормальной микрофлоры кишечника может нарушаться при снижении количества или полном исчезновении облигатных ее представителей и увеличениипопуляций условно-патогенных илипатогенных бактерий. Дисбиоз кишечника – это клинико-лабораторный синдром, вторично возникающий при ряде заболеваний и клинических ситуаций,который характеризуется изменениемкачественного и/или количественного состава нормофлоры определенногобиотопа, транслокацией различных ее представителей в несвойственные биотопы, метаболическими иммунныминарушениями, сопровождающимися участи пациентов клиническими симптомами [5].
При увеличении количества условно-патогенной микрофлоры в ТК принято говорить о синдроме избыточного бактериального роста (СИБР; smallintestinal bacterial overgrowth syndrome – SIBOS), который выявляется в 70–95 % случаев хронической патологии кишечника.
Под СИБР понимается патологическое состояние, в основе которого лежит повышенное заселение ТК фекальной или орофарингиальноймикрофлорой, сопровождающееся хронической диареей и мальабсорбцией, впервую очередь жиров и витамина В12.
При СИБР не только увеличивается количество, но и меняется спектр микроорганизмов со сдвигом в сторону грамотрицательных бактерий и анаэробов. У 30 % здоровых людей тощая кишка в норме стерильна, у остальных имеет низкую плотность заселения, которая увеличивается по мере приближения к ободочной кишке итолько в дистальном отделе подвздошной кишки обнаруживается микрофлора фекального типа: энтеробактерии,стрептококки, анаэробы рода бактероидов и др. [6].
СИБР развивается тогда, когда нарушаются гомеостатические механизмы, контролирующие популяцию бактерий в ТК. Чаще всего к избыточному росту бактерий приводят снижение секреции соляной кислоты в желудке и нарушение моторики ТК. Причиной развития СИБР может являться снижение панкреатической и билиарной секреции,несостоятельность илеоцекальногоклапана, нарушение продукции иммуноглобулинов иммунными клетками кишки.
Выделяют несколько патологических механизмов, приводящих к СИБР:
1. Стаз содержимого:
• дивертикулы ТК;
• операция Бильрот II;
• илеальный шунт;
• резекция илеоцекального клапана;
• стриктуры (болезнь Крона и др.);
• патологические коммуникациимежду проксимальными и дистальными отделами кишечника;
• фистулы (желудочно-ободочная, тощекишечно-ободочная).
2. Моторные расстройства:
• псевдообструкция;
• диабетическая нейропатия;
• склеродермия;
• функциональный гастро-, дуоденостаз, стаз содержимого в ТКи толстой кишке (хронические запоры).
3. Снижение кислотообразования:
•хронический атрофический гастрит;
•кислотосупрессивные медикаменты (антациды, Н2-блокаторы, ингибиторы протонной помпы).
4. Прочие факторы:
• панкреатит;
• билиарные дисфункции, желчекаменная болезнь;
• цирроз печени;
• антибиотикотерапия;
• стрессы различного происхождения;
• иммунодефицитные состояния (лучевая и цитостатическая терапия, СПИД);
• нарушения всасывания (мальабсорбция на фоне врожденногодефицита ферментов, глютеновой энтеропатии, энтеритов различнойэтиологии);
• хронический алкоголизм.
Симптомы СИБР достаточно характерны: метеоризм, вздутие живота,абдоминальная боль дистензионногохарактера или дискомфорт, диарея илизапор. Они “наслаиваются” на проявления основного заболевания, ставшего причиной развития СИБР; являются следствием реакции кишечника на продукты метаболизма бактерий.Более тяжелые симптомы указывают наосложнения СИБР, включая мальабсорбцию, дефицит нутриентов и расстройства метаболизма костной ткани.Неспецифичность этих симптомовчасто бывает причиной диагностических ошибок и требует дифференциального диагноза с синдромом раздраженного кишечника (СРК), пищевойинтолерантностью.
Для диагностики СИБР необходимо не только определение абсолютногоколичества бактерий, но и их видовоетипирование, определяющее характерсимптоматики. Если преобладает избыточный рост бактерий, метаболизирующих желчные соли в неконъюгированные или нерастворимые соединения, развивается клиника мальабсорбциижира или диарея, вызванная желчными кислотами. Деконъюгированные желчные кислоты могут оказывать токсический повреждающий эффект на энтероциты, что нарушает ассимиляцию не только жиров, но и углеводов,а также белков. При избыточном ростебактерий, которые преимущественнометаболизируют углеводы в КЖК и газ,в клинике преобладает вздутие кишечника без диареи, поскольку образующиеся продукты метаболизма могутабсорбироваться. Грамотрицательныеколиформы, такие как Klebsiella, продуцируют токсины, которые повреждают слизистую оболочку кишки, нарушают процесс абсорбции и увеличивают секрецию.
Основным компонентом внешней оболочки грамотрицательных бактерий, которые преобладают при СИБР, является липополисахарид (ЛПС), состоящий из иммуногенной полисахаридной части и консервативной липидной, именуемой липидом А.
Липид А – дисахарид с несколькими соединенными цепями необычной гидроксимиристиновой жирной кислоты, определяет токсичность ЛПС, высвобождаясь в кровь; он может вызывать тяжелые токсические последствия вплоть до септического шока. Источником ЛПС в организме человека помимо внешнего заражения является кишечник. Действие многих антибиотиков направлено на повреждение ЛПС. Многие бактерии в процессе жизнедеятельности теряют компоненты внешней мембраны, заново синтезируя их для поддержания морфофункциональной целостности, как, например, Escherichia coli. Высвобождение эндотоксина происходит и при гибели микроорганизмов. В последние годы стало известно, что низкие концентрации эндотоксина в крови необходимы для поддержания физиологической активации иммунной системы [1, 7].
Барьерная функция кишечника предотвращает проникновение потенциально патогенной флоры в кровоток,однако нарушение этого барьера, чтоимеет место при нарушении пассажапо кишечнику, приводит к транслокации ЛПС, а иногда и целых бактерийв близлежащие лимфоузлы и кровь.В результате происходит активация всех основных клеточных функций, связанных с развитием фагоцитоза и представлением антигенов, продукцией NO и свободных форм кислорода, синтезом низкомолекулярных медиаторов воспаления и группы провоспалительных цитокинов, к которымотносятся интерлейкины (ИЛ) – ИЛ-1, ИЛ-6, ИЛ-18, фактор некроза опухолей, интерфероны I типа, хемокины. Кроме того, происходит активация цитокинов, стимулирующих дифференцировку Т-лимфоцитов-хелперов I типа – ИЛ-12, ИЛ-23, ИЛ-27 [8]. Последний процесс служит своеобразным мостиком к началу развития реакций специфического иммунитета, связанных с распознаванием антигенных структур микроорганизмов. Эндотоксин играет важную роль в
регуляции работы иммунной системы,однако при попадании в кровь большихдоз энтеротоксина или при длительном его воздействии может произойтичрезмерно сильная стимуляция иммунитета с выбросом токсической дозыцитокинов. Вышеописанный механизмхронической транслокации эндотоксина в кровь (в систему портальной вены)может стать одной из причин формирования неалкогольного стеатогепатитаили усугублять течение гепатитов иной этиологии.
СИБР следует предполагать у каждого пациента с диареей, стеатореей, потерей веса и макроцитарной анемией, жалующегося на симптомы метеоризма, нелокализованные боли в животе, дискомфорт и неустойчивую функцию кишечника.
“Золотым стандартом” диагностикиСИБР является посев микрофлоры, длячего необходима аспирация содержимого тонкой кишки с посевом аспиратана питательную среду. Но избыточныйбактериальный рост может затрагиватьнаиболее дистальные участки ТК, чтонаходится вне пределов досягаемостиинструментария [9]. На основании характера и количеств микрофлоры в ТК различают три степени выраженности СИБР: I - увеличение аэробной нормальной кишечной микрофлоры (> 105–106 КОЕ/г); II – увеличение аэробной нормальной кишечной микрофлоры и появление анаэробных бактерий (> 106–107 КОЕ/г); III – преобладание анаэробной флоры (обсемененность на уровне 109 КОЕ/г и более).
Посев кала, часто использующийся в нашей стране как метод оценкимикробного биоценоза кишечника,признается малоинформативным, т. к.даже при максимальном приближениик правилам проведения микробиологических исследований может дать представление о микробном составе лишь12–15 типируемых видов бактерий дистального отдела толстой кишки [10]. Существуют и другие методы, основанные на изучении концентрации индикана, продуцируемого индолположительными микроорганизмами, фенола и паракрезола, являющихся метаболитами аэробных (в меньшейстепени) и анаэробных (в большей степени) микроорганизмов, а также способ диагностики состояния микробиоценоза различных биотопов, в т. ч. кишечника, основанный на определении КЖК, являющихся метаболитами в основном анаэробных родов микроорганизмов, методом газожидкостногохроматографического анализа [11]. К непрямым методам относятся тесты, основанные на изучении метаболитов микрофлоры. Наиболее используемым является водородный дыхательный тест (ВДТ) с лактулозой, глюкозой, лактозой и другими сахарами.
Содержание водорода в самом нижнем слое атмосферы – тропосфере – 0,575 ррm (пикамоль), содержание жеего в выдыхаемом воздухе здоровогочеловека – 20–30 ррm и более (исключение составляют некоторые люди,кишечная микрофлора которых продуцирует больше метана или другихгазов, чем водорода). Усиление выделения водорода встречается, когда часть поглощенных углеводов (протеинов) не всасывается или не переваривается в ТК и используется бактериальными колониями толстого кишечника для процессов брожения с выделением водорода. Часть этого водорода всасывается слизистой оболочкой кишечника в кровь и транспортируется в легкие, где выделяется с выдыхаемым воздухом. Таким образом, поглощенные углеводы (D-глюкоза, D-фруктоза, -галактоза, D-ксилоза, Д-лактоза и т.д.) или вещества, схожие с углеводами по молекулярной структуре (сорбитол, ксилит, маннитол и т. д.), вызывают увеличение концентрации водорода в выдыхаемом воздухе при нарушении всасывания или избыточном бактериальном росте в ТК.
ВДТ с лактулозой может применяться для ориентировочного представления о степени бактериального обсеменения ТК. Этот показатель находитсяв прямой зависимости от концентрации водорода в выдыхаемом воздухенатощак. У больных с заболеваниямикишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением ТК, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.При бактериальном обсеменении ТК“пик” нарастания концентрации водорода в выдыхаемом воздухе появляется гораздо раньше.
Преимущества этого теста включают:
• неограниченный доступ к бактериям всех отделов пищеварительноготракта (в отличие от глюкозы, которая позволяет оценивать избыточный рост только в проксимальныхотделах ТК);
• хорошая корреляция между скоростью продукции водорода в пищеварительном тракте и скоростью выделения водорода легкими;
• четкое отграничение метаболическойактивности бактерий и их хозяина.
При помощи ВДТ можно диагностировать:
• увеличение времени транзита углеводов по ЖКТ;
• СИБР;
• мальабсорбцию или мальдегестиюнекоторых углеводов;
• непереносимость лактулозы, сахарозы.
Лактулоза является искусственным синтетическим дисахаридом, состоящим из фруктозы и галактозы, для которого в ЖКТ человека не существует фермента, чтобы разложить его на моносахариды. Концентрация водорода (Н2) в выдыхаемом воздухе при ВДТ с лактулозой может иметь несколько графиков:
• нормальный – в ТК лактулоза неразлагается, при достижении толстого кишечника она подвергается
брожению с выделением водорода,который всасывается в кровь и выделяется с выдыхаемым воздухом;
• патологический – при избыточном бактериальном росте лактулоза подвергается брожению уже в ТК, концентрация водорода достигает максимума раньше.
ВДТ с лактулозой является наиболее распространенным неинвазивным тестом для определения временикишечного транзита углеводов. Раннийпик концентрации Н2 говорит о СИБР,задержка роста концентрации Н2 указывает на удлинение времени кишечного транзита.
Мы обследовали 62 пациента (41 женщину и 21 мужчину) в возрасте 31,0± 12,1 года с жалобами на метеоризм, неустойчивый кашицеобразный или жидкий стул, боли в животе, уменьшающиеся после дефекации, слабость;часть больных отметили похуданиена несколько килограммов за последние месяцы, ломкость ногтей и волос,сухость кожи, заеды, нарушение сна.Кроме того, 72,5 % (45 пациентов) прежде неоднократно обращались к гастроэнтерологу или терапевту с описаннымижалобами. Им назначались исследование кала на дисбактериоз и специфические инфекции (бактериологическоеисследование), ирригоскопия, ректо- и/или колоноскопия – патологии при бактериологических и рентгенологическихисследованиях не было обнаружено.Приэндоскопических исследованияхтолстой кишки у части больных в описании присутствовали минимальные признаки катаральных воспалительныхизменений слизистой оболочки илипатология не обнаруживалась. Больнымвыставлялся диагноз СРК, адекватная терапия не проводилась.
Всем пациентам был проведен ВДТ с лактулозой (прибор Gastrolyzer 2 производства Bedfont scientific LTD; Великобритания). У 54 больных (87 %) концентрация водорода была повышена в базовом выдохе (13 ppm) и достигала максимума в течение первого часа (от 26 до 68 ppm), постепенно снижаясь. Причины – весь субстрат (лактулоза) абсорбировался и ферментировался или только ферментировался водородпродуцирующими бактериями в ТК, субстрат не попадал в толстую кишку. В этом случае мы ставили диагноз СИБР. У 8 пациентов концентрация водорода достигала первого максимума в течение первого часа (от 18 до 42 ppm) и второго пика (от 31 до 49 ppm) после первого часа, затем снижалась. Причины – часть вещества была ферментирована в ТК, другая – в толстой кишке с выделением в обоих вариантах водорода. В данном случае наблюдался СИБР, при котором увеличивалось время пребывания химуса в ТК.
После обследования всем пациентамназначалось лечение: антибактериальные средства – рифаксимин (Альфа нормикс) по 400 мг 2 раза в сутки 6 дней,при необходимости назначались ферменты и селективные спазмолитики –мебеверина гидрохлорид (Дюспаталин)по 200 мг 2 раза в день или пинавериябромид (Дицетел) по 50 мг 2 раза в деньв течение 2 недель. После курса анти-
бактериальной терапии назначалисьпробиотик Линекс 2 капсулы 2–3 раза вдень в течение трех недель и пребиотиклактулоза (Дюфалак) по 5 мл 2 раза вдень в течение 3 месяцев.
В динамике после лечения у всех пациентов купировались полностью (68 %) или значительно уменьшились (32 %) симптомы кишечной диспепсии и боли, стабилизировался вес. Показатели ВДТ с лактулозой нормализовались у 60 пациентов (96,7 %), у двоих значительно улучшились. Пациентам, у которых при нормальных показателях ВДТ с лактулозой не купировались полностью болевой и диспепсический синдромы, выставлялся диагноз СРК и проводилась терапия антидепрессантами с хорошим результатом.
Лактулоза является классическим активным пребиотиком или бифидусфактором, уникальным углеводом, присутствующим в женском молоке. Лактулоза впервые была синтезирована и описана Хадсоном и Монтгомери в 1929 г. Получили ее при исследовании структуры дисахаридов путем термообработки лактозы щелочным раствором. В 1948 г. Петуэли Ф. и Кристан Ж. выделили из женского молока вещество, активизирующее рост бифидобактерий, и не зная его строения, определили как бифидус-фактор. Считается, что первые попытки использования лактулозы в медицинской практике относятся к 1951 г., когда бифидус-фактор применили для лечения детей с энтеритами. В 1957 г. Петуэли Ф. установил корригирующее действие лактулозы на микробиоценоз кишечника новорожденных, находящихся на искусственном вскармливании. У малышей удалось поднять популяционный уровень бифидобактерий от почти нулевого значения до 80–100 % [12]. И только в 1957 г., спустя почти 30 лет после открытия Хадсона и Мотгомери, Петуэли Ф. сделал сообщение об определении химического строения бифидус-фактора как углевода из группы дисахаридов и назвал его лактулозой.
Лактулоза относится к дисахаридам,имеет химическую формулу С12Н22О11и молекулярную массу 342,3. Молекулалактулозы состоит из остатков молекул галактозы и фруктозы, соединенных глюкозидной связью. В 1959 г.Майерхофер Ф. и Петуэли Ф. указалина слабительный эффект лактулозы,назвав ее “идеальным слабительнымсредством для детей младшего возраста”. Было установлено, что при вскармливании младенца детскими смесямиили молоком с добавлением 5 %-нойлактозы содержание Bifidobacterium в фекальной микрофлоре составляет 20 %. Однако при добавлении 2 %-ной лактулозы в молоко этот показатель возрастал до 90 %. С 1960 г. голландская компания “Филлипс-Дюфар” начала производство препарата лактулозы в виде сиропа.
По имеющимся данным, мировоепроизводство препаратов лактулозы достигает 20 тыс. т в год, для чего используется более 5 % вырабатываемого молочного сахара (лактозы). Ассортиментпрепаратов лактулозы насчитываетсвыше 100 наименований. В настоящеевремя в мире производится ряд продуктов детского, лечебно-диетического и гериатрического питания с лактулозой.На основании результатов обширныхмноголетних исследований в Япониив 1992 г. лактулоза получила официальный статус специальной пищевойдобавки, способствующей сохранению здоровья, и была включена в “золотой список”, состоящий из 12 ингредиентов пищевых продуктов, укрепляющих здоровье нации [13–15].
В 1996 г. проходил международный симпозиум, посвященный 30-летию применения лактулозы для лечения терапевтических больных. Символично название симпозиума – “Лактулоза – 30 лет спустя: управление флорой толстой кишки как экосистемой и метаболическим органом: последствия для организма”.
В толстой кишке лактулоза является идеальным питательным субстратом для сахаролитических бактерий (бифидо- и лактобактерий), которые быстро растут и размножаются в ее присутствии. Такие потенциально патогенные микроорганизмы, как кишечная палочка, клостридии и сальмонеллы, с трудом метаболизируют лактулозу. В такой ситуации соперничество в утилизации питательных веществ приводит к угнетению протеолитической потенциально патогенной кишечной микрофлоры, продуцирующей токсины.
При сбраживании лактулозы бактериями происходит “закисление”содержимого толстой кишки, что препятствует размножению гнилостныхбактерий. Немаловажным в подавлении патогенных и условно-патогенныхмикроорганизмов является бифидогенное действие лактулозы. Бифидои лактобактерии способны продуцировать КЖК, которые сами по себеобладают антимикробным действием. Выявлена четкая корреляционнаясвязь между концентрацией жирныхкислот и численностью популяцийклебсиелл, протея, шигелл. Жирные кислоты – один из важнейших механизмов устойчивости к колонизации клостридий. Антагонизм бифидобактерий в отношении патогенных бактерий обусловлен продукцией бактериоцинов – низкомолекулярных пептидов, составляющих относительно новую группу “естественных” антибиотикоподобных веществ. В эксперименте и клинике показаны лечебный и профилактический эффекты бактериоцинов при сальмонеллезах, шигеллезах, листериозах, энтерокококкозах, криптоспоридиозах, амебиазе [16].
Лактулоза сначала гидролизируется до органических кислот (уксусной, молочной, пропионовой, масляной), известных как КЖК. Разложение до КЖК повышает осмотическое давление в просвете кишки. Поэтому лактулоза действует как осмотическоеслабительное, стимулируя транзит потолстой кишке, тем самым снижаетсявремя контакта инфекционных агентови их метаболитов со слизистой оболочкой толстой кишки, что облегчает элиминацию микробов и их токсиновиз организма.
Среди препаратов лактулозы наиболее распространено лекарственное средство Дюфалак® (Abbott Products).В настоящее время установлено, чтолактулоза (Дюфалак) является препаратом первого выбора для лечениязапоров у детей и взрослых, у больныхпожилого возраста и у тяжелобольных,что подтверждено данными последних исследований [17]. Применение препарата Дюфалак показано женщинам во время беременности и родов, при аноректальной патологии, т. е. во всех случаях, когда необходимо стимулировать дефекацию, получить мягкий стул, уменьшить продолжительность и степень натуживания. Так, применение препарата Дюфалак у больных соматической патологией и физическими дефектами приводит к достоверному уменьшению времени дефекации (с 28 до 10 минут), значительно улучшая показатели качества жизни у данных больных. Положительный эффект достигается и у пациентов с запущенным хроническим запором, а также явлениями недержания кала [18]. По имеющимся в литературе данным, применение препарата Дюфалак более чем в 10 раз снижает потребность в применении клизмы у родильниц, а в 45 % случаев приводит к безболезненной первой дефекации после операции по поводу геморроя.
Положительное действие лактулозы(Дюфалака) этим не ограничивается.Как уже было указано выше, карбоновые КЖК, обладая непосредственнымположительным влиянием на эпителий толстой кишки и всасываясь в портальную систему, используются гепатоцитами в качестве питательных веществ, обладающих энергетическим действием.
Кроме того, лактулоза уменьшаетпродукцию аммиака за счет:
• снижения его уровня в подвздошнойкишке в результате связывания молекул аммиака лактулозой;
• подавления протеолитической флоры и образования аммиака в толстойкишке за счет подкисления содержимого;
• ингибирования разложения мочевины бактериями и уменьшения уровняаммиака как продукта разложения;
• его утилизации сахаролитическимибактериями и кишечной стенкой;
• стимуляции бактерий, связывающихаммиак в процессе белкового синтеза;
• его ускоренной элиминации из кишки с калом в толстом кишечнике.
Все это оказывает несомненное гепатопротекторное действие, предупреждая поражение печени (жировая дистрофия, реактивный гепатит при хроническом запоре в сочетании с дисбактериозом) или корригируя явления портосистемной энцефалопатии у больных с явлениями печеночно-клеточной недостаточности при циррозе печени. Известно, что нормализация функции печени и экскреции желчи приводит к стимуляции моторной активности кишечника и может оказывать корригирующее действие на явления хронического запора любой этиологии, т. к. нормализация желчеотделения и пищеварения в целом является самым эффективным естественным средством регуляции моторной активности кишки, средством профилактики запора.
Особенно показано применение лактулозы (Дюфалака):
• при СРК;
• у больных хроническими заболеваниями печени с синдромом портальной гипертензии, ассоциированными с хроническим запором;
• в педиатрической практике у детейвсех возрастных групп;
• у пожилых и лиц старческого возраста;
• при хроническом запоре на фонесахарного диабета и нарушеннойтолерантности к глюкозе;
• при желчекаменной болезни;
• у беременных, женщин в послеродовом периоде, у матерей, кормящихгрудью;
• на фоне приема антибиотиков ихимиопрепаратов;
• у больных сальмонеллезом;
• при микозах кишечника;
• у женщин после гинекологическихопераций;
• при почечной недостаточности;
• при медикаментозных запорах;
• при хроническом запоре у больныхна постельном режиме и при гиподинамии, в т. ч. у недавно прооперированных;
• у больных с выраженной соматической патологией и физическимидефектами;
• у пациентов, страдающих рассеянным склерозом;
• при параплегии;
• у больных нейрогенным запором;
• при дивертикулярной болезни;
• при спаечных процессах в брюшнойполости;
• при проктогенных запорах различного генеза.
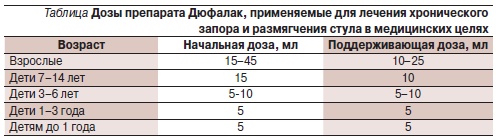
Лактулоза (Дюфалак) выпускаетсяв виде сиропа. Применяется обычновнутрь по 15–30 мл (начальная доза)1 раз в день утром ежедневно. В дальнейшем доза может быть изменена всторону увеличения или уменьшенияв зависимости от получаемого эффекта (частоты и характера стула). Какправило, оптимальная доза препаратаподбирается самим больным так, чтобымягкий стул был ежедневно, при портосистемной энцефалопатии максимально – 2–3 раза в день. Примерныедозы препарата Дюфалак для лечениязапоров и размягчения стула приведены в таблице. Обычно эффект от приема препарата Дюфалак возникает навторой-третий день терапии, но нередко стул появляется и через несколькочасов. На время возникновения клинического эффекта влияет состояние исходной микрофлоры толстой кишки. При наличии нормального количества сахаролитической микрофлоры слабительный эффект от приема Дюфалака натощак может возникнуть уже через один-два часа. При недостатке в кишечнике расщепляющей лактулозу флоры эффект от приема препарата возникает через один-два дня, во время которых образуется достаточное количество флоры и метаболитов препарата, вызывающих соответствующий слабительный эффект.
При СРК с явлениями запораДюфалак назначается в случае отсутствия эффекта от применяемых диетических мер.
При длительном применении препарата и избыточном бактериальномросте в кишечнике, когда лактулозаиз-за инактивации бактериями превращается во всасываемые вещества с утратой осмотического эффекта, необходимо корригировать терапию, своевременно подбирая адекватную дозу для достижения слабительного эффекта.
При постоянном лечении некоторымпациентам подчас достаточно нескольких приемов Дюфалака в неделю. Приэтом у 89 % больных полностью восстанавливаются физиологические параметры дефекации. Обычно курс лечениясоставляет около двух месяцев, послекоторых возможна полная отмена приема препарата.
Таким образом, применение лактулозы (Дюфалака) несомненно показано при хроническом запоре, особенно когда базисная диетотерапия дает неудовлетворительный эффект.
Особенно рекомендуется Дюфалак (препарат выбора) детям, беременным и при хронических заболеваниях печени [19]. В целом слабительные детям (за исключением препаратов лактулозы) назначаются не более чем на 10–14 дней [20], что обусловлено большим количеством побочных эффектов большинства из них. Доза Дюфалака при лечении хронических запоров у детей подбирается индивидуально – в зависимости от возраста и выраженности констипации. Обычно начинают с 5 мл сиропа 1 раз в день с последующим увеличением дозы (на 5 мл каждые 3–4 дня) до достижения нормального стула. Максимальная суточная доза – 60 мл. Кратность приема дюфалака составляет от 1 до 3 раз в день (чаще в два приема). Продолжительность лечения не ограничивается (чаще 1–2 месяца), а отмена препарата производится постепенно. Возможно применение Дюфалака у недоношенных детей, а также на первом году жизни [21].
В последнее время в России проблема дисбиоза (дисбактериоза кишечника) начала рассматриваться клиницистами с позиций, принятых в международной медицинской практике. Пересматриваются и научно обосновываются пути нормализации микрофлоры кишечника, где на первое местовыходят про- и пребиотики, а не биотерапевтические агенты, бактериофаги или антибиотики.
При этом важно подчеркнуть, что, когда у пациента диагностируется СИБР, в коррекции этого состояния кроме селективной деконтаминации патогенной и условно-патогенной микрофлоры (при необходимости) необходимо восстановливать нормальный микробный пейзаж. В этом случаенаиболее эффективным методом является назначение пробиотиков в кишечнорастворимой оболочке вместе с пребиотиком лактулозой (Дюфалаком),которая является “продуктом” для роста и восстановления нормальногобиоценоза кишечника человека, обеспечивающего его здоровье и благополучие.



