Введение
Азтреонам – единственный разрешенный к клиническому применению β-лактамный антибиотик из группы монобактамов, был впервые выделен из культуры Cromobacterium violaceum. В настоящее время азтреонам получают исключительно путем химического синтеза.
Препарат уникален прежде всего спектром активности, а также стабильностью к β-лактамазам, особой фармакокинетикой и низкой токсичностью. Механизм действия в принципе аналогичен таковому других β-лактамов. Азтреонам избирательно взаимодействует с пенициллинсвязывающим белком-3, который является ферментом – транспептидазой, участвующей в завершающем этапе синтеза клеточной стенки бактерий и соединяющей пептидогликаны в единую структуру биополимера [1, 2].
Для азтреонама характерна избирательная активность в отношении грамотрицательных аэробных бактерий. Область клинического применения довольно велика, несмотря на “узость” спектра. Из-за активности в отношении полирезистентных микроорганизмов, продуцирующих β-лактамазы, которые разрушают цефалоспорины и пенициллины, азтреонам демонстрирует высокую клиническую эффективность в лечении инфекций, вызванных грамотрицательными бактериями, включая P. aeruginosa и K. pneumoniae. Низкая токсичность предупреждает развитие ряда серьезных нежелательных реакций и делает возможным использование антибиотика в педиатрии.
Спектр активности
Для азтреонама характерна селективная активность в отношении грамотрицательных аэробных бактерий, в т. ч. резистентных к цефалоспоринам и аминогликозидам. Он демонстрирует выраженный бактерицидный эффект в отношении устойчивых к тобрамицину Enterobacter spp., Klebsiella spp., Serratia spp., Proteus spp. (индолпозитивных) и P. aeruginosa [3]. Бактерицидная активность антибиотика сохраняется в диапазоне рН от 6 до 8, а также в анаэробных условиях. В табл. 1 представлен спектр действия азтреонама в отношении важнейших аэробных и анаэробных бактерий.

Для большинства энтеробактерий минимальная подавляющая концентрация (МПК) азтреонама не превышает 0,1 мг/л, однако для некоторых штаммов Enterobacerspp. и Citrobacterspp. МПК > 8 мг/л.
Несмотря на то что спектр действия азтреонама не распространяется на грамположительные кокки (МПК > 100 мг/л), антагонизма в комбинациях с другими антимикробными препаратами, активными в отношении этой группы микроорганизмов, не наблюдается [5]. К ряду штаммов стрептококков групп В и D отмечен синергизм действия в комбинациях азтреонам + клиндамицин, азтреонам + ампициллин и азтреонам + цефокситин.
В табл. 2 представлены эффекты комбинаций различных антибиотиков с азтреонамом. В основном наблюдался синергидный и аддитивные эффекты. Антагонизм действия в отношении Enterobacter spp. описан при сочетании азтреонама с цефокситином [6]. Отчасти этот феномен объясняется индукцией синтеза хромосомных β-лактамаз цефокситином.
Таблица 2. Эффекты комбинаций антибиотиков различных групп с азтреонамом [2–15].
Фармакокинетика
Азтреонам вводится внутримышечно или внутривенно [16]. После внутривенного и внутримышечного введений бактерицидные концентрации препарата определяются во многих тканях и органах. Степень связывания с альбуминами плазмы крови составляет 56 % (табл. 3). Этот относительно низкий по сравнению с другими β-лактами показатель благоприятствует скорейшему распределению антибиотика в тканях.
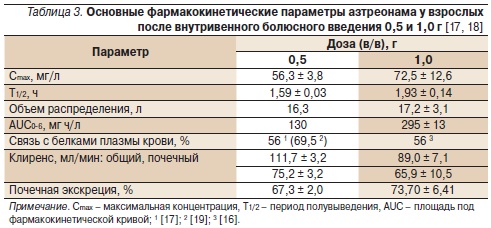
После внутримышечной инъекции максимальные концентрации в сыворотке после введения 0,5 г препарата наблюдаются через час и составляют 21,0 ± 1,3 мг/л. Через 4 часа концентрации снижаются до 8,6 мг/л. Период полувыведения равен 1,7 ± 0,1 часа (табл. 4).

Согласно Swabb E. и соавт. [16], при многократных внутривенных и внутримышечных введениях кумуляции препарата не наблюдалось.
Большая часть от введенной дозы антибиотика – от 62 до 74 % – выводится в течение первых 8 часов путем клубочковой фильтрации и канальцевой секреции в неизменном виде. Высокие – в 10–300 раз превышающие МПК для чувствительных микроорганизмов – концентрации антибиотика в моче в течение 24 часов после однократной инъекции являются фармакокинетическими предпосылками к эффективной эрадикации уропатогенов при инфекциях мочевыводящих путей (МВП). Элиминация с желчью составляет около 12 % от введенной дозы. В печени часть препарата трансформируется в неактивную субстанцию с открытым β-лактамным кольцом – SQ 26.992, а часть выводится с желчью в неизменном виде [19].
Creasey W.A. и соавт. [20] не отметили каких-либо особенностей в распределении и элиминации азтреонама у пожилых лиц. Naber K. и соавт. [21] сообщают о более продолжительном Т1/2, равном 2,7 часа, у больных старше 70 лет.
Фармакокинетика азтреонама у детей от 2 до 12 лет с нормальной функцией почек практически не отличается от таковой у взрослых. Для новорожденных и детей первого года жизни характерны увеличение периода полувыведения (от 2,56 ± 0,20 часа у новорожденных с массой тела более 2,5 кг до 5,71 ± 1,63 часа у новорожденных с массой тела менее 2,5 кг) и значения AUC, относительно низкие показатели общего клиренса и более высокие показатели объема распределения. Как и у взрослых, основной путь элиминации азтреонама у детей – почечный, путем гломерулярной фильтрации и канальцевой секреции (69–74 % от введенной дозы). Неактивный метаболит SQ 26.992 частично выводится с желчью, частично с мочой; содержание его в моче в среднем составляет 4–5 % от введенной дозы [22].
Азтреонам хорошо проникает в различные органы и ткани. Скорость и степень диффузии зависят от структуры и гидрофильности тканей [23]. Через час после 30-минутной инфузии 2 г антибиотика здоровым добровольцам в цереброспинальной жидкости (ЦСЖ) обнаруживали от 0,14 до 0,69 мг/л препарата. Сmax, определяемая через 4,0–4,5 часа, варьировалась от 0,83 до 1,28 мг/л [24]. Всего через гематоэнцефалический барьер проникает до 1,5 % от введенной дозы. При воспалении пенетрация азтреонама в ЦСЖ повышается. Через час после внутривенного введения концентрации антибиотика в ЦСЖ у больных с менингитом превышают таковые в группе без воспаления мозговых оболочек в 4 раза (1,98 ± 3,44 мг/л). Сmax составляет 3,22 ± 2,99 мг/л. Пенетрация препарата достоверно выше у больных бактериальным менингитом, чем на фоне вирусной этиологии воспаления. У детей через час после внутривенного введения антибиотика в дозах 34 и 71 мг/кг концентрации азтреонама в ЦСЖ составляли 0,31 и 0,42 мг/л соответственно при асептическом и 6,9 мг/л – при гнойном менингите (после введения в дозе 100 мг/кг). В фазу разрешения гнойного воспаления пенетрация антибиотика снижается [25].
По данным Winslade N.E. и соавт. [27], у больных абдоминальным сепсисом отношение концентраций азтреонама в перитонеальном эксудате к сывороточным составило 0,95 : 1,00, тогда как для тобрамицина данный показатель был достоверно ниже – 0,46 : 1,00. Еще одно положительное свойство азтреонама связано с хорошей пенетрацией через капсулу абсцессов брюшной полости и способностью поддерживать в их содержимом эффективные бактерицидные концентрации в течение 8–12 часов после парентерального введения [28].
Сmax азтреонама в желчи из общего желчного протока, достигаемая через час после внутривенного введения 2 г, составляет в среднем 362,5 мг/л. В желчи, взятой из желчного пузыря, Сmax, равная 292,2 ± 125,6 мг/л, определяется через 4 часа. В стенке желчного пузыря значения концентраций через 1, 2 и 4 часа составили 27,1, 11,7 и 2,8 мг/л соответственно [29, 30]. У больных механической желтухой содержание азтреонама в желчи значительно ниже – Сmax в среднем 42,9 мг/л. В стенке тонкого кишечника (2 г азтреонама внутривенно болюсно) концентрации через 1, 2 и 4 часа составляли соответственно 5,2, 7,5 и 11,2 мг/л; в стенке толстого кишечника через 1 и 2 часа – 13,1 и 11,7 мг/л соответственно [30]. Достаточно высокое содержание препарата определялось в печени (до 65,4 мг/л) и большом сальнике (32,9 мг/л) [30].
Азтреонам быстро проникает в кожу – через час после внутривенного введения 1 г антибиотика его концентрации в дерме составляли половину от сывороточных [18]. Cmax в дерме, равная 25,4 ± 5,9 мг/л, достигается через 1,8 часа после инъекции, а Т1/2 равен 2,4 ± 0,14 часа [18].
Азтреонам хорошо проникает в синовиальную оболочку, синовиальную жидкость и кости. По данным MacLeod C.M. и соавт. [31], после внутривенного введения 2 г препарата его концентрация в синовиальной жидкости составляла в среднем 83,0 ± 9,2 мг/л (99 % от сывороточной), а в губчатой кости – 16,0 ± 4,3 мг/л (20 % от сывороточной).
По данным Beam T.R. и соавт. [26] и Berthelot G. и соавт. [32], высокая пенетрация азтреонама в органы репродуктивной системы у женщин обеспечивает бактерицидные концентрации по крайней мере в течение 3–4 часов после инъекции.
Азтреонам проникает через плаценту. Трансплацентарный переход, определяемый как отношение концентраций антибиотика в венозной крови из пупочного канатика к концентрациям в материнской крови, составляет от 27 до 33 % (через 30 минут после внутривенного введения 1 г) [32]. Характерно, что концентрации в амниотической жидкости достоверно выше, чем в крови из пупочного канатика, медленно нарастают и через определенный промежуток времени превышают содержание препарата в сыворотке матери. Через 2 часа после внутривенного болюсного введения 1 г азтреонама в крови и тканях плода, находящегося на ранних сроках гестации, концентрации антибиотика были за пределом минимальной разрешающей способности жидкостного хроматографа.
Диффузия азтреонама в грудное молоко у женщин в период лактации сравнительно мала – через два часа после внутривенной инъекции 1 г препарата концентрации не превышали 0,2 мг/л, а через 6 часов колебались от < 0,4 до 1,0 мг/л [33].
Особенности фармакокинетики у тяжелых больных
По данным McKindley D.S. и соавт. [34], у тяжелых больных с политравмой и вентилятор-ассоциированной пневмонией отмечен более высокий объем распределения азтреонама, из чего следует необходимость в более высокой дозе антибиотика для поддержания бактерицидных концентраций как в сыворотке, так и в ткани легкого.
У тяжелых ожоговых больных также отмечено увеличение объема распределения антибиотиотика примерно на 30 % по сравнению с аналогичными показателями у здоровых добровольцев, что приводит к более быстрому снижению сывороточных концентраций. По мнению Friedrich L.V. и соавт. [35], у ожоговых больных необходимо увеличивать разовую дозу, но не интервал между введениями.
Клиническое применение
Спектр клинического применения азтреонама чрезвычайно широк. Прежде всего это инфекционные процессы любой локализации, в этиологии которых преобладают грамотрицательные аэробы: инфекции МВП и нижних дыхательных путей (НДП), интраабдоминальные и гинекологические инфекции, инфекции мягких тканей, костей и суставов, сепсис.
По данным Smith G. и соавт. [36], эффективность азтреонама в лечении тяжелой грамотрицательной инфекции (из 38 случаев 23 – бактериемии) составила 92 %.
Norrby R. [37] представил мета-анализ 20 клинических исследований по оценке эффективности азтреонама в лечении инфекций МВП (165 случаев) и НДП (99 случаев), бактериемий (40 случаев). Сообщается о высокой общей клинической эффективности – 91,5 % (в частности, при инфекции НДП – 86 %). Причиной суперинфекции в основном были грамположительные кокки (37 случаев).
По результатам другого, более обширного мета-анализа, включившего 2821 пациента с грамотрицательными инфекциями, из которых 2117 получали азтреонам, а 704 – другие антибиотики, эффективность терапии азтреонамом составила: при инфекциях МВП – 82 %, инфекциях НДП – 79 %, септицемии – 98 %, инфекциях кожи и мягких тканей – 88 %, интраабдоминальной инфекции – 85 %, гинекологических инфекциях – 100 %, неосложненной гонорее – 97 %, при инфекциях костей и суставов – 100 % [38].
Доказано, что не только внебольничные, но и нозокомиальные грамотрицательные инфекции самой различной локализации и тяжести, в т. ч. у больных с нарушениями иммунного статуса, являются показанием к терапии азтреонамом. Согласно Cristiano P. и соавт. [39], при использовании препарата в режиме 4–6 г внутривенно каждые 8–12 часов его клиническая и бактериологическая эффективность у пациентов с нозокомиальной инфекцией на фоне иммунодефицита составила 80 и 88 % соответственно; в ходе лечения отмечены хорошая переносимость антибиотика и отсутствие серьезных нежелательных реакций.
Очевидны преимущества азтреонама в лечении нозокомиальных грамотрицательных инфекций МВП, поскольку монобактам не оказывает нефротоксического действия, а его микробиологическая эффективность выше, чем у традиционных аминогликозидов [40].
Инфекции ЦНС
Эффективность препарата в лечении бактериального менингита, вызванного грамотрицательными аэробами, у детей и взрослых подтверждена результатами клинического исследования. Согласно Lentnek A.L. и соавт. [41], при использовании азтреонама в следующих режимах: 2 г внутривенно 4 раза в сутки у взрослых, 50 мг/кг внутривенно 4 раза в сутки у детей старше 2 лет и 30 мг/кг 4 раза в сутки – у детей до 2 лет, клинический эффект достигнут у всех 122 пациентов (100 %); эрадикация возбудителей (H. influenzae, Pseudomonas spp., N. meningitides, Enterobacteriaceae) наблюдалась в 97 % случаев.
Инфекции НДП
По данным одного из первых рандомизированных проспективных исследований, клиническая эффективность азтреонама в лечении тяжелых нозокомиальных пневмоний у пациентов отделений реанимации и интенсивной терапии (ОРИТ) составила 93 % (для сравнения: тобрамицин был эффективным только в половине случаев). Отмечена высокая микробиологическая эффективность: в 92 % достигнута эрадикация возбудителей [42].
Согласно Swabb E.A. и соавт. [43], в лечении 226 пациентов с инфекцией НДП, в т. ч. 181 – с пневмонией различной тяжести, клиническая и микробиологическая эффективность азтреонама (1–2 г внутривенно каждые 8 часов) составила 93 и 78 % соответственно.
Отмечены минимум сходные результаты лечения тяжелых нозокомиальных пневмоний комбинациями азтреонам + цефотаксим и амикацин + цефотаксим [44].
По данным Polk H.C. и соавт. [45], положительная динамика и меньшее число побочных эффектов более отчетливо прослеживались в группе пациентов с политравмой и нозокомиальной пневмонией, получавших азтреонам + клиндамицин, в сравнении с группой, получавшей имипенем + циластатин. Результаты сравнительного рандомизированного исследования различных режимов в лечении нозокомиальной пневмонии у онкологических больных, представленные Raad I. и соавт. [46], демонстрируют сходную эффективность азтреонама с клиндамицином (86 %) и пиперациллина/тазобактама (83 %)
На основании данных, полученных в ходе сравнительного контролируемого рандомизированного исследования, подтвердивших эффективность и хорошую переносимость азтреонама (в комбинациях с клиндамицином или антистафилококковыми антибиотиками), Bjornson H.S. и соавт. [47] рекомендуют включать данный антибиотик в схемы терапии инфекций НДП, вызванных грамотрицательными бактериями.
Помимо пневмоний азтреонам следует рассматривать как антибиотик резерва для лечения других бактериальных инфекций НДП: обострений хронических бронхитов, бронхиолитов и бронхоэктатической болезни [48].
Инфекции МВП
С момента начала широкого клинического применения азтреонам вызывает интерес у специалистов, занимающихся лечением инфекций МВП. Основными возбудителями осложненных и неосложненных инфекций МВП являются патогенные энтеробактерии – E. coli, Klebsiella spp., Proteus spp., Pseudomonas spp. Высокие концентрации препарата в моче и активность в отношении большинства энтеробактерий, в т. ч. устойчивых к другим антибиотикам, обеспечивают быструю эрадикацию микроорганизмов и высокую клиническую эффективность монотерапии [49]. В ранних исследованиях, как правило, оценивали клинико-бактериологическую эффективность азтреонама в лечении самых различных инфекций МВП – от острого цистита до пиелонефрита – у больных с различными фоновыми урологическими заболеваниями. Сообщается, что выздоровление с эрадикацией возбудителей наблюдалось в 80–100 % среди больных с осложненным циститом, 83–100 % – с пиелонефритом и 63 % – с простатитом [50]. Все авторы отмечали хорошую переносимость терапии, отсутствие нефротоксического действия антибиотика и других нежелательных реакций, которые бы требовали отмены препарата. В основном использовали азтреонам в режиме 1 г внутримышечно 2 раза в сутки в течение 14–28 дней.
Опираясь на результаты клинического исследования, Cox C.E. [49] считает, что парентеральная терапия азтреонамом в режиме 1 г внутривенно или внутримышечно 3 раза в сутки является оптимальной при осложненной инфекции МВП, вызванной полирезистентными бактериями.
Согласно Childs S.J. [51], азтреонам показан к лечению нозокомиальных инфекций МВП. Аргументами в пользу выбора антибиотика-монобактама явились высокая бактериологическая эффективность: в целом эрадикация грамотрицательных возбудителей наблюдалась у 91 % пациентов (в случаях, вызванных P. aeruginosa инфекций, этот показатель составил 93 %), а также отличная переносимость терапии.
По данным мета-анализа, проведенного Swabb E.A. и соавт. [52] и включившего 8 рандомизированных исследований, а также 681 больного, самыми “популярными” схемами лечения инфекций МВП с использованием азтреонама были однократная внутримышечная инъекция при неосложненном остром цистите, а также 5-дневные и более длительные курсы, предусматривающие внутривенное или внутримышечное введение антибиотика в дозе 1 г дважды или трижды в сутки при терапии пиелонефритов, орхоэпидидимитов и простатитов. В целом микробиологическая эффективность одно- и многодозовых режимов составила 85 и 84 % соответственно. Анализ данных многоцентрового исследования, проведенный Martelli A. и соавт. [53], демонстрирует еще более высокие показатели: в 93,6 % случаев использования азтреонама для антибиотикотерапии инфекций МВП была достигнута эрадикация патогенных бактерий, в т. ч. она составила 93,9 % для E. coli (n = 415), 86,3 % – для Pseudomonasspр. (n = 207), 91,6 % – для Proteus spр. (n = 192), 89,8 % – для Providencia spр. (n = 59), 96,2 % – для Klebsiella spр. (n = 56) и 98,1 % – для Serratiaspр. (n = 56). По данным Puppo P. и соавт. [54], в терапии цистита и пиелонефрита азтреонам оказался более эффективным (выздоровление – 97,5 %, эрадикация бактерий – 100,0 %), чем норфлоксацин (выздоровление – 71,4 %, эрадикация бактерий – 50,0 %).
Примечательно, что азтреонам (1 г внутривенно или внутримышечно 2 раза в сутки) и амикацин (500 мг внутривенно или внутримышечно 2 раза в сутки) демонстрировали сходную клиническую и микробиологическую эффективность при лечении осложненной инфекции МВП, вызванной грамотрицательными бактериями [53]. Это особенно важно при курации пожилых больных с инфекциями МВП на фоне тяжелой сопутствующей патологии, в т. ч. нефропатии и сахарного диабета, когда все преимущества имеет препарат с наименьшим количеством нежелательных реакций.
Акушерские и гинекологические инфекции
Принимая во внимание полимикробную этиологию гинекологических инфекций с преобладанием помимо грамположительных кокков и неспорообразующих анаэробов бактерий из семейства Enterobacteriaceae (E. coli, Proteus spp., Klebsiella spp., Enterobacter spp.) и N.gonorrhoeae, азтреонам является препаратом резерва для комбинированной антимикробной терапии воспалительных заболеваний органов малого таза (ВЗОМТ), пельвиоперитонита, инфекционных осложнений после родов (послеродовый эндометрит) и гинекологических операций [55]. По мнению Dodson M.G. и Faro S. [56], азтреонам в комбинации с клиндамицином – одна из наиболее безопасных и эффективных схем лечения острых ВЗОМТ. Chimura T. и соавт. [96] указывают на высокую (96 %) клиническую эффективность азтреонама (2 г внутривенно каждые 8 часов) в комбинации с клиндамицином (600 мг внутривенно каждые 6 часов), использовавшегося в терапии самых различных инфекций в акушерстве и гинекологии, в т. ч. послеродового эндометрита.
Интраабдоминальная инфекция
По результатам рандомизированного сравнительного клинического исследования, включившего 66 больных с вторичным перитонитом, в т. ч. послеоперационным, клиническая эффективность сочетания азтреонам + клиндамицин (92 %) превысила аналогичный показатель в группе, леченной тобрамицином с клиндамицином (87 %) [57]. Согласно Williams R.R. и соавт. [58], бактериологическая эффективность азтреонама в отношении грамотрицательных возбудителей абдоминального сепсиса составила 93 против 86 % для тобрамицина.
Комбинированная терапия интраабдоминальной инфекции азтреонамом (1 г 3 раза внутривенно) и клиндамицином (600 мг 3 раза внутривенно) по эффективности достоверно не отличалась от лечения имипенемом/циластатином (1 г 4 раза внутривенно) [59].
Sawyer R.G. и соавт. [60] экспериментально обосновали эффективность азтреонама при интраабдоминальной инфекции. В условиях гипоксии и ацидоза МПК гентамицина для E. coli составила 8 мг/л, тогда как в сходных условиях МПК азтреонама в отношении того же патогена не превышал 0,25 мг/л. Помимо этого при использовании комбинации азтреонам + клиндамицин удается не только добиться 100 %-ной эрадикации энтеробактерий из полостей абсцессов, но и предупредить формирование новых гнойных полостей (0 против 33 % подобных осложнений, имевших место в группе, леченной гентамицином и клиндамицином).
Другая актуальная проблема – рациональная антибиотикотерапия у больных с проникающими ранениями брюшной полости. По результатам рандомизированного двойного слепого исследования, клиническая эффективность азтреонама (с клиндамицином) составила 97 % и была достоверно выше, чем в группе, леченной гентамицином (с клиндамицином; 81 %); средний койко-день у пациентов, получавших азтреонам, составил 8,1 дня против 12 – в группе, получавшей гентамицин [61]. Важно также, что азтреонам имеет фармакодинамические и фармакокинетические преимущества – отпадает необходимость в расчете дозы и лекарственном мониторинге.
Pedretti G. и соавт. [62] сообщают о высокой клинической и бактериологической эффективности азтреонама в лечении острого холецистита и различных форм холангитов, в т. ч. послеоперационного.
Berne T.V. и соавт. [63] на основании результатов рандомизированного контролируемого клинического исследования раскрывают преимущества комбинации азтреонам + клиндамицин перед классическим сочетанием гентамицина с клиндамицином в лечении местного перитонита, осложнившего перфоративный или гангренозный аппендицит.
Ariza J. и соавт. [64] предлагают использовать азтреонам в режиме 1 г внутривенно каждые 8 часов для лечения спонтанного бактериального перитонита, объясняя выбор как высокой чувствительностью грамотрицательных бактерий к препарату, так и фармакокинетическими/фармакодинамическими предпосылками – концентрации препарата в асцитической жидкости были на уровне 32,7 мг/л, что обеспечило 100 %-ную эрадикацию патогенных микроорганизмов из брюшной полости.
Согласно мета-анализу 5 рандомизированных контролируемых исследований, проведенному Holzheimer R.G. и Dralle H. [65], клиническая эффективность азтреонама (в комбинации с клиндамицином) в лечении интраабдоминальных инфекций самой различной локализации составила 89 %.
Исследования фармакокинетики азтреонама у больных, находящихся на перитонеальном диализе, доказали высокую (более 90 %) биодоступность антибиотика, находящегося в брюшной полости; причем концентрации в сыворотке и брюшной полости превышали МПК для основных возбудителей перитонита [66]. Brown J. и соавт. [67] на основании доказанной высокой клинической эффективности предлагают использовать следующий режим терапии перитонита: 3 г азтреонама вместе с 500 мг ванкомицина 1 раз в сутки интраперитонеально вместе с диализирующим раствором. По мнению Dratwa M. и соавт. [68], вполне приемлема также монотерапия азтреонамом (интраперитонеально), по эффективности превосходящая аминогликозиды и ко-тримоксазол: разрешение перитонита наблюдалось в 84 % случаев.
Из-за возможности развития серьезных нежелательных реакций при использовании и роста устойчивости среди микроорганизмов аминогликозиды постепенно утрачивают свою значимость; предпочтение отдается менее токсичным и более эффективным препаратам. Азтреонам практически лишен этих недостатков, поэтому может быть наилучшей альтернативой аминогликозидам при среднетяжелых и тяжелых интраабдоминальных инфекциях.
Тяжелые инфекции у больных ОРИТ
Представляется довольно интересной сравнительная оценка азтреонама и аминогликозидов, в частности амикацина, в терапии тяжелых грамотрицательных инфекций у пациентов с тяжелой сопутствующей патологий, находящихся в ОРИТ. По данным Rabinad E. и соавт. [69], эффективность монотерапии азтреонамом тяжелых и очень тяжелых грамотрицательных инфекций (нозокомиальная пневмония, септицемия, осложненные инфекции МВП, перитонит) превосходит стандартные комбинации амикацина с цефалоспоринами III поколения; наибольшее превосходство отмечено при лечении нозокомиальных инфекций НДП.
Опираясь на результаты рандомизированного сравнительного исследования, согласно которым клиническая эффективность азтреонама в сочетании с антистафилококковым пенициллином в лечении инфекций у больных в ОРИТ достоверно выше, чем у комбинации аминогликозида с цефалоспорином III поколения (80 против 51 %), Colardyn F. и соавт. [70] делают вывод о назревшей необходимости изменить стандартные режимы терапии на комбинации, включающие монобактам.
Инфекции у больных с нарушениями иммунитета
Результаты исследований указывают на целесообразность включения азтреонама в схемы комбинированной антибиотикотерапии фебрильной нейтропении у гематологических больных [71].
По данным Spencer R.C. и соавт. [72], клиническая и бактериологическая эффективность азтреонама в комбинации с гликопептидами (ванкомицин или тейкопланин) в лечении больных с подтвержденной септицемией на фоне нейтропении превосходила или была сходной с эффективностью комбинаций пиперациллина с гентамицином или имипенемa/циластатина с ванкомицином. Число нежелательных лекарственных реакций было достоверно ниже в группах больных, получавших монобактам.
Таким образом, азтреонам может быть с успехом использован в комбинированной (в основном) и монотерапии инфекций у иммунокомпрометированных больных как лучшая альтернатива аминогликозидам.
Инфекции костей и суставов
Как правило, инфекции костей и суставов, вызванные грамотрицательными возбудителями, составляют особую проблему в травматологии и ортопедии ввиду злокачественности течения и склонности к рецидивам. В основном это нозокомиальные инфекции у пациентов после операций и тяжелых травматических повреждений (открытые переломы). Среди возбудителей чаще всего встречаются P. aeruginosa, S. marcescens, E. cloacae, M. morganii, C. freundii, P. vulgaris, P. rettgeriи A. calcoaceticus. По данным Pribyl C. и соавт. [73], клинико-бактериологическая эффективность лечения остеомиелитов, гнойных артритов после эндопротезирования (17 больных) и гнойных осложнений после остеосинтеза (26 больных) комбинациями азтреонама с антибиотиками, активными в отношении грамположительных кокков, составила 100 %. Рецидив инфекций наблюдался в двух случаях. Длительность терапии колебалась от 5 до 52 дней; азтреонам вводился либо внутримышечно, либо внутривенно в суточной дозе 4–8 г. Аналогичные данные приводят Simons W.J. и соавт. [74]. Conrad D.A. и соавт. [75] провели анализ эффективности азтреонама в лечении септического артрита (n = 10) и остеомиелита (n = 18), вызванных P. aeruginosa: у 13 больных достигнуты клиническое выздоровление и эрадикация патогенов, у 5 – улучшение (в целом клиническая эффективность – 64 %); за 18-месячный период наблюдения зарегистрирован только один рецидив. Продолжительность парентерального курса составила 4 недели у пациентов с септическим артритом и 40 дней – у больных остеомиелитом.
Таблица 5. Концентрации (среднее значение + SD) азтреонама в различных органах и тканях
после однократной медленной внутривенной инъекции в дозе 2 г [26].
Лечение инфекций кожи и мягких тканей
Особое значение антибиотикотерапия инфекций кожи и мягких тканей приобретает в комбустиологии, где этиология инвазивной инфекции ассоциируется с грамотрицательной флорой, а использование, например, аминогликозидов сопряжено с риском поражения почек. Как показали результаты клинических исследований, азтреонам показал высокую – от 84 до 100 % – клиническую эффективность среди пациентов с гнойными процессами мягких тканей [76, 77]. В случае эмпирического выбора целесообразно комбинировать азтреонам с антибиотиком, активным в отношении грамположительной кокковой флоры, например цефазолином или ванкомицином.
Гонорея
Предпосылками к пересмотру классических схем лечения гонореи являются широкая распространенность устойчивости среди гонококков к пенициллину, фторхинолонам (ципрофлоксацину), спектиномицину и тетрациклинам. Азтреонам с избирательной активностью в отношении грамотрицательных бактерий может рассматриваться как альтернатива цефалоспоринам и фторхинолонам в лечении как неосложненной, так и осложненных форм. Согласно Mohanty K.C. и соавт. [78], а также Gottlieb A. и соавт. [79], с использованием азтреонама в режиме 1 г внутримышечно однократно для лечения гонореи у женщин и в смешанной популяции выздоровления удалось достичь в 100 % случаев. МПК азтреонама в отношении N. gonorrhoeae составило менее 0,5 мг/л.
По данным Stoberl C. и соавт. [80], среди 99 больных с неосложненной гонореей (в т. ч. 64 мужчин и 35 женщин) однократное введение азтреонама было эффективным в 95,9 % случаев. Резистентных к монобактаму штаммов гонококков не определилось; МПК в отношении N. gonorrhoeae колебалось от 0,0075 до 3,906 мг/л.
Инфекции, вызванные P. aeruginosa, у больных муковисцидозом
P. aeruginosa – основной возбудитель инфекционных осложнений у больных муковисцидозом. Самой частой локализацией инфекционного процесса являются легкие. Высокая частота лекарственной устойчивости среди возбудителей и необходимость в длительном курсе антипсевдомонадной терапии предполагают руководствоваться в выборе антибиотиков не только комплаенсом, но в первую очередь доказанными клинико-бактериологической эффективностью и безопасностью. По данным Schaad U.B. и соавт. [81], клиническая эффективность азтреонама и цефтазидима у данной категории больных эквивалентна. Авторы предлагают высокие суточные дозы азтреонама (300 мг/кг/сут внутривенно, максимальная доза – 12 г/сут) в комбинации с амикацином (36 мг/кг/сут внутривенно, максимальная доза – 1,5 г/сут) [81]. Сообщается о хорошей переносимости двухнедельного курса, в т. ч. у подростков. Очевидны перспективы использования азтреонама у больных с аллергией на цефалоспорины и пенициллины [82].
Антибиотикопрофилактика гнойно-септических послеоперационных осложнений
Грамотрицательные аэробные бактерии, в основном представители семейства Enterobacteriaceae, являются одними из основных возбудителей послеоперационных инфекционных осложнений в урологии, абдоминальной хирургии, колопроктологии и в меньшей степени – в гинекологии. Сегодня имеется достаточное количество рандомизированных клинических исследований, доказывающих эффективность азтреонама в плане снижения частоты инфекций в области хирургического вмешательства (ИОХВ) и послеоперационных инфекций МВП.
Результаты плацебо-контролируемых проспективных рандомизированных исследований указывают на возможность использования азтреонама в режиме 1 г внутривенно для периоперационной профилактики у больных, подвергающихся операциям на предстательной железе; сообщается о клинической эффективности метода от 88,7 % и выше (учитывались как послеоперационные инфекции МВП, так и послеоперационная лихорадка, бактериурия и катетер-ассоциированные осложнения) [83–85].
Многоцентровые рандомизированные клинические исследования демонстрируют преимущества комбинации азтреонам + клиндамицин (5,8 % ИОХВ) перед общепринятыми режимами, включающими аминогликозиды, в основном гентамицин (12,5 % ИОХВ), с точки зрения снижения числа послеоперационных инфекций в колоректальной хирургии [84, 86].
Достоверно более высокая эффективность монобактама определяется при сравнительной оценке азтреонама и гентамицина в профилактике послеоперационных инфекций в билиарной и желудочной хирургии (95,5 против 80,6 %) [87]. Очевидны фармакокинетические и фармакодинамические предпосылки этого: эффективные бактерицидные концентрации в мягких тканях, желчи и стенке кишки сохраняются минимум в течение 4 часов после предоперационного парентерального введения 2 г азтреонама [29]. Аналогичные результаты получены при сравнении азтреонама в комбинации с клиндамицином и цефотаксима в периоперационной профилактике ИОХВ в гинекологии: 1,2 % ИОХВ в группе, получавшей азтреонам, против 4,9 % в группе, получавшей цефотаксим [88].
Использование в педиатрии
Лечение грамотрицательной инфекции у детей представляет определенные трудности. Cложно подобрать антибиотик, отвечающий определенным требованиям, прежде всего обладающий доказанными эффективностью и безопасностью. Азтреонам имеет ряд достоинств, которые по праву делают его одним из ключевых антибиотиков для лечения инфекций самых различных локализаций, вызванных грамотрицательными аэробными бактериями, в педиатрии. Результаты рандомизированных клинических исследований, включающих тысячи детей с инфекциями МПВ, бактериемией, менингитом, инфекциями костей и суставов, пневмонией и перитонитом, демонстрируют высокую эффективность моноили комбинированной терапии монобактамом – от 92 до 100 %; рецидивы наблюдались в основном у пациентов с врожденными аномалиями МВП и дыхательных путей [89, 90]. В лечении сепсиса у новорожденных эффективность монобактама как минимум соответствовала таковой амикацина [91], а при легочной инфекции у больных муковисцидозом – традиционной комбинации антисинегнойных антибиотиков. По сводной статистике, нежелательные реакции при использовании азтреонама наблюдались менее чем в 2 % наблюдений. Сообщалось о единичных случаях изменений в биохимических тестах [92].
Оптимизация терапии фебрильной нейтропении у детей также возможна с использованием азтреонама (120–150 мг/кг/сут внутривенно) в сочетании с одним из антисинегнойных пенициллинов (пиперациллином) или цефалоспоринов (цефтазидимом). Эффективность указанных комбинаций составляла 74,3–76 %, а у пациентов с тяжелой нейтропенией (количество лейкоцитов периферической крови меньше 100/мм3) – 63 % [93].
Важные особенности
Клиницистам крайне необходимо иметь антибиотик, который по безопасности и переносимости соответствовал бы цефалоспоринам ипенициллинам, но не имел бы с ними перекрестной аллергии и микробной устойчивости. Как демонстрируют экспериментальные и клинические исследования, азтреонам не вызывает аллергических реакций у пациентов с непереносимостью других β-лактамов, в основном пенициллинов и цефалоспоринов [94]. Проблемы отои нефротоксичности, возникающие при назначении аминогликозидов, легко решаемы при назначении азтреонама: монобактам не вызывает изменений со стороны гломерулярного и тубулярного аппарата почек и не воздействует токсически на кортиев орган [95].
Безопасность и переносимость
Нежелательные реакции при использовании азтреонама встречаются менее чем в 2 % случаев. Чаще всего это повышение уровня печеночных трансаминаз, клинически никак не проявляемое. Также встречаются нарушения со стороны желудочно-кишечного тракта – диспепсия, диарея и тошнота [38]. Отмечены, но редко встречаются местные реакции, преимущественно при внутримышечном введении (боли в месте инъекции). При длительной (свыше 3 недель) терапии встречались кожные проявления в виде сыпи, а также умеренная лейкопения [38].
Суперинфекция, вызванная в основном грамположительными кокками (S. aureus, Enterococcus spp.), – также редкое явление, наблюдаемое при длительной терапии ИМВП с частотой до 2 % [52].
Из-за неактивности в отношении анаэробных бактерий риск развития псевдомембранозного колита при лечении азтреонамом минимален.
Заключение
Азтреонам имеет как фармакологические, так и клинические предпосылки стать одним из основных антибиотиков для лечения грамотрицательных и смешанных инфекций. Ввиду хорошей переносимости и минимальной частоты побочных лекарственных реакций монобактам можно использовать у детей и взрослых для терапии среднетяжелых, тяжелых, а также угрожающих жизни инфекций. На сегодняшний день азтреонам – одна из лучших альтернатив аминогликозидам. Поэтому, несмотря на кажущуюся “узость” спектра активности, азтреонам обладает самым широким потенциалом клинического применения.
Информация об авторе:
Муконин А.А. – ГОУ ВПО “Смоленская государственная медицинская академия” Росздрава.
E-mail: malat@mail.ru



