Свойства ацетилцистеина
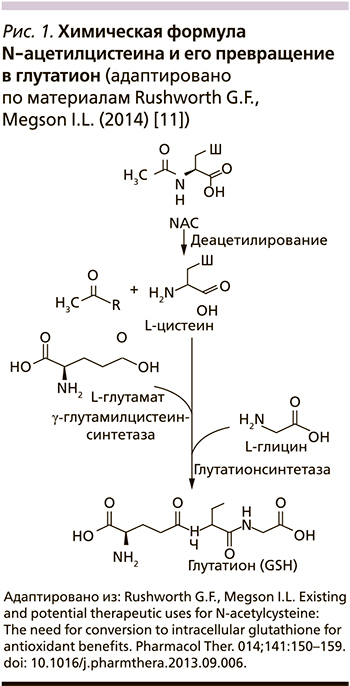
N-ацетил-L-цистеин (NAC– ацетилцистеин) – производное L-цистеина, относящийся к группе тиолов, его молекула содержит реактивные тиоловые (сульфгидрильные) группы (рис. 1), которые обусловливают прямое муколитическое действие [1]. Они «разрывают» дисульфидные связи кислых мукополисахаридов бронхиального секрета (БС). В результате происходит деполимеризация макромолекул мукопротеидов и БС становится менее вязким и адгезивным [2].
NAC быстро и хорошо всасывается из желудочно-кишечного тракта (ЖКТ) и из дыхательных путей, при этом в легких создаются действенные концентрации лекарственного средства. Уровень всасывания NAC из ЖКТ сопоставим с его поступлением в кровь при внутримышечном введении. Действие препарата начинается через 30–90 минут после введения и сохраняется до 2–4 часов. Препарат метаболизируется в печени (гидролизуется в активный метаболит – цистеин) и отчасти – в кишечной стенке. Биодоступность низкая – не более 10% (за счет эффекта «первого прохождения» через печень). Максимальная концентрация в плазме крови (~2 мкмоль/л) достигается через 2–3 часа после введения. После системного введения NAC равномерно распределяется во всем организме, при этом во всех тканях и плазме крови отмечается значительное увеличение количества сульфгидрильных групп (0,33–0,47 л/к). Т1/2 равен 1 часу, при циррозе печени увеличивается до 8 часов, путь элиминации преимущественно печеночный (~70%). Основные метаболиты NAC фармакологически активны.
NAC как активный муколитический агент широко использовался в клинической практике с середины 1960-х гг. (под торговым названием «Флуимуцил»), но только в 1989 г. O. Auroma et al. обнаружили его неспецифическую активность, направленную на нейтрализацию свободнорадикальных групп [3]. NAC является мощным антиоксидантом, оказывающим как прямое, так и непрямое действие даже в очень низких концентрациях (рис. 2) [4].
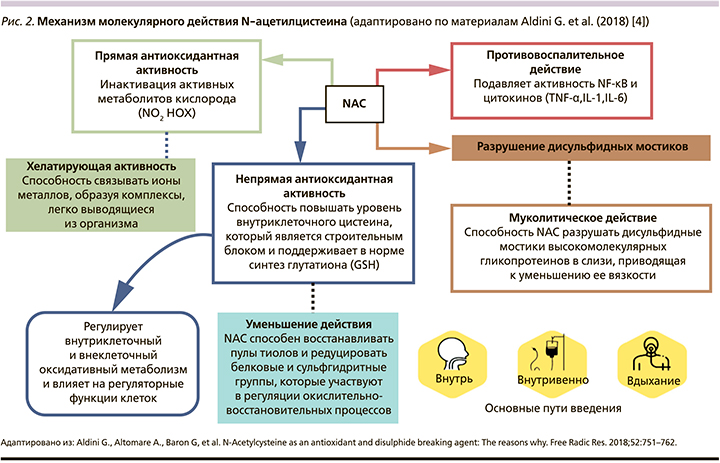
Прямое антиоксидантное действие обусловлено наличием свободной тиольной группы, взаимодействующей с электрофильными группами свободных радикалов и реактивных кислородных метаболитов, ответственных за развитие острого и хронического воспаления легочной ткани и дыхательных путей. Препарат инактивирует практически все разновидности активных метаболитов кислорода, в т.ч. наиболее реакционноспособные формы.
Непрямое антиоксидантное действие препарата обусловлено тем, что за счет аминокислоты цистеина (образующейся при распаде NAC) он является предшественником глутатиона (GSH), участвующего в процессах детоксикации организма, защиты слизистой оболочки дыхательных путей от внешних и внутренних повреждающих воздействий (рис. 1). GSH является наиболее распространенным небелковым тиолом в организме и одним из основных антиоксидантов, ответственных за поддержание клеточного окислительно-восстановительного статуса, который помимо непосредственного взаимодействия с реактивными видами действует как кофактор или субстрат для различных антиоксидантных ферментов [3]. Внутриклеточная концентрация цистеина ниже внеклеточной, следовательно, он действует как ограничивающий фактор скорости биосинтеза GSH. Эта характеристика объясняет роль NAC как пролекарства цистеина и внутриклеточного GSH [5].
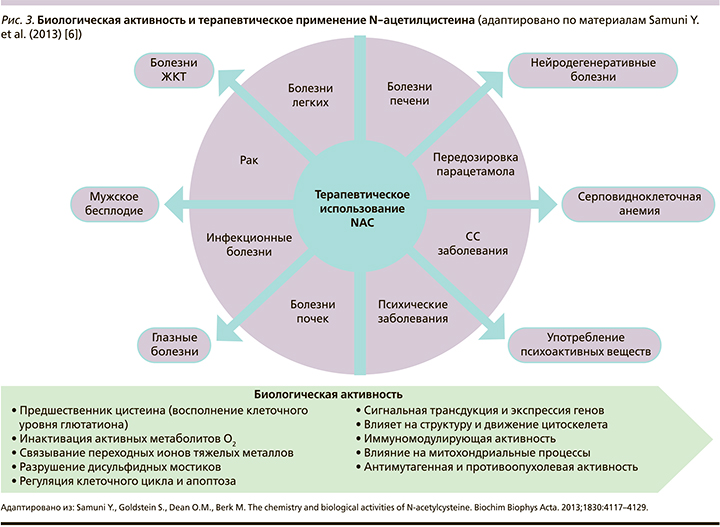
Действие NAC как мощного антиоксиданта напрямую связана с его способностью повышать уровень внутриклеточного цистеина с последующим повышением уровня GSH (рис. 1). Таким образом, основная роль NAC связана с его антиоксидантной и противовоспалительной активностью, которая способствует поддержанию клеточного окислительно-восстановительного дисбаланса. По этой причине его терапевтический потенциал касается ряда заболеваний, которые связывают окислительный стресс с его этиологией и прогрессированием (рис. 3) [6]. По той же причине N-ацетилцистеин (NAC) одобрен FDA (Food and Drug Administration) и, следовательно, признан Всемирной организацией здравоохранения (ВОЗ) в качестве основного лекарственного средства, широко используемого для лечения передозировки парацетамола (Ацетаминофена) [5].
Антиоксидантное действие NAC косвенно влияет на продукцию БС, т.е. оказывает мукорегуляторный эффект. В свое время (середина 1960-х гг.) особый интерес вызвало сообщение об уменьшении вязкости раствора мукопротеинов in vitro, т.е. прямого действия муколитического препарата. Активность препарата сохраняется и при гнойном БС. Снижая вязкость БС, приводя ее к оптимальному состоянию, NAC повышает мукоцилиарный клиренс, т.е. оказывает и отчетливое мукокинетическое действие. Одним из результатов прямого антиоксидантного действия NAC является защита α1-антипротеина, что может быть потенциально полезным при хронической обструктивной болезни легких, т.к. замедляются развитие и прогрессирование эмфиземы легких [5].
NAC и COVID-19
В наши нелегкие времена мы постоянно возвращаемся к теме пандемии новой коронавирусной инфекции COVID-19, так резко изменившей всю нашу жизнь, хотя коронавирусы и являются одними из основных патогенов, вызывающими различные заболевания органов дыхания, включая простуду (острую респираторную вирусную инфекцию – ОРВИ), ближневосточный респираторный синдром и тяжелый острый респираторный синдром. За неполных 2 года, прошедших от первой манифестации заболевания, были проведены многочисленные исследования, связанные с изучением патогенеза заболевания, основных клинических проявлений, вариантов течения новой коронавирусной болезни COVID-19 и, конечно, возможностей лечения. Однако до сих пор нет «золотого» стандарта лечения.
Среди препаратов, которые могли бы быть потенциально полезными в лечении СOVID-9, был и NAC. Известно, что NAC является полипотенциальным препаратом, обладающим свойствами антиоксиданта (прямого и непрямого) с гипотетически вероятным воздействием на последствия, связанные с COVID-19. В ноябре 2020 г. был опубликован всеобъемлющий обзор этих исследований [5]. С учетом особых вероятных терапевтических воздействий NAC на COVID-19 и его последствия, респираторные исходы и другие поражения конечных органов NAC может быть назначен в качестве потенциальной адъювантной терапии COVID-19 с учетом статуса пациента, противопоказаний и возможных побочных эффектов, связанных с лекарственными препаратами.
В этом обзоре [5] классифицированы вероятные эффекты NAC, такие как окислительно-регуляторный эффект, противовирусная активность, профилактическая и терапевтическая роль при сепсисе, положительная роль при сопутствующих заболеваниях и внелегочном поражении внутренних органов или недостаточности и даже при первичных кожных проявлениях, ассоциированных с COVID-19.
Пероральный прием NAC рекомендуется в качестве профилактического или терапевтического средства для лечения связанных с болезнью исходов у стабильных пациентов, не находящихся на искусственной вентиляции легких (ИВЛ). Внутривенное введение NAC рекомендуется в том случае, если его эффективность будет признана ценной и значимой. Для оценки влияния NAC на исходы COVID-19 рекомендуются аналитические исследования случай–контроль и рандомизированные клинические исследования, а также систематический обзор фактических данных [7].
Мы уже многое знаем о новой коронавирусной инфекции: непредсказуемость течения заболевания, внезапное ухудшение состояния на фоне, казалось бы легкого, доброкачественного течения (ОРВИ), высокая смертность, многочисленные осложнения, нередко затянувшееся течение [8].
Клинические варианты и проявления COVID-19:
- ОРВИ (поражение только верхних отделов дыхательных путей);
- пневмония без дыхательной недостаточности;
- острый респираторный дистресс-синдром – ОРДС (пневмония с острой дыхательной недостаточностью – ОДН);
- сепсис, септический (инфекционно-токсический) шок;
- ДВС (диссеминированное внутрисосудистое свертывание)-синдром, тромбозы и тромбоэмболии.
Гипоксемия (SpO2<88%) развивается более чем у 30% пациентов.
Классификация COVID-19 по степени тяжести:
- Легкое течение (температура тела <38°C, кашель, слабость, боли в горле, отсутствие критериев среднетяжелого и тяжелого течения).
- Среднетяжелое течение (температура тела>38°C, частота дыхательных движений (ЧДД) >22/мин, одышка при физических нагрузках, изменения при компьютерной томографии – КТ (рентгенографии), типичные для вирусного поражения (объем поражения минимальный или средний; КТ – 1–2), SpO2<95%, С-реактивный белок сыворотки крови >10 мг/л).
- Тяжелое течение (ЧДД>30/мин, SpO2≤93%, PaO2/FiO2≤300 мм рт.ст., снижение уровня сознания, ажитация, нестабильная гемодинамика (систолическое артериальное давление [АД]менее 90 мм рт.ст. или диастолическое АД менее 60 мм рт.ст., диурез менее 20 мл/ч), изменения в легких при КТ (рентгенографии), типичные для вирусного поражения (объем поражения значительный или субтотальный; КТ – 3–4), лактат артериальной крови >2 ммоль/л, qSOFA>2 баллов).
- Крайне тяжелое течение (стойкая фебрильная лихорадка, ОРДС, ОДН с необходимостью респираторной поддержки (ИВЛ), септический шок, полиорганная недостаточность, изменения в легких при КТ (рентгенографии), типичные для вирусного поражения критической степени (объем поражения значительный или субстотальный; КТ-4) или картина ОРДС).
Сегодня глобальная пандемическая коронавирусная болезнь COVID-19 имеет высокий уровень смертности, достигающий 20% (в некоторых исследованиях) и в 30–60 раз превышающий частоту смертельных исходов, отмечаемых при сезонном гриппе.
Большая часть усилий медицинского сообщества до сих пор была посвящена выявлению препаратов, способных вернуть к жизни пациентов, переносящих самые тяжелые и опасные для жизни осложнения COVID-19, прежде всего цитокиновый шторм и гиперкоагуляцию. При этом оказалось, что как национальные, так и международные органы здравоохранения уделяют мало внимания разработке принципов лечения COVID-19 на ранних этапах, т.е. от стадии 1 до стадии 2А [9]. Эта критическая фаза болезни по аналогии с другими вирусными инфекциями и широко принятой фармакологической практикой должна своевременно лечиться либо этиотропными препаратами (которые в случае COVID-19 все еще отсутствуют), либо использовать симптоматическую терапию для управления/предотвращения симптомов заболевания.
Известно, что в среднем у 50% инфицированных пациентов заболевание протекает бессимптомно. У 80% пациентов с наличием клинических симптомов заболевание протекает в легкой форме ОРВИ. Таким образом, большинство инфицированных пациентов с легким и среднетяжелым течением должны будут лечиться амбулаторно, т.к. у пациентов этой группы чаще всего отсутствуют показания к госпитализации [8].
Согласно определению подозрительного случая [10], любой случай острой респираторной инфекции (температура тела выше 37,5°C и один или более из следующих признаков: кашель – сухой или со скудной мокротой, одышка, ощущение заложенности в грудной клетке, насыщение крови кислородом по данным пульсоксиметрии SpO2≤95%, боль в горле, насморк и другие катаральные симптомы) в отсутствие других известных причин, которые объясняют клиническую картину вне зависимости от эпидемиологического анамнеза, считается подозрительным на COVID-19. При этом медикаментозное этиотропное лечение при ОРВИ доказано только в отношении одного возбудителя – вируса гриппа. ВОЗ для лечения гриппа рекомендует применение этиотропных химиопрепаратов, блокирующих репликацию вируса, т.е. обладающих прямым противовирусным действием [10].
В связи с этим на первый план в лечении новой коронавирусной инфекции COVID-19 выходит симптоматическая терапия, особенно при лечении относительно легко протекающей формы заболевания. В руководствах по лечению коронавирусной инфекции, в т.ч. и отечественных, перечисляются различные препараты, как правило, без достаточного обоснования их возможной эффективности и безопасности в свете конкретных ситуаций [8].
Симптоматическое лечение включает:
- купирование лихорадки (жаропонижающие препараты, например парацетамол);
- комплексную терапию ринита и/или ринофарингита (увлажняющие/элиминационные препараты, назальные деконгестанты);
- комплексную терапию бронхита (мукоактивные, противокашлевые, бронхолитические и прочие средства).
Жаропонижающие средства назначают при температуре тела >38,0–38,5ºС. При плохой переносимости лихорадочного синдрома, головных болях, повышении АД и выраженной тахикардии (особенно при наличии ишемических изменений или нарушениях ритма) жаропонижающие препараты используют и при более низких цифрах. Наиболее безопасным препаратом считается парацетамол.
Парацетамол
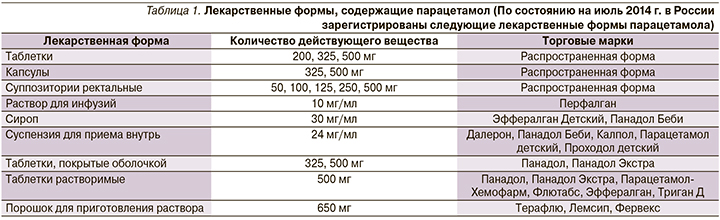
Парацетамол входит в схемы лечения в амбулаторных условиях новой коронавирусной инфекции (COVID-19) легкого/среднетяжелого течения в качестве жаропонижающего средства в дозе 1–2 таблетки (500–1000 мг) 2–3 раза в сутки, но не более 4,0 г/сут. В то же время в условиях стационара в качестве жаропонижающего средства рекомендуются нестероидные противовоспалительные средства – НПВС (без расшифровки). Таким образом, априори предполагается бесконтрольный прием парацетамола амбулаторными пациентами. Следует отметить, что парацетамол входит в состав многочисленных безрецептурных лекарственных средств, предназначенных для лечения ОРВИ (табл. 1) [11]. При этом существует опасность одновременного приема нескольких препаратов, содержащих парацетамол.
Парацетамол является основным метаболитом фенацетина с химически близкими ему свойствами. При приеме фенацетина он быстро образуется в организме и обусловливает его анальгетический эффект. По болеутоляющей активности парацетамол существенно не отличается от фенацетина и подобно ему обладает слабой противовоспалительной активностью. Основные преимущества парацетамола: малая токсичность и меньшая, чем у фенацетина, способность вызывать образование метгемоглобина.
Парацетамол (Ацетаминофен) был внедрен в клиническую практику в 1955 г. под одной из самых известных в США торговой маркой Тайленол, как болеутоляющее и жаропонижающее лекарство для детей (Tylenol Children’s Elixir). В Великобритании парацетамол поступил в продажу в 1956 г., тогда он выпускался под маркой Панадол. В то время Панадол отпускался из аптек только по рецепту (в настоящее время он является безрецептурным препаратом), но его рекламировали как безопасное средство для слизистой оболочки желудка, в то время как популярный в те годы Аспирин (ацетилсалициловая кислота) раздражал слизистую оболочку.
Парацетамол относительно широко стали применять после изъятия из оборота амидопирина и фенацетина Появилось множество парацетамол-содержащих комбинированных лекарственных форм, в т.ч. в сочетаниях с ацетилсалициловой кислотой, анальгином, кодеином, кофеином и другими препаратами (табл. 1). Парацетамол содержится более чем в 500 препаратах, отпускаемых как по рецепту, так и без рецепта в США.
Парацетамол сразу стал одним из самых популярных и наиболее часто используемых анальгетиков и жаропонижающих препаратов во всем мире, доступных без рецепта, как в моно-, так и в многокомпонентных препаратах. Это препарат выбора для пациентов, которые не могут лечиться НПВС: пациенты, страдающие бронхиальной астмой, язвенной болезнью желудка, гемофилией, аспирин-индуцированными заболеваниями, дети в возрасте до 12 лет, беременные и/или кормящие женщины.
Механизм действия парацетамола сложен. Он блокирует обе формы фермента циклооксигеназы (ЦОГ1 и ЦОГ2), тем самым ингибируя синтез простагландинов. Действует преимущественно в центральной нервной системе (ЦНС), воздействуя на центры боли и терморегуляции. В периферических тканях клеточные пероксидазы нейтрализуют влияние парацетамола на ЦОГ, что объясняет практически полное отсутствие противовоспалительного эффекта. Отсутствие блокирующего влияния на синтез простагландинов в таких тканях обусловливает отсутствие у него отрицательного влияния на слизистую оболочку ЖКТ и водно-солевой обмен (задержка ионов Na+ и воды). Предполагается также, что препарат селективно блокирует ЦОГ3, которая находится только в ЦНС, а на ЦОГ1 и ЦОГ2, расположенных в других тканях, не влияет. Этим объясняется выраженные анальгетический и жаропонижающий и слабый противовоспалительный эффекты [12].
Около 97% препарата, поступившего в организм, метаболизируется в печени: 80% препарата вступает в реакции конъюгации с глюкуроновой кислотой и сульфатами с образованием неактивных метаболитов (глюкуронида и сульфата парацетамола), 17% подвергаются гидроксилированию с образованием 8 активных метаболитов, которые конъюгируют с GSH с образованием уже неактивных метаболитов. При недостатке GSH эти метаболиты могут блокировать ферментные системы гепатоцитов и вызывать их некроз.
В метаболизме препарата также участвует изофермент CYP2E1.
Гепатотоксическое действие парацетамола
Парацетамол считается хорошо переносимым препаратом, однако, несмотря на это, с каждым годом наблюдается неуклонное увеличение числа зарегистрированных случаев парацетамол-индуцированной печеночной интоксикации во всем мире. На протяжении многих лет появляются данные о гепатотоксическом действии парацетамола при его умеренной передозировке, при применении парацетамола в высоких терапевтических дозах и одновременном приеме индукторов микросомальной ферментной системы печени Р-450 (антигистаминные препараты, глюкокортикоиды, фенобарбитал, этакриновая кислота), а также у алкоголиков [11]. Гепатотоксичность лекарственных препаратов, хотя и является относительно редким событием, считается ведущей причиной острой печеночной недостаточности в клинике, на долю которой приходится более 60% всех случаев в США [13]. Таким образом, одно из наиболее часто используемых обезболивающих лекарств во всем мире, парацетамол, является классическим дозозависимым гепатотоксином, который отвечает почти за 50% всех случаев острой печеночной недостаточности в США, Великобритании и многих западных странах [13]. Ежегодно 30 тыс. человек госпитализируются после передозировки парацетамола, из них около половины отравились, не осознавая этого. Описаны случаи суицидальных попыток с помощью парацетамола в Великобритании. У таких больных проводится трансплантация печени, но в 28% случаев пересадок пациент все равно умирает. К сожалению, данных по России нет [14].
Одним из важных преимуществ парацетамола является большая широта терапевтической дозы. Рекомендованная суточная доза препарата 2 таблетки (по 0,5 г) 4 раза в сутки, что составляет 4,0 г. В то же время пороговая доза, при которой возможно поражение печени, – 15 г (30 таблеток), а смертельный исход – только при суточном приеме 20 г (40 таблеток). Таким образом, при элементарном соблюдении дозировки и правил приема препарата, изложенных в инструкции, имеющейся в каждой упаковке, прием опасной для жизни дозы парацетамола практически исключается.
Однако даже при приеме в терапевтических дозах (2,5–4,0 г/сут) парацетамол может вызывать серьезное поражение печени у алкоголиков, а также у лиц, систематически употребляющих алкоголь (для мужчин ежедневный прием свыше 700 мл пива или 200 мл вина, для женщин дозы в 2 раза меньше), особенно если прием парацетамола происходит через короткий промежуток времени после употребления алкоголя [15]. При длительном приеме парацетамола более 1 таблетки в сутки (1000 и более таблеток за жизнь) вдвое увеличивается риск развития тяжелой анальгетической нефропатии, приводящей к терминальной почечной недостаточности [16].
В 2011 г. FDA запустило государственную образовательную программу, которая должна была помочь избегать передозировки, предупреждая: «Ацетаминофен может вызывать серьезное повреждение печени, если применяется в дозах, превышающих указанные на упаковке». В предупреждении о безопасности 2011. г FDA немедленно потребовало от производителей обновить этикетки всех рецептурных комбинаций ацетаминофена, чтобы предупредить о потенциальном риске тяжелого поражения печени, и запретило препараты, содержащие более 325 мг ацетаминофена в одной дозе.
Парацетамольная токсичность является основной причиной острой печеночной недостаточности в западном мире и объясняет большинство передозировок лекарств в Соединенных Штатах, Великобритании, Австралии и Новой Зеландии. Согласно данным FDA, в Соединенных Штатах в течение 1990-х гг. было зарегистрировано 56 тыс. посещений отделения неотложной помощи, 26 тыс. госпитализаций и 458 смертей в год, связанных с передозировками, связанными с парацетамолом. В рамках этих оценок непреднамеренная передозировка парацетамола составила почти 25% посещений отделения неотложной помощи, 10% госпитализаций и 25% смертей» [17].
Во всем мире широко распространены острые и хронические заболевания печени, которые являются частыми причинами заболеваемости и смертности [5]. Решающим фактором в патогенезе этих заболеваний является оксидативный стресс, который способствует развитию цирроза печени, а также стимулирует его прогрессирование [5].
NAC в лечении отравлений парацетамолом
В широком систематическом обзоре экспериментальных и клинических исследований антиоксидантной и противовоспалительной роли NAC в предотвращении повреждения печени проанализирована эффективность NAC в модуляции воспаления и окислительного стресса при заболеваниях печени [18]. В этом обзоре подтверждена роль NAC как безопасного и эффективного препарата для лечения отравления парацетамолом.
Патогенез отравления парацетамолом хорошо изучен и является следствием токсического воздействия на печень избыточной продукции гепатотоксического метаболита N-acetyl-ρ-benzo-quinon imine (NAPQI). В нормальных условиях он легко инактивируется печенью с помощью GSH. Однако в случаях интоксикации GSH истощается и NAPQI накапливается в органе, вызывая повреждение клеток и их гибель. Функция NAC заключается в пополнении запасов GSH и облегчает поступление кислорода в поврежденную печень [5].
Совсем недавно эксперты подготовили обновленное научно обоснованное руководство, которое поможет клинической практике в случае эпизодов отравления парацетамолом, являющегося наиболее распространенной причиной тяжелого острого повреждения печени в западных странах (табл. 2).
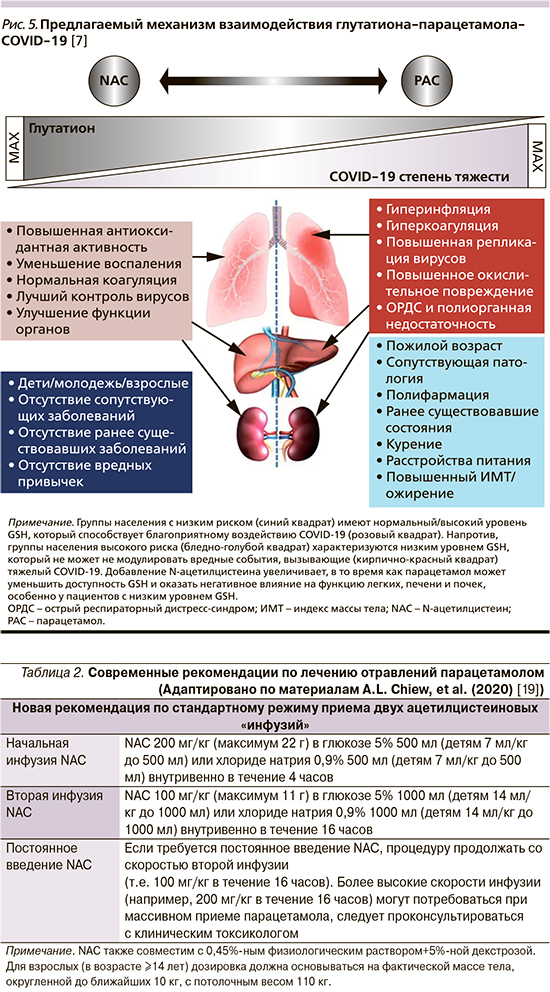
Согласно новым рекомендациям, две «инфузии» NAC, вводимые внутривенно (200 мг/кг через 4 часа, затем 100 мг/кг через 16 часов) обладают аналогичной эффективностью по сравнению с предыдущей рекомендованной дозировкой (из трех «инфузий») с преимуществом значительного уменьшения побочных эффектов. Протокол также установил предел массы тела пациента 110 кг с максимальной дозировкой внутривенного NAC, эквивалентной 22 г в первой инфузии и 11 г во второй [19].
Как и отравление парацетамолом, другие препараты и растительные или пищевые добавки также могут вызывать острое или хроническое повреждение печени. Повреждение печени, индуцированное непарацетамольными препаратами, включает прямое, иммуно-опосредованное и митохондриальное повреждение клеток, однако механизм, лежащий в основе гепатотоксичности, не включает истощение GSH и остается неясным. Тем не менее есть подозрение, что NAC оказывает благотворное влияние и в этой ситуации за счет оптимизации подачи кислорода и улучшения системной гемодинамики.
Проспективное исследование показало значительное улучшение выживаемости пациентов с острой печеночной недостаточностью, получавших внутривенное введение NAC (150 мг/кг в течение 1 часа, затем по 12,5 мг/кг/ч в течение 4 часов непрерывной инфузией 6,25 мг/кг/ч, для остальных 67 часов), снижение смертности и сокращение пребывания в стационаре [5].
Введение внутривенного NAC пациентам с острой печеночной недостаточностью, не индуцированной парацетамолом, вскоре после поступления снижает смертность и необходимость трансплантации печени, а также уменьшает энцефалопатию, госпитализацию, поступление в отделение интенсивной терапии и недостаточность других органов [5]. В подтверждение этих данных недавний мета-анализ также пришел к выводу, что NAC улучшает выживаемость, выживаемость без трансплантации, выживаемость после трансплантации и продолжительность пребывания в больнице для пациентов с острой печеночной недостаточностью, не связанной с парацетамолом [5].
Единственным клинически одобренным противоядием против AПAП (парацетамол)-индуцированного повреждения печени является NAC, который наиболее эффективен при введении в течение 8 часов после передозировки. Хотя NAC по-прежнему эффективен даже через 24 часа, но при этом эффективность значительно снижается. NAC является предшественником синтеза GSH и действует путем облегчения очистки реактивного метаболита NAPQI во время фазы метаболизма. В более поздние моменты времени GSH помогает в удалении активного кислорода в митохондриях, а избыток NAC превращается в промежуточные продукты цикла Кребса и поддерживает энергетический метаболизм митохондрий. Отсроченное лечение NAC повышает риск острой печеночной недостаточности. Однако в отличие от индивидуальной токсичности лекарств, вызванное AПAП, повреждение печени и печеночная недостаточность характеризуются относительно высокой выживаемостью. Тем не менее из-за широкого применения препарата передозировка AПAП на сегодняшний день является наиболее частой причиной острой печеночной недостаточности любой этиологии в США и Великобритании [20].
В обзорной статье P. Sestili et al. (2020) проанализировано несколько исследований, указывающих на важность клеточных уровней восстановленного GSH и целостности соответствующих антиоксидантных путей в патогенезе COVID-19. Была установлена связь дефицита глюкозо-фосфатдегидрогеназы, способствующей заболеваемости и смертности пациентов с COVID-19 с дефицитом GSH и антиоксидантной активности, что в свою очередь приводит к снижению способности пациента преодолевать инфекцию SARS-CoV-2. (рис. 5). Кроме того, была продемонстрирована важность целостности анитоксидантной защиты при вирусных инфекциях и высказана гипотеза о том, что низкие уровни GSH могут играть важную роль в патогенезе COVID-19, особенно в прогрессировании тяжести заболевания [9]. Интересным следует считать тот факт, что профилактические добавки NAC значительно снижали заболеваемость клинически очевидным гриппом, особенно у пожилых людей с более высоким риском [21]. Отсюда становится очевидным, что в недалеком будущем мы сможем со спокойным сердцем назначать NAC при COVID-19.
Заключение
Без малого за полвека знакомства с NAC мы узнали многое о его фармакокинетике, фармакодинамике, о показаниях и противопоказаниях к применению этого препарата, но с сожалением следует констатировать, что это знакомство «шапочное» …



