Введение
В исследованиях последних десятилетий установлено, что ведущим факторам риска формирования атеросклероза принадлежат увеличение уровня общего холестерина (ОХ), липопротеидов низкой плотности (ЛПНП), ожирение, артериальная гипертензия, курение, сахарный диабет [1]. Несмотря на огромную работу, проводимую в направлении профилактики этих факторов, смертность от сердечно-сосудистых заболеваний (ССЗ) во всем мире остается высокой. Вероятно, это связано с существованием более тонких механизмов атерогенеза. В последние годы в центре внимания исследователей находятся вопросы, связанные с изучением липопротеина а [Лп(а)] и его влияния на развитие атеросклероза сосудов.
Лп(а) представляет собой частицу, состоящую из аполипопротеина B100 (апоВ), окруженного холестерином, фосфолипидами, триглицеридами (ТГ) и ковалентно связанного с аполипопротеином А (апоА) с помощью дисульфидного мостика. Уровень Лп(а) наследственный, в значительной степени определяется изменениями размера аллелей и наличием однонуклеотидных полиморфизмов в гене аполипопротеина(а) на хромосоме 6q22–23 [2]. Уникальной особенностью этой частицы является то, что он уже полностью экспрессируется к первому году жизни человека в отличие от других показателей липидного профиля, концентрация которых стабилизируется намного позже [3].
Установлено, что Лп(а) способствует атерогенезу путем прямого осаждения на артериальной стенке, увеличению продукции провоспалительных цитокинов за счет содержания в нем окисленного фосфолипида и предположительно представляющего собой тот самый мостик в цепочке доказательств, связывающих тромбоз и атеросклероз [3–7]. Действия Лп(а) представлены в таблице.
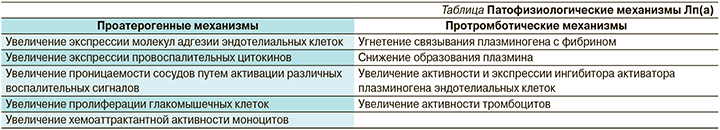
Показано, что Лп(а) – независимый фактор риска ишемической болезни сердца (ИБС), атеросклероза, аортального стеноза, тромбоза и инсульта [8, 9]. При этом увеличение уровня Лп(а) коррелирует с ранним дебютом указанных заболеваний. B.G. Nordestgaard et al. (2010) приводят информацию, согласно которой около 20% людей во всем мире имеют повышенный уровень Лп(а) [10], а его повышение в свою очередь в 2–4 раза увеличивает риск ранней ИБС [11].
Таким образом, Лп(а) – чрезвычайно важный показатель сердечно-сосудистого риска и должен оцениваться в отношении пациентов с отягощенным семейным анамнезом по ССЗ, а также в отношении пациентов, которые не достигают целевого уровня ЛПНП при лечении статинами.
Следует отметить, что среди педиатрической популяции исследования Лп(а) немногочисленны, а проблемы скрининга и коррекции Лп(а) в детском возрасте остаются нерешенными.
Анализ научных работ, посвященных исследованию Лп(а)
Наибольшее число исследований проведено по изучению Лп(а) у детей с инсультом [12–17]. Это связано с влиянием Лп(a) на развитие гиперкоагуляционных нарушений, которые могут быть причиной инсульта [12]. Выявлено, что увеличение концентрации Лп(а) достоверно чаще регистрировалось у детей, перенесших острое нарушение мозгового кровообращения. Полученные результаты стали основанием включения оценки Лп(а) в обязательный объем лабораторных исследований молодых людей, перенесших ишемический или геморрагический инсульт.
Некоторые исследования детей посвящены влиянию Лп(а) на риск формирования ССЗ. Рядом авторов показано, что высокий уровень Лп(а)>30 мг/дл, выявленный в детском возрасте, коррелирует с отягощенным анамнезом по развитию ранних ССЗ в семье [2, 18–21]. Результаты исследований по изучению влияния высокой концентрации Лп(а) на состояние сосудов в детском возрасте неоднозначны. O. Qayum et al. (2018) отмечают отсутствие достоверной разницы скорости каротидно-феморальной пульсовой волны и толщины комплекса интима-медиа в группе детей с повышенным уровнем Лп(а) [2]. Интересный дизайн представлен в исследовании J. Lapinliemu (2015), в котором продемонстрировано ослабление эндотелиальной функции у детей в случае увеличения уровня Лп(а) у их родителей [22].
Особое внимание привлекают исследования Лп(а) у детей с семейной гиперхолестеринемией. Так, I. Narverud et al. (2014) утверждают, что уровень Лп(а) и СГХС не зависят друг от друга, в то же время уточняют, что пациенты с СГХС, имеющие высокий уровень Лп(а), подвержены большему риску преждевременного атеросклероза [23]. Другие авторы также не зарегистрировали достоверной разницы уровня Лп(а) у здоровых детей и детей с СГХС [24–26]. С другой стороны, в ряде исследований показано, что у детей с СГХС уровень Лп(а) достоверно выше по сравнению с контролем [27, 28]. K.E. Sorensen et al. описали у детей с СГХС взаимосвязь высокого Лп(а) с эндотелиальной дисфункцией, измеряемой с помощью потокзависимой вазодилатации, являющейся ранним маркером атеросклероза [29].
Несмотря на массу работ, изучающих структуру, функции, метаболизм Лп(a), а также его влияние на развитие атеросклеротических ССЗ, вопросы, кому из пациентов необходимо проводить анализ, как интерпретировать результаты и необходимо проводить коррекцию повышенного уровня, до сих пор активно обсуждаются.
В настоящее время существует шесть национальных/международных рекомендаций, в которых предложено тестирование Лп(а): Европейского общества кардиологов (ESC) и Европейского общества атеросклероза (EAS) [30], Американского общества аферезa [31], Американского общества Американского колледжа кардиологов [32], руководства Канадского сердечно-сосудистого общества [33], Национальных руководящих принципов ассоциации липидов и согласованное заявление HEART UK по Лп(а) [34]. Несмотря на существующие различия между представленными рекомендациями, есть ключевое сходство: повышенным считается уровень >30–50 мг/дл, а тестирование на Лп(а) рекомендуется пациентам среднего и высокого рисков.
В 2019 г. Европейское общество кардиологов и Европейское общество атеросклероза рекомендовали измерение Лп(а) минимум 1 раз в жизни.
Ряд исследователей указывают на возможные ошибки в расчете Лп(а). Это связано с тем, что в большинстве случаев уровень ЛПНП в клинической медицине не измеряется, а вместо этого оценивается расчетом по методу Фридвальда (ЛПНП, мг/дл)=ОХ-ЛПВП-ТГ/5). Метод Фридвальда становится неточным при увеличении уровня ТГ и не рекомендуется при значениях ТГ>400 мг/дл.
В этом случае многие лаборатории используют β-количественное определение. Авторы предполагают, что потенциальный вклад Лп(а) в лабораторно измеренные значения ЛПНП может быть представлен в идеализированной форме липидной панели следующим образом ОХ=ЛПНП+Лп(а)+ЛПВП (липопротеиды высокой плотности)+ЛПОНП (липопротеиды очень низкой плотности). При этом при повышении массы Лп(а) увеличивается его вклад в ЛПНП, тогда как «истинный» уровень ЛПНП может быть значительно ниже [35, 36]. Ключевое клиническое значение представленных «расчетов» заключается в том, что пациенты, принимающие умеренные или высокие дозы статинов, в ряде случаев не достигают «ожидаемого» снижения уровня ЛПНП, т.к. их истинный уровень ЛПНП может быть очень низким и они меньше реагируют на дальнейшее снижение. Это связано с тем, что значительная часть ЛПНП представлена частицами Лп(а) [35].
В связи с этим при гиперхолестеринемии измерение концентрации Лп(а) дополнительно к стандартному липидному профилю (ОХ, ЛПНП, ЛПВП, ТГ) необходимо.
Заключение
Таким образом, изучение Лп(а) при ССЗ демонстрирует высокий интерес ученых во всем мире ввиду появления многократного риска развития сердечно-сосудистых осложнений при повышении концентрации Лп(а). В свою очередь это направление недостаточно изучено педиатрической популяцией, в т.ч. при семейной гиперхолестеринемии, что диктует актуальность проведения дальнейших исследований в этой области.



