Введение
Антипсихотики являются блокаторами дофаминергических рецепторов. Именно на этом основано их действие на продуктивную симптоматику при психотических расстройствах [1]. В то же время блокада других медиаторных систем имеет большое значение. Так, аффинность антипсихотиков к рецепторам серотонина позволяет как смягчять экстрапирамидные нарушения, так и оказывать влияние на негативные симптомы психоза [1]. Тропностью к серотониновым рецепторам отличаются антипсихотики второй генерации [1].
Персонализированное назначение антипсихотиков активно изучается сегодня. Уже существуют рекомендации по подбору дозы рисперидона, арипипразола, галоперидола и зуклопентиксола на основе генотипирования CYP2D6 [2]. Но фармакодинамические генетические факторы изучены в меньшей степени. С учетом существенного увеличения доли антипсихотиков второй генерации в клинической практике роль генов рецепторов серотонина имеет не меньшее, чем дофамина, значение.
Гены рецепторов серотонина активно изучаются в аспекте безопасности антипсихотиков. В частности, полиморфные варианты гена HTR2C значимо ассоциированы с риском метаболических побочных эффектов [3–4].
Но менее изучен ген HTR2A, который имеет непосредственное отношение к механизму действия антипсихотиков. Установлено, что полиморфный вариант HTR2A rs6313 может влиять на плотность и функциональность одноименных рецепторов в различных областях мозга [4]. Следовательно, у носителей данного полиморфного варианта может меняться клинический ответ на прием антипсихотиков.
В мета-анализе F. Gressier et al. (2016) было подтверждено, что носители HTR2A rs6313 лучше отвечают на прием клозапина [6]. Однако клозапин применяется преимущественно при терапевтической резистентности, поэтому важнее изучение роли HTR2A для других антипсихотиков. Недавнее исследование E. Maffioletti et al. (2020) выявило, что носители аллели T HTR2A rs6313 лучше отвечают на терапию рисперидоном и оланзапином [7]. В исследовании участвовали пациенты с шизофренией, и особенно важно, что была измерена ранняя эффективность, т.е. в первые 14 дней приема антипсихотика [7]. В противоречие с результатами E. Maffioletti et al. (2020) [7] вступает другое исследование – работа C.G. Alladi et al. (2019) [8]. Авторы не выявили значимых ассоциаций между носительством HTR2A rs6313 и ответом на прием рисперидона за 4 недели терапии [8].
Изучение безопасности антипсихотиков в зависимости от носительства HTR2A rs6313 ранее проводилось на взрослых пациентах с шизофренией. Значимых ассоциаций с экстрапирамидной симптоматикой при приеме галоперидола выявлено не было [9]. В исследовании A. Gunes et al. (2007) аллель C чаще ассоциировалась с наличием экстрапирамидных симптомов [10]. В крупном исследовании S. Mas et al. (2016) HTR2A rs6313 не был включен в исследование, но продемонстрирована связь другого полиморфного варианта (rs9567733) с риском антипсихотик-индуцированных экстрапирамидных симптомов у пациентов с первым психотическим эпизодом [11].
Таким образом, на сегодня влияние носительства HTR2A rs6313 на эффективность и безопасность антипсихотиков однозначно не установлено. Требуется проведение новых исследований. Важно подчеркнуть, что исследования проводились в основном с участием взрослых пациентов с шизофренией. Но есть потребность в изучении более молодого контингента, в т.ч. подростков. Работ, проведенных с участием пациентов молодого возраста, опубликовано очень мало.
Ранее в пилотном исследовании мы выявили, что носительство аллели C полиморфного варианта HTR2A rs6313 ассоциировано с меньшей редукцией негативной симптоматики [12].
Цель настоящего исследования: установить возможные ассоциации носительства HTR2A rs6313 с параметрами эффективности и безопасности применения антипсихотиков для подростков с острым психотическим эпизодом в течение первых 2 недель лечения.
Методы
Исследование было одобрено заседанием Локального этического комитета ФГБОУ ДПО РМАНПО Российской медицинской академии непрерывного профессионального образования Минздрава РФ (Протокол № 3 от 06.06.2018) и ГБУЗ «Научно-практический центр психического здоровья детей и подростков им. Г.Е. Сухаревой» ДЗМ (Протокол № 2 от 14.06.2018).
Проведено проспективное обсервационное исследование, в котором участвовали пациенты, госпитализированные в детскую психиатрическую больницу (ГБУЗ «Научно-практический центр психического здоровья детей и подростков им. Г.Е. Сухаревой» ДЗМ) с 20.06.2018 по 20.03.2020. В исследование был включен 101 подросток с установленным диагнозом «острое полиморфное психотическое расстройство» на момент поступления (F23.0-9, согласно Междунарордной классификации болезней 10-го пересмотра – МКБ-10). Включение проводилось в срок от 1 до 3 дней после госпитализации пациента в психиатрическую больницу. Каждый пациент или его законный представитель подписал добровольное информированное согласие на участие в исследовании. Все пациенты идентифицировали себя этнически русскими. Персональные данные, которые позволяют идентифицировать пациента, не были внесены в базы данных.
Критерии включения:
1. Возраст от 10 до 18 лет.
2. Клинически верифицированный острый психотический эпизод.
3. Назначение антипсихотика в качестве основного вида фармакотерапии.
4. Согласие пациента и родителя (законного представителя) на участие в исследовании.
Критерии невключения:
1. Наличие соматического или инфекционного заболевания в состоянии декомпенсации.
2. Положительный результат теста на употребление психоактивных веществ, что указывает на экзогенный характер психотического расстройства.
3. Противопоказания к приему антипсихотиков.
4. Отказ пациента или его родителя (законного представителя) от участия в исследовании.
Наблюдение за пациентами проводилось в течение 14 дней. Оценка психического состояния пациента проводилась дважды: на момент включения и на момент окончания периода наблюдения. Безопасность психофармакотерапии оценивалась на 14-й день наблюдения.
Для оценки тяжести психического состояния применяли специальные шкалы: CGAS (Children’s Global Assessment Scale) [13], PANSS (Positive and Negative Symptoms Scale) [14], CGI-S (Clinical Global Impression Severity) и CGI-I (Improvement) [15]. Динамические изменения данных шкал использовали для оценки эффективности психофармакотерапии.
Безопасность психофармакотерапии оценивали при помощи шкал UKU SERS (UKU Side Effects Rating Scale) [16], SAS (Sympson-Angus Scale) [17], BARS (Barnes Akathisia rating scale) [18]. Эти шкалы имеют числовые значения: чем выше значение, тем больше выраженность симптомов. Но UKU SERS также позволяет оценивать наличие отдельных неблагоприятных побочных эффектов у пациента.
Исследователь не мог влиять на назначение психофармакотерапии лечащим врачом. Все получаемые пациентом психотропные препараты были учтены в исследовании. Все пациенты получали антипсихотик в качестве основной терапии. Некоторым пациентам дополнительно назначали второй антипсихотик, антидепрессант, нормотимик, антихолинергический препарат или транквилизатор. Подобные случаи рассматривались как полипрагмазия и обязательно учитывались при анализе. Для анализа учитывали суточную дозу антипсихотика без разделения одного и того же препарата по пути введения. Дозы антипсихотиков были переведены в хлорпромазиновый эквивалент для унификации дальнейшего анализа [19]. В анализ включали только те лекарственные средства, которые назначались пациенту не менее чем на 3 дня.
У каждого пациента был взят соскоб эпителия внутренней стороны щеки (буккального эпителия) в день включения в исследование с целью генотипирования. Биоматериал замораживали, транспортировали в лабораторию и в дальнейшем хранили при температуре -77°С.
Лабораторная часть исследования проводилась на базе НИИ молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО Минздрава РФ (Москва). Выделение ДНК и генотипирование образцов происходили по мере их поступления с 25.04.2019 по 15.05.2020. Выделение ДНК из буккального эпителия проведено сорбентным методом.
Определение полиморфного варианта HTR2A rs6313 (T102C) осуществлялось методом полимеразной цепной реакции (ПЦР) в реальном времени с применением коммерческих наборов реактивов (ООО «Синтол»); оборудование: детектирующий амплификатор CFX96 TouchTM Real-Time PCR Detection System (Bio-Rad, USA).
Статистическая обработка проводилась в программе SPSS Statistics 21.0. С учетом небольшого размера выборки применялись непараметрические критерии (Манна–Уитни, Крускала–Уоллеса) для сравнения количественных переменных между группами. Ввиду малочисленной выборки в результатах средние значения представлены как медиана и квартили – Me [Q1; Q3] Частоты категориальных переменных сравнивались между собой при помощи χ2-критерия Пирсона, для сравнений 2×2 использовался точный критерий Фишера. Для коррекции множественных сравнений вводилась поправка Бонферрони.
Расчет соответствия распределения генотипов закону Харди–Вайнберга выполнен при помощи on-line-калькулятора [20].
Носители разных аллелей полиморфных вариантов были разбиты на две группы: носители «дикой» аллели в гомозиготном состоянии (TT) и носители полиморфной аллели (CС+СТ). Такое разбиение было применено в связи с наличием пациентов с разными генотипами для формирования подходящих для статистического анализа подгрупп.
При анализе данных всегда учитывалось влияние демографических и клинических характеристик пациентов на изучаемые исходы, в т.ч. влияние полипрагмазии. Это было сделано с целью установки значимости ассоциаций полиморфных вариантов исследуемых генов с параметрами эффективности и безопасности применения антипсихотиков.
Результаты
По итогам генотипирования полиморфного варианта HTR2A rs6313 в выборке выявлены 23 пациента с «диким» генотипом TT, 48 гетерозигот CT и 30 пациентов с генотипом CC. Распределение значимо не отличалось от равновесия по Харди–Вайнбергу (p=0,65).
Средний возраст пациентов составил 15,2±1,7 года. Соотношение мальчиков и девочек было примерно одинаковым (51,5 и 48,5% соответственно). Индекс массы тела составил в среднем 21,4±4,8 кг/м2.
Клинически пациенты при поступлении соответствовали критериям диагноза F23 по МКБ-10 «Острое полиморфное психотическое расстройство». В процессе клинического наблюдения устанавливался уточненный диагноз. Диагноз F23 для 45 (44,6%) пациентов остался без изменений, 25 (24,8%) установлен диагноз параноидной шизофрении (F20 по МКБ-10), 17 (16,8%) – шизоаффективного расстройства (F25 по МКБ-10).
Также встречались диагнозы F22 (3%), F21 (8,9%) и F32 (2%) по МКБ-10. В 56,4% случаев острый психотический эпизод у пациента наблюдался впервые в жизни. Наиболее часто в качестве ведущего диагностировали галлюцинаторно-параноидный синдром (61,4%), примерно поровну – параноидный (14,9%), депрессивно-параноидный (11,9%), маниакально-параноидный (10,9%); у одного пациента ведущим синдромом был кататонический.
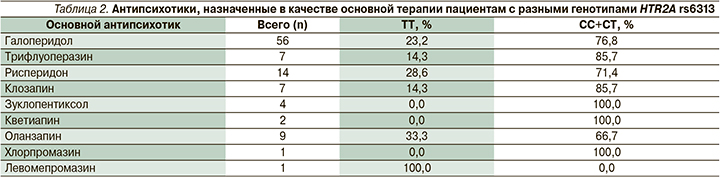
При сравнении дозировок антипсихотиков для пациентов с разным генотипом выявлено, что стартовая доза антипсихотиков у носителей генотипа ТТ в 1–3-и сутки была ниже по сравнению с CC+CT (табл. 1). В табл. 2 приведены антипсихотики, которые назначались пациентам в качестве основной терапии. Значимых различий частоты назначения антипсихотиков носителям разных генотипов HTR2A rs6313 выявлено не было.
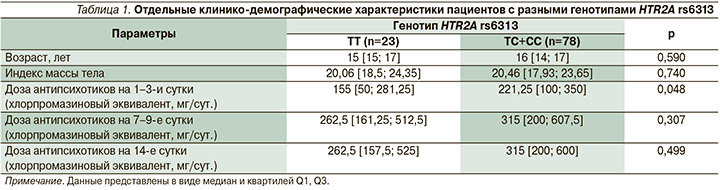
Проведенный анализ различий выраженности психотической симптоматики на момент включения в исследование, а также на 14-е сутки лечения, согласно шкалам PANSS, CGAS, CGI-S, CGI-I, не выявил значимых различий между носителями разных генотипов. Значения шкал представлены в табл. 3.
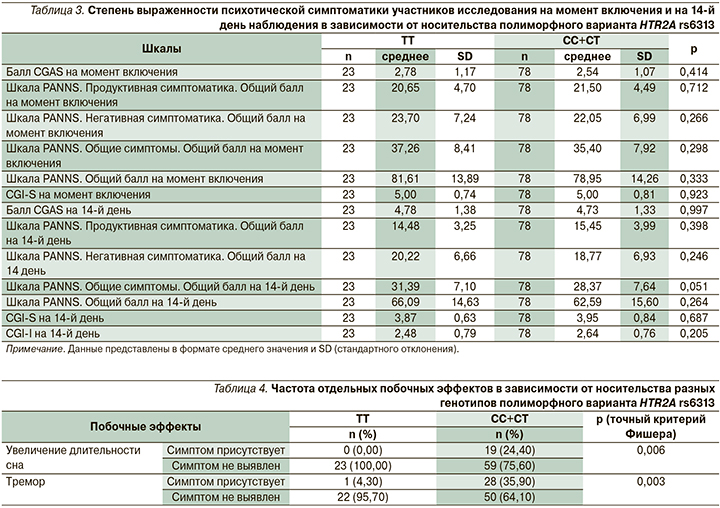
При анализе параметров безопасности психофармакотерапии в зависимости от носительства полиморфного варианта HTR2A rs6313 не было выявлено значимых различий балла шкалы UKU SERS и ее подшкал, а также шкалы SAS между носителями разных генотипов HTR2A rs6313.
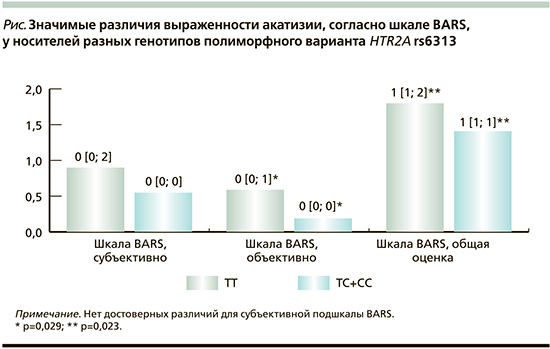
Продемонстрированы значимые различия выраженности акатизии, согласно шкале BARS, а именно: общая оценка акатизии и ее объективные признаки. Субъективная подшкала BARS, оценивавшая восприятие пациентом своих симптомов, между разными генотипами HTR2A rs6313 значимо не различалась (см. рисунок).
Был проведен анализ частоты встречаемости отдельных побочных эффектов согласно перечню шкалы UKU SERS в зависимости от носительства полиморфного варианта HTR2A rs6313. Из всего перечня значимые различия были выявлены только для двух симптомов: увеличение длительности сна и тремор. Данные побочные эффекты значимо чаще встречались среди носителей полиморфной аллели С (табл. 4).
Обсуждение
В настоящем исследовании изучено влияние полиморфного варианта HTR2A rs6313 на эффективность и безопасность психофармакотерапии для подростков с острым психотическим эпизодом.
Ограничением настоящего исследования послужила недостаточность выборки для оценки ассоциаций с клиническими эффектами отдельных антипсихотиков. Но с учетом натуралистичного характера исследования следует принять во внимание полученные результаты. Тем более фармакогенетических исследований антипсихотиков конкретно для полиморфного варианта HTR2A rs6313 у европеоидов проведено мало.
В рамках нашего исследования ассоциаций HTR2A rs6313 с параметрами эффективности антипсихотиков выявлено не было. Но наблюдается тенденция к достоверности при сравнении подшкалы «Общие симптомы» шкалы PANSS у носителей полиморфной аллели C выраженность симптоматики ниже. Это согласуется с результатами, ранее полученными в исследовании L. Olajossy-Hilkesberger et al. (2011): гомозиготы CC при приеме оланзапина демонстрировали большую редукцию продуктивной симптоматики [21].
С другой стороны, в работе E. Maffioletti et al. (2020) получены противоположные результаты: гомозиготы TT отличались лучшим ответом на оланзапин и рисперидон [7]. Но в том же исследовании отдельные симптомы, измеренные по шкале PANSS, лучше редуцировались у носителей аллели C [7]. Следовательно, нельзя говорить об однонаправленном влиянии носительства HTR2A rs6313 на эффективность терапии антипсихотиками.
Носители аллели C в нашем исследовании отличались худшей переносимостью: они чаще жаловались на увеличение длительности сна и тремор.
С другой стороны, у пациентов – носителей аллели C объективная выраженность акатизии была меньше по сравнению с гомозиготами TT. Известно, что блокада рецепторов серотонина уменьшает выраженность экстрапирамидных реакций. Полиморфный вариант HTR2A rs6313 известен тем, что способен изменять плотность рецепторов серотонина в разных областях мозга и это выражается в непредсказуемом изменении реакции центральной нервной системы на фармакотерапию [5, 22]. И несмотря на то что измененная экспрессия рецепторов серотонина у носителей аллели C потенциально может быть объяснением меньшей выраженности акатизии, нельзя это утверждать. Наличие тремора у тех же носителей аллели C опровергает это предположение.
Следует принять во внимание важное ограничение: носители аллели C в первые 3 дня получали значимо более высокую дозу антипсихотиков по сравнению с носителями TT. Следовательно, жалобы на тремор и увеличение длительности сна могли быть связаны с исходно высокой дозой антипсихотика. В этом смысле результаты по шкале BARS выглядят более значимыми, т.к. получены объективно при осмотре на 14-й день терапии.
Мы провели сравнение полученных результатов с ранее опубликованными исследованиями риска экстрапирамидных реакций в зависимости от носительства HTR2A rs6313. В работе M. Grubor et al. (2020) не выявлена значимая связь HTR2A rs6313 с риском экстрапирамидных реакций, в т.ч. акатизии, согласно шкале BARS [9].
В данном исследовании все пациенты получали галоперидол, что справедливо и для пациентов нашего исследования – большинство принимали галоперидол. Но других работ, которые оценивали бы выраженность акатизии по шкале BARS, в литературе обнаружено не было. Исследование A. Gunes et al. (2007) совпадает с нашим в части большей частоты экстрапирамидных реакций у носителей аллели C [10].
Поскольку на данный момент опубликовано немного исследований, посвященных роли HTR2A rs6313 для прогноза эффективности и безопасности применения антипсихотиков, наше исследование вносит вклад в общую доказательную базу. Важно, что не найдено подобных исследований, которые проводились с участием подростков с острым психотическим эпизодом.
Требуется расширять знания о влиянии данного полиморфизма путем проведения новых исследований и расширения выборки пациентов.
Заключение
В результате настоящего исследования установлено, что HTR2A rs6313 служит значимым предиктором безопасности антипсихотиков для подростков с острым психотическим эпизодом.
Носители аллели C реже демонстрировали симптомы акатизии на фоне приема антипсихотиков. Носители генотипа TT были менее склонны к проявлению побочных эффектов, ощущаемых пациентами субъективно: тремора и увеличения длительности сна. Но данная находка может быть связана с разницей дозировок антипсихотиков в первые 3 дня лечения между носителями разных генотипов HTR2A rs6313.
В результате исследования однонаправленные закономерности влияния HTR2A rs6313 на безопасность антипсихотиков выявлены не были. Это свидетельствует о многофакторном генезе риска побочных эффектов.
Не было выявлено значимых ассоциаций HTR2A rs6313 с параметрами эффективности антипсихотиков у подростков с острым психотическим эпизодом.
Финансирование. Исследование выполнено при финансовой поддержке Российского научного фонда, проект № 18-75-00046.


