Введение
Нестероидные противовоспалительные средства (НПВС) – одни из самых успешных в мире и используются большим числом пациентов из-за их противовоспалительного, обезболивающего и жаропонижающего действий. С момента открытия ацетилсалициловой кислоты (Аспирина) в XIX в. F. Hoffmann на мировом рынке было продано более 50 различных молекул. НПВС обычно назначают при хронических воспалительных состояниях, но они также широко используются в качестве безрецептурных препаратов при различных воспалительных процессах – от легкой до умеренной боли или лихорадки. Другие клинические применения (например, ацетилслициловая кислота в низких дозах для кардиопротекции) также весьма популярны.
Химически НПВС крайне неоднородны: производные салициловой кислоты (ацетилслициловая кислота, дифлунизал), индолы (индометацин), производные фенамовой кислоты (мефенамовая кислота, меклофенамовая кислота), производные уксусной кислоты (диклофенак, кеторолак), производные пропионовой кислоты (ибупрофен, н-проксофен), производные еноловой кислоты (пироксикам, мелоксикам) или диарилгетероциклические соединения (целекоксиб, эторикоксиб). Большинство НПВС представляют собой органические кислоты с низким значением pKa, способные накапливаться в воспаленных тканях с кислым pH.
Фармакологически все НПВС имеют общий механизм действия, открытый J.R. Vane в 1971 г.: они действуют как конкурентные и обратимые ингибиторы простагландина G/H-синтазы (также известной как циклооксигеназа, или ЦОГ), тем самым снижая образование различных простагландинов [1]. Единственное исключение составляет ацетилсалициловая кислота, которая необратимо ацетилирует ключевую аминокислоту (серин 529), расположенную в активном центре ЦОГ-1, с образованием ковалентной связи, что приводит к постоянному ингибированию фермента. Серия исследований охарактеризовала как минимум две изоформы ЦОГ у человека:
ЦОГ-1 – конститутивный фермент, работает практически постоянно и выполняет физиологически важные функции, обычно экспрессируется на многих клетках, генерирует простагландины, непосредственно участвующие не только в защите слизистой оболочки желудка, но и в гомеостазе тромбоцитов и почек. Считается, что ингибирование этой изоформы отвечает за желудочные и легочные побочные эффекты неселективных НПВС.
ЦОГ-2 экспрессируется макрофагами, синовиоцитами, фибробластами, гладкой сосудистой мускулатурой, хондроцитами и эндотелиальными клетками после индуцирования их цитокинами или факторами роста. ЦОГ-2 – индуцибельная изоформа, которая включается при определенных ситуациях, например при воспалении, индуцированном провоспалительными цитокинами или агрессией тканей, вырабатываются простагландины, участвующие в боли, лихорадке и воспалении. Кроме того, ЦОГ-2 может отвечать за некоторые физиологические функции.
В зависимости от относительной селективности в отношении изоформ ЦОГ было разработано два типа НПВС. Неселективные (традиционные) НПВС (ибупрофен, диклофенак, индометацин и др.), которые ингибируют обе изоформы ЦОГ с высоким потенциалом индукции раздражения желудка. Селективные к ЦОГ-2 препараты (коксибы, нимесулид, мелоксикам), которые избирательно ингибируют ЦОГ-2, лучше переносятся слизистой оболочкой желудка, но с другими проблемами безопасности. Ключевая особенность класса НПВС в следующем: частично как положительные, так и побочные эффекты вызваны одним и тем же механизмом действия, а именно ингибированием биосинтеза простагландинов [2].
В нашей работе мы в очередной раз обоснуем предпочтительное отношение к мелоксикаму при различных заболеваниях и синдромах.
Общие данные о мелоксикаме
Мелоксикам (MX), 4-гидрокси-2-метил-N- (5-метил-2-тиазоил)-2H-1,2-бензотиазин-3-карбоксамид-1,1-диоксид, – это НПВС, принадлежащее к классу еноловой кислоты [3]. MX получил свое первое маркетинговое разрешение в 1995 г. Он одобрен для использования более чем в 80 странах в качестве лечения остеоартрита (ОА), ревматоидного артрита (РА) и анкилозирующего спондилита.
Концентрация МХ достигает максимума через 2 часа после внутримышечного (IM) введения и через 5–11 часов после перорального приема. Биодоступность при приеме внутрь составляет около 95%. МХ примерно на 99% связывается с белками сыворотки крови. Печень метаболизирует МХ до неактивных метаболитов. Изоферменты цитохрома-P450 2C, особенно CYP2C9, ответственны за большую часть метаболизма препарата. МХ выводится с мочой в неизмененном виде (0,25%). МХ метаболизируется до четырех биологически неактивных метаболитов и выводится с периодом полувыведения (t1/2) около 15 часов после внутривенного и около 20 часов после внутримышечного введения. После приема внутрь период полувыведения составляет от 13,2 до 24 часов. Системный клиренс составляет от 8,6 до 11,5 мл/мин после внутривенного введения и 8,51 – после внутримышечного. Устойчивое состояние достигается в течение 3–5 дней. Кроме того, фармакокинетические параметры линейны во всем диапазоне доз, при многократном дозировании изменения не наблюдаются, а для ряда различных составов показана биоэквивалентность. Результаты показывают, что МХ подходит для приема 1 раз в сутки и что переход с одной формы препарата на другую легко возможен, если это необходимо или удобно для пациента. Фармакокинетические различия между молодыми взрослыми и пожилыми пациентами незначительны, чтобы требовать корректировки дозы. У пожилых женщин концентрация в плазме часто выше (47%), чем у молодых женщин, но изменения дозы не рекомендуется. Доза МХ не требует корректировки у пациентов с почечной недостаточностью от легкой (CrCl от 41 до 60 мл/мин) до умеренной (CrCl от 20 до 40 мл/мин) почечной недостаточности. Гемодиализ не выводит МХ [4–8].
Существенные концентрации МХ достигаются в синовиальной жидкости, предполагаемой области действия при хронических воспалительных артропатиях. Он демонстрирует эффективность по уменьшению боли и воспалительных симптомов и имеет определенную активность в лечении ОА, РА и анкилозирующего спондилита [9–11]. MX ингибирует изофермент циклооксигеназы-2 (ЦОГ-2) сильнее, чем изофермент ЦОГ-1, поэтому он показывает аналогичную эффективность, но более низкую токсичность, чем другие НПВС [12, 13]. Кроме того, он изучался как потенциальное лекарство для борьбы с болезнью Альцгеймера и как эффективное вспомогательное терапевтическое средство для лечения различных видов рака, включая рак легких, колоректальный рак, рак простаты и рак мочевого пузыря [14–19]. Следовательно, MX имеет большой потенциал для клинического использования. В настоящее время MX коммерчески доступен в виде таблеток с различными способами всасывания, суспензий, свечей, капсул, гранул, гелей и инъекций.
Фармакодинамические свойства МХ. Противовоспалительные эффекты МХ были продемонстрированы на моделях крыс, таких как каррагинан или каолин-индуцированный отек лап крысы, образование гранулем после имплантации хлопка крысам, каолин-индуцированный плеврит у крыс и артрит, индуцированный адъювантом у крыс [20, 21]. Во всех моделях МХ подавлял воспаление однократной дозой в течение длительного времени. В исследованиях на людях показано, что МХ снижает скорость оседания эритроцитов (СОЭ) у пациентов с РА [22] и снижает СОЭ, уровень С-реактивного белка (СРБ) и экспрессию аквапорина-1, что служит аналогом эффективности лечения при анкилозирующем спондилите [23].
МХ продемонстрировал болеутоляющий пролонгированный эффект против воспалительной боли у крыс [24]. После однократного перорального приема обезболивающий эффект МХ не снижается на 50% до 18 часов после приема. МХ имеет значительно более длительное действие, чем пироксикам, диклофенак и индометацин. Точно так же МХ использовался для лечения боли, вторичной по отношению к РА, ОА и перипроцедурной боли в различных исследованиях на людях с момента его появления [25].
Антипиретические свойства. МХ, как и все другие НПВС, не влияет на температуру тела нормотермных млекопитающих, поскольку НПВС не влияют напрямую на центр калорийности. НПВС влияют только на пирогенную лихорадку. МХ проявляет более низкую эффективность в отношении вызванной дрожжами гипертермии, чем диклофенак и пироксикам. Было обнаружено, что в дозе 0,1 мг/кг МХ снижает вызванную эндотоксинами лихорадку у кошек [26].
Избранные клинические данные о МХ. M Distel et al. представили глобальный анализ безопасности данных клинических исследований МХ с упором на побочные эффекты со стороны желудочно-кишечного тракта (ЖКТ). МХ 7,5 и 15 мг (n=893 и 3282) сравнили с пироксикамом 20 мг (n=906), диклофенаком 100 мг с замедленным высвобождением (n=324) и напроксеном 750–1000 мг (n=243). Что касается всех побочных эффектов со стороны ЖКТ, МХ в дозах 7,5 и 15 мг показал статистически значимое превосходство перед всеми препаратами сравнения в объединенном анализе двойных слепых исследований РА и ОА, при обследовании несерьезных событий ЖКТ, тяжелых событий ЖКТ, прерывистых из-за событий ЖКТ, диспепсии, боли в животе и событий верхних отделов ЖКТ. Там, где статистическая значимость не была продемонстрирована, в целом наблюдалась тенденция в пользу МХ. Улучшенный профиль безопасности ЖКТ МХ был связан с его преимущественным ингибированием индуцибельного ЦОГ-2 по сравнению с конститутивным ЦОГ-1 [27].
A. Barner проанализировал двойные слепые испытания с участием более 5000 пациентов с ОА и РА и выявил, что МХ в дозах 7,5 и 15 мг значительно более эффективен, чем плацебо, и по эффективности сопоставим со стандартными НПВС, такими как напроксен 750–1000 мг, пироксикам 20 мг и диклофенак 100 мг замедленного освобождения. В глобальном анализе безопасности обе дозы МХ вызывали значительно меньше побочных эффектов со стороны ЖКТ, чем препараты сравнения (p<0,05) [28].
Dequeker J. et al. провели крупномасштабную оценку безопасности и эффективности терапии, ингибирующей ЦОГ (SELECT), при ОА.
6 SELECT представляло собой проспективное рандомизированное двойное слепое исследование с двумя фиктивными тестами, проведенное в 12 странах. В этом исследовании сравнивались две схемы: МХ 7,5 мг внутрь 1 раз в сутки в течение 28 дней и пироксикам 20 мг внутрь 1 раз в сутки в течение 28 дней. Участники были набраны из общей практики и имели ОА бедра, колена, кисти или позвоночника. Основными конечными точками этого исследования были частота побочных эффектов (особенно со стороны ЖКТ) и эффективность. Конечные точки оценивались с использованием отчетов о побочных эффектах и визуальной аналоговой шкалы (ВАШ) для оценки уменьшения боли при движении. Частота побочных эффектов была значительно ниже в группе МХ (22,5%) по сравнению с группой пироксикама (27,9%; р<0,001), в основном из-за значительно более низкой частоты побочных эффектов со стороны ЖКТ в группе МХ, чем в группе, принимавшей пироксикам (10,3 против 15,4%; р<0,001), при этом эффективность обоих препаратов была эквивалентной. Среднее уменьшение боли при приеме МХ составило 47%, при приеме пироксикама – 45% [29].
Крупномасштабное международное исследование по оценке безопасности МХ (MELISSA) организовано для изучения переносимости МХ по сравнению с диклофенаком. C. Hawkey et al. провели исследование по сравнению МХ и диклофенака: двойное слепое проспективное рандомизированное исследование с участием 9323 пациентов с симптоматическим ОА в течение 28 дней. Оно было разработано для сравнения переносимости, безопасности и эффективности двух агентов. МХ по 7,5 мг внутрь ежедневно получали 4635 пациентов, 4688 – 100 мг диклофенака с замедленным высвобождением (SR) перорально ежедневно. Переносимость оценивалась с использованием 4-балльной вербальной рейтинговой шкалы (VRS). Пациенты и врачи сообщили о побочных эффектах. Используя ВАШ, пациенты оценивали свою боль при активном движении и в состоянии покоя. Получавшие МХ 2517 (27%) пациентов сообщили о побочных эффектах по сравнению с 2983 (32%), принимавшими диклофенак (p<0,001). У 1211 (13%) пациентов, принимавших МХ, наблюдались побочные эффекты со стороны ЖКТ по сравнению с 1771 (19%), принимавшим диклофенак (p<0,001). Это испытание подтверждает результаты более ранних исследований, показывающих, что МХ имеет более высокий профиль переносимости со стороны ЖКТ (13% пациентов, испытавших побочные эффекты со стороны ЖКТ, по сравнению с 19% принимавших диклофенак) по сравнению с другими НПВС (p<0,001) [30].
G. Singh et al. проанализировали данные 24 196 пациентов из 28 исследований, большинство из которых наблюдались до 60 дней. Преобладающее большинство включенных в эти исследования лиц принимали НПВС по поводу различных заболеваний. Относительный риск ишемического инсульта для рофекоксиба и индометацина составил 1,26, пироксикама – 1,25, напроксена – 1,24, ибупрофена – 1,19, диклофенака – 0,98, целекоксиба – 0,97. Величина этого риска для МХ составила 0,88, и она оказалась такой же, как и у лиц контрольной группы, не принимавших НПВС. Таким образом, МХ не является фактором риска мозговых инсультов. Положительным свойством этого препарата является и отсутствие взаимодействия с антигипертензивными препаратами при их совместном применении [31].
Рядом работ подтвердили, что МХ по своему терапевтическому потенциалу нисколько не уступает другим НПВС при наиболее распространенных заболеваниях, характеризующихся болью мышечного и скелетного происхождения (ОА, боли в спине, РА, анкилозирующий спондилоартрит т.п.) [32–36].
Несколько авторов использовали МХ в качестве эффективного анальгетика при ортодонтическом обезболивании, учитывая, что он имеет меньше гастроинтестинальных побочных эффектов по сравнению с другими НПВС [37–40]. Mariana Orozco-Solís et al. продемонстрировали, что пациенты, получавшие 15 мг МХ до ортодонтической операции, имели лучший послеоперационный обезболивающий и антитризматический эффект по сравнению с пациентами, получавшими 100 мг диклофенака после удаления третьего моляра [41].
В последние годы появились работы по эффективному применению пероральных форм МХ в пред- и послеоперационном периодах при артроскопических вмешательствах, а также при протезировании тазобедренного и коленных суставов. Раннее предоперационное введение МХ было лучшим методом контроля боли по сравнению с послеоперационным введением при лечении ортопедических пациентов [42–45].
Существует еще один способ доставки МХ – трансдермальный. Jianmin Chen и Yunhua Gao изучили текущее состояние методов доставки MX через кожу. В этом обзоре продемонстрировано, что MX, вводимый через кожу, может поддерживать требуемые концентрации в тканях-мишенях, при этом сохраняя низкую концентрацию в плазме, что позволяет избегать раздражения MX в ЖКТ и уменьшать системные побочные эффекты. Кроме того, местное введение MX также вызывало те же фармакологические эффекты, что и внутривенное введение, но с более низкой концентрацией MX в плазме, что дает преимущество за счет снижения системных побочных эффектов. Многие исследования доказали, что доставка MX через кожу хорошо переносится кожей, не вызывая эритему или отек [46].
В последнее десятилетие был разработан новый внутривенный нанокристаллический коллоидный дисперсии МХ (Мелоксикам IV) для лечения острой боли [47]. Недавно был завершен ряд исследований фаз 2 и 3 для оценки эффективности и безопасности внутривенного МХ в качестве лечения послеоперационной боли в различных клинических условиях [48–52]. Sergio Bergese et al. на основании своих материалов исследования подчеркнули, что МХ для внутривенного введения имеет профиль безопасности, аналогичный плацебо, и снижает потребление опиоидов, являясь «опиоидсберегающим» препаратом [53].
R. Wong в своем обзоре описала, что противовоспалительные препараты играют роль в лечении и профилактике рака. Исследования последних нескольких десятилетий показали, что НПВС могут снижать риск некоторых видов рака. Ингибирование ЦОГ можно рассматривать как хорошую стратегию, поскольку некоторые продукты активности ЦОГ (например, простагландин Е2 – PGE2) участвуют в онкогенезе. Было показано, что PGE2 увеличивается в раковых клетках [54], способен стимулировать пролиферацию и инвазию раковых клеток [55]. Сообщалось, что сигнальный путь COX-2/PGE2 играет решающую роль в колоректальном онкогенезе. Исследования показывают, что увеличение экспрессии ЦОГ-2 и PGE2 поддерживает выживаемость клеток колоректального рака, особенно в микроокружении опухоли, лишенном глюкозы [56]. Поскольку НПВС являются хорошо известным ингибитором ЦОГ, они неизбежно становятся популярным противораковым противовоспалительным средством для лечения и профилактики рака [57]. МХ как препарат с селективной ингибирующей способностью ЦОГ-2, принимаемый длительными курсами или постоянно, может быть средством выбора в онкологической практике.
В ЦНИЛ Кемеровского государственного медицинского университета были проведены исследования на фармацевтическую эквивалентность нескольких отечественных генериков с оригинальными препаратами двумя методами. Одним из отечественных генериков был препарат Амелотекс (ЗАО ФармФирма Сотекс, Россия). Оригинальные препараты (Boehringer Ingelheim International GmbH, Германия) были куплены в Италии (Mobiс), Болгарии (Movalis) и в России (Мовалис).
Авторы статьи проанализировали инфракрасные спектры (ИК) оригинальных препаратов (рис. 1) и российских генериков. При обработке ИК-спектров использована методология, представленная в работе [58]. Структурный анализ по ИК-спектрам сводится к сопоставлению характеристических полос поглощения и их отнесению к соответствующим структурным элементам. Отнесение проводится с учетом численных значений частот максимумов поглощения, контура (формы) и интенсивности полос. При анализе полученных спектральных данных у нативных образцов установлено наличие характеристических полос поглощения, позволяющих характеризовать препарат и его производителя.
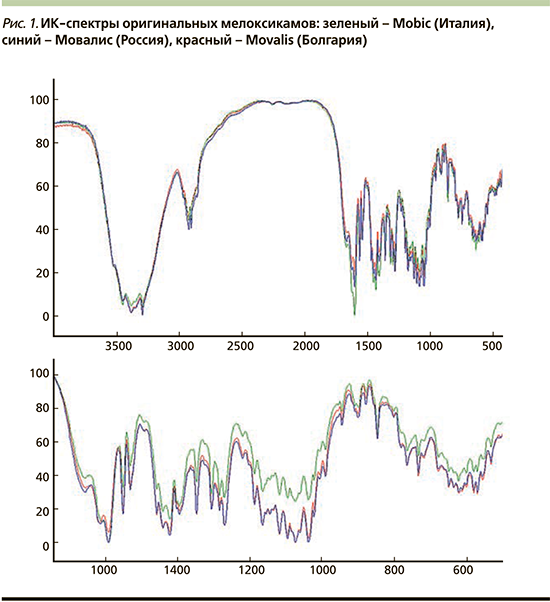
Для оригинальных препаратов сходимость спектральных характеристик составила более 95%, хотя имелись и некоторые различия, что очень удивило авторов. При этом ценовая разница была очевидной – самая дорогая таблетка МХ продавалась в аптеках Кемерова (Россия) (рис. 2). Путем несложных расчетов мы подсчитали цену одной таблетки в рублях: «итальянский» оригинальный МХ стоил 24,5 руб. одна таблетка, «болгарский» – 31, «российский» – 37 руб. (курсы Центробанка России евро и болгарского лева к рублю мы взяли от 08.11.2020).
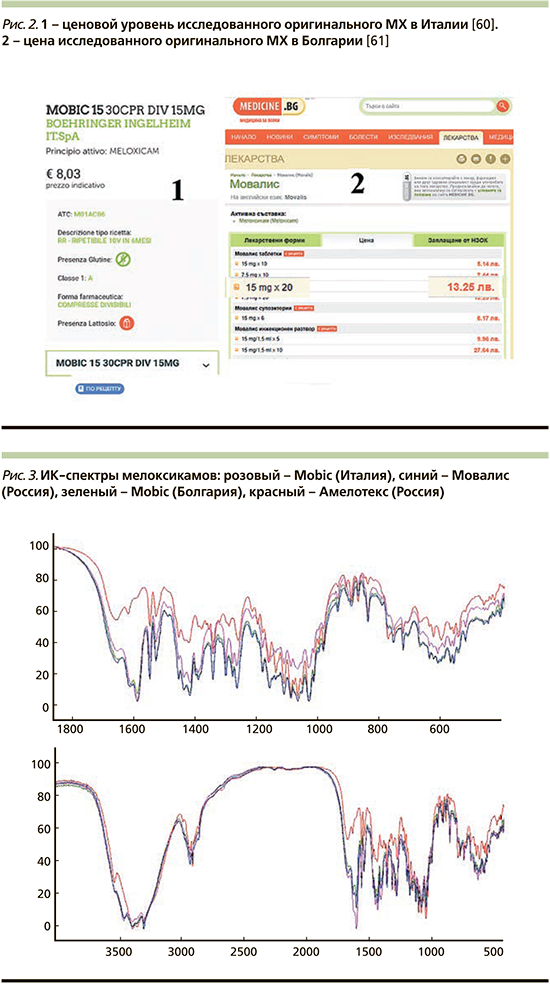
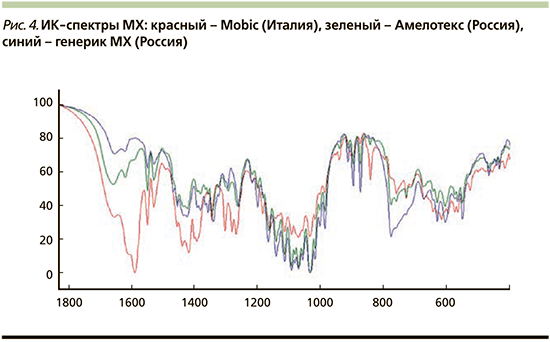
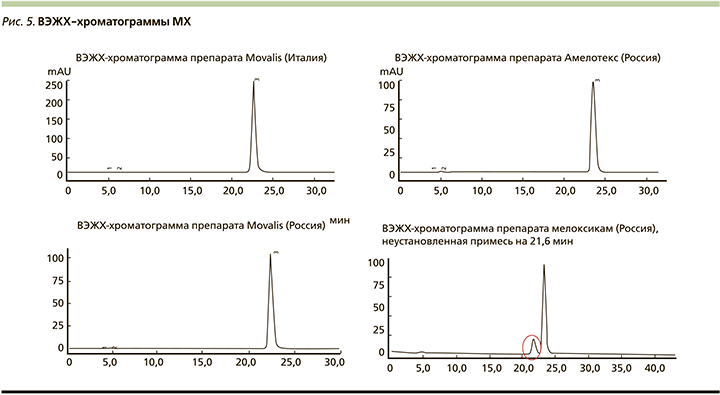
В свою очередь можно отметить, что воспроизведенные лекарственные препараты характеризуются уникальной спектральной спецификацией. Сходимость спектральных характеристик между оригинальным МХ (Mobiс) и Амелотексом (Россия) были порядка 92%, а сходимость спектральных характеристик с другим российским генериком не превышала 70% (рис. 3–4). Цена одной таблетки Амелотекса 15 мг от 08.11.2020 в Кемерове была 7,5 руб. [60].
Хочется задать вопрос производителю «оригинальных мелоксикамов»: какой из них все-таки референсный или эталонный, от которого из них отталкиваться при определении различных видов эквивалентности?
Далее мы провели исследование ВЖЭХ (высокоэффективную жидкостную хроматографию). Работа выполнена на ВЖЭХ-хроматографе Shimadzu LC-20 Prominence с диодно-матричным детектором Shimadzu SPD20MA. Амперометрическое детектирование выполнено на хроматографе ВЖЭХ- Цвет Яуза-04. В качестве амперометрического детектора использовался стекло-углеродный электрод СУЭ. Перед использованием СУЭ был обработан ультразвуком в ацетонитриле и деионизированной воде в течение 5 минут. Впоследствии он был предварительно электрохимически обработан в 0,1 М H2SO4 в режиме 50 потенциальных циклов от -1,7 до +2,0 В (против SCE) и тщательно промыт деионизированной водой. Использовались хроматографическая колонка Gemini 5 мкм С18, 110А, 250×4,6 мм; предколонка Security Guard Gartridge (C18) Phenomenex (США); объем инжекции – 20 мкл. Температура колонки составила 30°. Режим хроматографирования изократический. Скорость потока – 1,2 мл/мин. Подвижная фаза состояла из смеси водного раствора калия монофосфата 20 мМ и ацетонитрила (60: 40, об/об) с рН 3,5, достигнутого добавлением о-фосфорной кислоты. Подвижная фаза была отфильтрована через стеклянный фильтр и дегазировалась ультразвуком после смешивания.
Исходный раствор Мх (0,5 мг/мл) готовили с использованием 50% MeOH. Вторичные стандартные растворы МХ были приготовлены путем разбавления исходных растворов 50%-ным MeOH. Рабочие стандартные растворы МХ были получены путем разбавления вторичного стандартного раствора. Калибровочные стандарты МХ (конечные концентрации: 1000, 1200, 1400, 1600, 1800, 2000, 2400, 2500, 3000, 3500, 4000, 4500, 5000, 5500 мкг/мл) подготавливались независимо. Все растворы хранились при температуре 4°C.
Линейность метода оценивалась с помощью калибровочной кривой в диапазоне 400–5500 мкг/мл МХ. Калибровочная кривая получена путем построения отношения площадей МХ в зависимости от концентрации МХ с использованием метода наименьших квадратов линейного регрессионного анализа. Пробоподготовка проходила согласно принципам, описанным в работе [63].
По данным хроматографического анализа установлена сходимость времени удержания МХ. Хроматограмма у всех оригинальных препаратов представлена одним хроматографическим пиком. Однако на хроматограмме образца отечественного генерика МХ обнаружен неидентифицированный компонент (рис. 4). Как клинически проявит себя этот компонент, можно только предполагать.
Таким образом, МХ не только обладает выраженными противовоспалительным и анальгетическим действиями, но и характеризуется хорошей переносимостью и высокой безопасностью. МХ сегодня – препарат первого ряда для многих пациентов, страдающих острыми и хроническими заболеваниями суставов и позвоночника. Спектр побочных эффектов у него намного ниже, чем у неселективных и селективных ингибиторов ЦОГ. Эти его свойства наряду с высокой клинической эффективностью способствовали его широкому внедрению в комплексную терапию не только воспалительных и дегенеративных ревматических заболеваний, но и многих других патологических состояний. Генерик МХ Амелотекс (ЗАО ФармФирма Сотекс, Россия) продемонстрировал очень высокую фармакохимическую эквивалентность с «оригинальными препаратами», поэтому его можно рекомендовать всем пациентам, которым показан этот препарат.


