Введение
Ревматоидный артрит (РА) – одно из наиболее распространенных как в мире, так и в России аутоиммунных заболеваний, приводящее к ранней инвалидизации, в связи с чем необходимость совершенствования клинической тактики ведения пациентов РА очевидна [1]. В последние годы непосредственно РА рассматривается как фактор риска развития тяжелых хронических коморбидных состояний, служащих наиболее значимым предиктором смертности для данного контингента больных [2–4]. Имеются научные сведения о значительной распространенности метаболического синдрома (МС) среди больных РА [5, 6], а его компоненты – абдоминальное ожирение и инсулинорезистентность, служат пусковым механизмом поражения печени (печеночный компонент МС) с развитием неалкогольной жировой болезни печени (НАЖБП) [7, 8].
По данным эпидемиологических исследований, НАЖБП – самое распространенное хроническое заболевание печени среди населения, в т.ч. на территории России, особенно в Южном регионе [9–11]. Ряд исследований указывает на бόльшую частоту развития заболеваний системы пищеварения среди пациентов с РА, чем в популяции [12, 13]. Результаты работ, в которых оценивается коморбидная желудочно-кишечная патология у больных РА, противоречивы [14, 15]. Проведенный научный поиск выявил отдельные сведения по данному вопросу, но серьезных исследований, которые изучали бы частоту НАЖБП среди больных РА, мы не обнаружили. Вместе с тем ведущие в этой области ученые делают определенные выводы: пациентов с РА и МС следует дополнительно обследовать с целью своевременной диагностики НАЖБП [16, 17]. В современной клинической практике принято выделять три основные клинико-морфологические формы НАЖБП: стеатоз печени, неалкогольный стеатогепатит (НАСГ) без фиброза или с фиброзом печени и цирроз печени. При этом нет связи с потреблением алкогольсодержащих напитков в гепатотоксичных дозах [18]. По данным литературы, до 80% больных имеют стеатоз и доброкачественное течение НАЖБП, но примерно у каждого третьего пациента с НАСГ определяется прогрессирующая форма, ассоциируемая с гепатоцеллюлярным повреждением и воспалением с развитием фиброза печени, ведущего к циррозу [19]. Доказано, что фиброз печени – независимый предикторный фактор выживаемости пациентов с НАЖБП: у лиц с фиброзом печени F3–4 показатель летальности значительно выше, чем у лиц с менее выраженным фиброзом [20]. Таким образом, без учета вклада серьезного коморбидного окружения реализовать основную тактику – Treat to Target (до достижения цели) – в отношении больного РА не представляется возможным [2, 21].
С учетом вышеизложенного своевременное выявление НАЖБП у больных РА на фоне МС считается крайне важной диагностической позицией клиницистов-интернистов.
Цель исследования: изучить частоту встречаемости НАЖБП и ее клинико-морфологических форм (стеатоза, НАСГ, фиброза) у больных РА с МС в условиях Краснодарского края; оценить фиброз печени с помощью интернет-калькулятора и провести математический поиск более точной предикторной модели определения фиброза печени.
Методы
На 1-м этапе провели ретроспективный анализ выписных эпикризов 365 стационарных больных. Были выделены 300 (82,2%) пациентов с РА и коморбидным фоном, из них 178 (59,3%) – с МС, а далее из этой группы после ультразвукового исследования (УЗИ) печени и при наличии УЗИ-признаков жировой дистрофии печени отобрали группу больных РА с НАЖБП для комплексного обследования. Диагностику МС проводили по алгоритму в соответствии с клиническими рекомендациям по коморбидной патологии 2017 г. [22]. Диагностику НАЖБП осуществляли согласно клиническим рекомендациям по диагностике и лечению НАЖБП Российского общества по изучению печени и Российской ассоциации по гастроэнтерологии 2015 г., а также с учетом международных клинических рекомендаций по лечению НАЖБП, диабета и ожирения 2016 г. [23, 24].
Помимо рутинных анализов исследовали биохимические параметры: общий билирубин, аспартатаминотрансферазу (АСТ), аланинаминотрансферазу (АЛТ), γ-глутамилтранспептидазу (ГГТ), щелочную фосфатазу, общий белок и белковые фракции, глюкозу, гликированный гемоглобин (НbА1с), ферритин, трансферрин, креатинин, общий холестерин (ОХ), липопротеиды низкой плотности (ЛПНП), липопротеиды высокой плотности (ЛНВП), триглицериды (ТГ), С-реактивный белок (СРБ). Оценивали анамнез, антропометрические показатели (рост, масса тела, индекс массы тела – ИМТ), объем талии (ОТ), а также итоги анкетирования по МАST для исключения злоупотребления алкоголем. Критерием исключения стали возраст старше 70 лет, ожирение вторичного генеза, онкологическая патология, органические заболевания толстой кишки, алкогольное поражения печени, наличие гепатита другой этиологии. В группе с НАЖБП (n=58), дополнительно проведена калькуляция по шкале FLI (Fatty Liver Index – индекс стеатоза печени): баллы FLI<30 указывали на то, что стеатоз следует исключить, от 30 до 60 – на высокую вероятность стеатоза печени; калькуляция по шкале FIB-4 (fibrosis 4 score calculator) для НАСГ: показатель >0,675 – фиброз печени минимально вероятен, <1,3=F0–F1 – вероятен, а при ≥2,67=F3–F4 – доказан с точностью AUROC до 0,80.
Статистический анализ первой выборки пациентов (n=184), имеющих данные антропометрии, произведен с помощью таблиц сопряженности по ранговым переменным ИМТ и FLI с разделением по номинальной переменной «Пол». Взаимная независимость ранговых переменных проверена χ2-критерием по Пирсону, χ2-критерием с поправкой на правдоподобие (отношение правдоподобия) и тестом Мантеля–Хэнзеля (линейно-линейная связь), показавших максимальную значимость (р<0,001), т.е. для мужчин и для женщин доказана статистически значимая зависимость FLI от ИМТ.
По второй выборке пациентов с НАЖБП (n=58) проведен статистический анализ 16 параметров с помощью относительной шкалы и вычислены их описательные статистики (М, SE, SD, As, Ex и др.), а на основании их анализа выбрано 14 показателей, подчинявшихся нормальному распределению (коэффициенты эксцесса Ex и асимметрии As по модулю не превысили 1,5). Парный корреляционный анализ 14 переменных позволил выделить среди них те, которые статистически значимо связаны (Знч.2ст.<0,05 – двусторонний тест) с диагнозом фиброза F3 и F4 и не связаны статистически значимо между собой (Знч.2ст.>>0,05 – двусторонний тест). Таким образом, найдены параметры FIB-4, FLI и ТГ и их пригодность к многомерному статистическому анализу (дискриминантного) проверена с помощью критерия равенства групповых средних лямбда Уилкса (λ Уилкса), а также доказано наличие дискриминирующих особенностей переменных FIB-4, FLI и ТГ (значимость показателей для трех групп менее 0,05). Составлена матрица внутригрупповых статистических различий, доказаны отсутствие корреляционной связи и пригодность данных для построения дискриминантной модели – ДМ (парные коэффициенты корреляции переменных существенно меньше 0,5). Оценка качества построенной ДМ произведена по собственным значениям коэффициента канонической корреляции между рассчитанными значениями и реальной принадлежностью к группе. В качестве индикатора точности прогнозирования вычисленной дискриминантной функции принята площадь под кривой ROC (AUROC). Корреляционный анализ и проведение математического поиска ДМ как предикторной модели фиброза печени осуществляли с помощью приложения IBM SPSS.
Результаты
Из всей когорты больных РА выявлены 58 (32,6%) пациентов с МС и НАЖБП. В этой группе при оценке сопряженности двух выборок по критериям «Пол» и «ИМТ» и, соответственно, с критерием «Стеатоз» высокой вероятности (FLI>30 ЕД) неалкогольный стеатоз печени (НАСП) диагностирован у трети (19/32,8%) больных, причем каждый второй пациент независимо от пола был со 2-й степенью ожирения (56,6%), каждый третий – с 1-й (31,5%) и только каждый десятый – с избытком массы тела (11,9%). Вместе с тем среди мужчин НАСП выявлялся в 1,7 раза чаще (40,6% у мужчин против 28,3% у женщин). НАСГ подтвержден у 39 (67,1%) больных, причем НАСГ с «вероятным фиброзом» – у 14 (35,9%), НАСГ с фиброзом (FIB-4≥2,67) выявлен только у 1 (0,3%) пациентки.
Был выполнен детальный корреляционный анализ для уровня значимости 0,05 между FLI (стеатозом) и различными компонентами МС, а также лабораторными критериями синдрома поражения паренхимы печени. Выявлены сильные корреляционные связи (в диапазоне 0,7–0,9) между FLI и ИМТ (r=0,856), а также дислипидемией (r=0,828), особенно с показателями ОХ (r=0,853) и ТГ (r=0,716). Прямая значимая корреляционная связь также отмечена между FLI и ГГТ (r=0,789) – одним из показателей, характеризующих синдром воспалительно-некротических процессов в печени. Это также подтверждают уровни трансаминаз выше пороговых значений при НАСП: АСТ=79,7±7,75 и АЛТ=74,7±9,57, причем имеется некоторое превалирование уровня АСТ над АЛТ, что указывает на более глубокое повреждение печеночных клеток, а это наряду с повышенным уровнем ГГТ=68,1±5,15 дает возможность косвенно оценить тяжесть повреждения гепатоцитов у этих больных (умеренная степень активности).
Так как почти у двух третей больных РА с МС выявлена НАСГ, которая часто приводит к фиброзным изменениям печени, и в трети случаев у них определен фиброз, относящийся к категории «вероятный», мы предприняли попытку поиска более точной предикторной модели оценки фиброза. Для этого из выборки с подтвержденным диагнозом НАЖБП вычислены описательные статистики для 16 показателей: из них 14 использованы в калькуляционных шкалах – возраст, ИМТ, ОТ, АЛТ, АСТ, СРБ, СОЭ, глюкоза, НbА1с, ОХ, ЛПНП, ЛПВП, ТГ, креатинин, и 2 показателя – индексы FLI и FIB-4. Анализ этих показателей указывает на соответствие их нормальному распределению и принадлежности 12 из них параметрическим критериям.
Для корреляционного анализа кроме указанных введены дихотомические показатели – пол (муж. – 1; жен. – 0) и фиброз (болен – 1; здоров – 0). Данные анализа сведены в табл. 1.
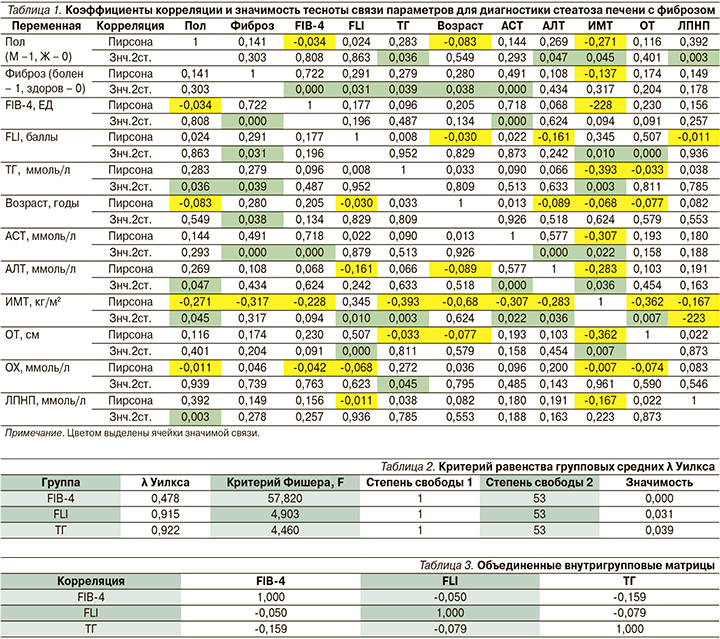
Анализ данных табл. 1 показывает значимые связи для парных корреляций: «болен–фиброз» с критериями FIB-4 и АСТ (р<0,01) и «болен–фиброз» с критериями возраст, ТГ, FLI (р<0,05). Так как калькуляционный расчет фиброза уже включает показатели АСТ и возраст, для дискриминантного анализа в качестве независимых переменных выбраны только три переменные: FLI, FIB-4 и ТГ. Получены следующие характеристики групповых средних λ Уилкса (табл. 2).
Значимость показателей для трех групп менее 0,05 доказывает наличие дискриминирующих особенностей данных переменных – FLI, FIB-4 и ТГ.
Также была составлена матрица внутригрупповых различий этих переменных (табл. 3).
Из табл. 3 видно, что парные коэффициенты корреляции переменных существенно меньше 0,5, что доказывает отсутствие корреляционной связи и их пригодность к построению ДМ.
Оценка качества построенной ДМ произведена по собственным значениям (табл. 4).
Значение коэффициента канонической корреляции между рассчитанными значениями ДМ и реальной принадлежностью к группе «фиброз» (0,771>0,700) удовлетворительное. Собственное значение 1,464>1,000 свидетельствует о высокой точности построенной ДМ.
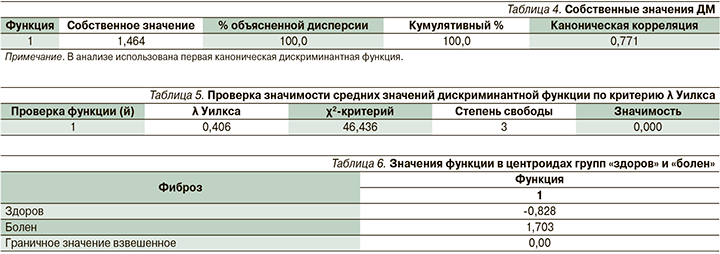
Высокая значимость различий средних значений дискриминантной функции 0,000<<0,050 подтверждена показателем λ Уилкса (табл. 5).
Далее определены нормированные коэффициенты канонической дискриминантной функции, показывающие относительный вклад каждой переменной в различие трех исследуемых групп, – это FIB-4=0,946, FLI=0,332, ТГ=0,416 при функции=1,0, т.е. вклад FIB-4 в 2,8 раза выше, чем FLI, и в 2,3 раза выше, чем ТГ.
Для построения ДМ использовали рассчитанные коэффициенты канонической дискриминантной функции: FIB – 2,784, FLI – 0,037, ТГ – 0,296, (константа – 5,598). Таким образом, ДМ имеет вид:
d=-5,598+2,784 ×1+0,037 ×2+0,296 ×3, где ×1 – FIB-4; ×2 – FLI; ×3 – ТГ.
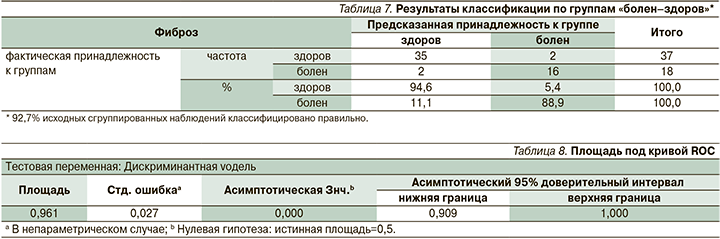
Вместе с тем для практического использования ДМ в целях прогнозирования фиброза печени необходимо знать центроиды групп «здоров» и «болен» (табл. 6).
Из табл. 6 видно, что граничное значение разделяет группы «здоров» и «болен». Результаты классификации по данным группам – «болен–здоров» – представлены в табл. 7.
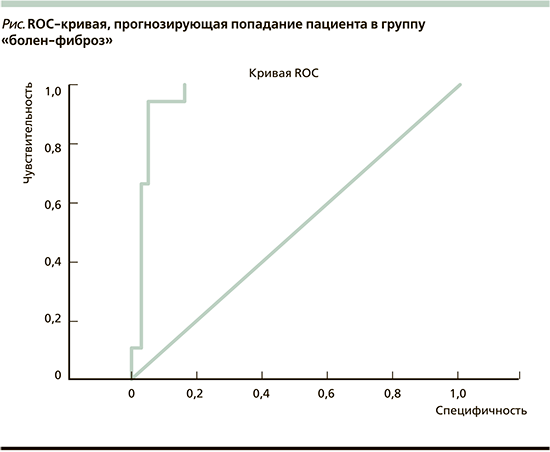
Индикатором точности прогнозирования вычисленной дискриминантной функции служит площадь под кривой ROC (AUROC), которая для кривой с нулевой степенью прогнозирования равна 0,5, для максимальной степени прогнозирования – 1.
Путем построения ROC-кривой (см. рисунок) определено значение площади – 0,961, доказывающей высокую точность ДМ прогнозирования фиброза печени, причем 95% доверительный интервал принадлежит диапазону 0,909–1,000. Таким образом, дискриминантной модели d=f(FIB-4+FLI+ТГ) можно присвоить рабочее название FIB-4+, поскольку главный вклад в ДМ вносит значение индекса FIB-4.
Кривая ROC представлена на рисунке, а значения площади – в табл. 8.
Обсуждение
В связи с тем что НАЖБП – это прежде всего морфологические изменения в печени, «золотым» стандартом диагностики этого заболевания считается биопсия печени. Надо признать, что это инвазивная методика, сопряженная с рядом осложнений, а биоптат представлен лишь ограниченным участком паренхимы печени, поэтому трактовка патоморфологических данных может быть достаточно условной. В настоящее время для предикторной неинвазивной диагностики стеатоза и фиброза печени у пациентов с НАЖБП предложено множество тестов/индексов, основанных на моделях рутинных клинических и лабораторных показателей пациентов. Для дискриминации пациентов с выраженным фиброзом и циррозом печени (F3–F4) в практике широко используют известные индексы АPRI, BARD, NFS, FIB-4, при этом наибольшая диагностическая точность определения фиброза F3–F4 (АUROC≥0,80) продемонстрирована последними тремя тестами. Важно отметить, что эти простые тестовые модели определения фиброза печени имеют хороший показатель отрицательной прогностической ценности (NPV), следовательно, с достаточной вероятностью могут исключить выраженный фиброз у больных НАЖБП, но показатель положительной прогностической ценности (РРV) для этих индексов является скромным (в пределах 27–79%), поэтому для точной верификации фиброза печени пациентам с высокими баллами рекомендуют дополнительные исследования, в т.ч. биопсию. В проведенном нами исследовании показана возможность более успешной неинвазивной оценки фиброза печени с помощью предлагаемой ДМ, имеющей вид математической шкалы: d=-5,598+2,784 ×1+0,037 ×2+0,296 ×3, где ×1 – FIB-4; ×2 – FLI; ×3 – ТГ.
Заключение
С учетом полученных данных можно сделать вывод о тесной взаимосвязи компонентов МС и НАЖБП у пациентов, страдающих РА. Доказано, что каждый второй (56,6%) пациент с РА и НАЖБП имел 2-ю степень ожирения, каждый третий (31,5%) – 1-ю. Частота встречаемости НАЖБП в исследуемой когорте была в целом следующей: 32,6% случаев, из них НАСГ – в 67,1% случаев. При калькуляционной оценке «вероятный фиброз» печени диагностирован у каждого третьего (35,9%) пациента. Путем математического поиска определена математическая формула (шкала) для более точной предикторной оценки фиброзапечени.
Признаем, что данный фрагмент нашего исследования выполнен на небольшом объеме выборки, однако предлагаемая калькуляционная шкала FIB-4+ дает обнадеживающие результаты диагностики фиброза (F≥3) печени у больных НАЖБП, что требует дополнительных исследований, способных подтвердить диагностическую точность предлагаемой шкалы, а она в свою очередь может быть эффективным неинвазивным и малозатратным методом оценки фиброза печени, выполняемым в любом лечебном учреждении, где рутинно исследуются входящие в шкалу биохимические показатели.
В заключение хотелось бы отметить наличие в современных клинических рекомендациях по ведению больных РА важного положения для достижения ремиссии (низкой активности) заболевания – снижение риска коморбидной патологии, т.к. именно характер коморбидных заболеваний имеет большое значение для выбора тактики лечения с точки зрения как эффективности, так и безопасности терапии. Принимая во внимание полученные данные о значительной распространенности НАЖБП среди больных РА, смеем надеяться, что наше исследование будет полезным научным вкладом в дело разработки положения об активном выявлении и своевременном лечении НАЖБП у больных РА на фоне МС.
Благодарности. Авторы статьи выражают особую благодарность А.А. Луговому, канд. техн. наук, доценту, ФГБОУ ВО «Кубанский государственный университет», за безвозмездную помощь в проведение математического поиска предикторной модели оценки фиброза печени.
По согласованию с И.С. Корольчук доцент А.А. Луговой не претендует на соавторство в данной статье.
Вклад авторов. Концепция и дизайн исследования – И.С. Корольчук. Сбор и обработка материала (ретроспективный анализ выписных эпикризов стационарных больных) – В.И. Кучерявый, Р.В. Коваленко. Организация клинического обследования пациентов с НАЖБП – И.С. Корольчук. Статистическая обработка данных – И.С. Корольчук, А.А. Луговой. Литера-турный обзор и написание текста статьи – И.С. Корольчук. Редактирование – И.С. Корольчук, А.А. Луговой.



