Введение
Остеоартрит (ОА) – самая частая форма артрита, которым болеют все больше жителей планеты. По оценкам международного исследования «Глобальное бремя болезни» (2013), почти 242 млн человек на нашей планете страдают ОА тазобедренного и/или коленного суставов [1]. Эта цифра будет только увеличиваться из-за старения человечества и распространенности ожирения. С 1990 по 2013 г. ОА показал рост на 75%. Это третье, наиболее быстро «растущее» заболевание, связанное с инвалидностью, вслед за сахарным диабетом (прирост – 135%) и деменцией (прирост – 84%). [2]
Боль, обусловленная ОА, приводит не только к инвалидизации пациентов, ухудшению качества жизни, но и к уменьшению ее продолжительности, являясь значимым предиктором риска смерти [3].
В настоящее время терапевтические подходы к лечению ОА связаны с нелекарственными методами, использованием обезболивающих средств (преимущественно из группы нестероидных противовоспалительных средств) и симптоматических препаратов замедленного действия, а также эндопротезированием сустава. Однако, несмотря на лечение, большинство пациентов продолжают испытывать хроническую боль. Этот факт заставляет более углубленно изучать механизмы боли при ОА.
В качестве основных причин болевого синдрома при ОА рассматривают локальные ноцицептивные процессы в суставе и околосуставных тканях – источник боли, а также нейрогенные механизмы (периферические и центральные), участвующие в формировании болевых ощущений и поддержании боли в хроническом состоянии. Немаловажное значение имеют коморбидные заболевания, такие как ожирение, сахарный диабет, психические расстройства: тревога, депрессия и катастрофизация боли.
Хроническое воспаление лежит в основе вовлечения нейрогенных механизмов в патогенез хронического болевого синдрома при ОА, определяет его интенсивность, а также качественные характеристики. Повторяющаяся стимуляция периферических рецепторов в результате длительного воспалительного процесса приводит к гиперактивности спинальных ноцицептивных нейронов – центральной сенситизации (ЦС) [4–6]. Она происходит в основном в результате повышенной продукции глутамата и субстанции Р на уровне спинного мозга. Глутамат является основным возбуждающим нейротрансмиттером в нервной системе и действует на три подгруппы рецепторов: рецептор α-амино-3-гидрокси-5-метил-4-изоксазелопропионовой кислоты, рецептор NMDA и семейство метаботропов, связанных с G-белком. В то время как α-амино-3-гидрокси-5-метил-4-изоксазелопропионовая кислота отвечает за базовый ответ на патологические раздражители, NMDA-рецептор усиливает и расширяет болевой ответ. Эти изменения модулируют пластичность центральной нервной системы, что приводит к вторичной гипералгезии и аллодинии – клиническим признакам ноципластической боли [7]. Ноципластическая боль возникает в отсутствие травмы, воспаления, а также поражения соматосенсорной нервной системы. Основным патогенетическим механизмом этого типа боли является ЦС. Наличие у пациента нейропатической и/или ноцицептивной боли не исключает возникновения боли ноципластического типа, в таком случае речь идет о боли смешанного характера [8].
По данным литературы, признаки ноципластической боли у пациентов с ОА встречаются с частотой до 30% [9–11], подтверждаются различными опросниками и исследованиями, демонстрирующими центральный генез боли.
Наиболее популярны диагностические опросники нейропатической боли DN4 и PainDETEC [12–14]. Они представляют собой перечень определенных характеристик боли, а именно: наличие у пациента онемения, жжения, покалывания, ползания мурашек, прострелов «как ударом тока» и др. В отсутствие признаков поражения соматосенсорной нервной системы высокие баллы по этим опросникам расценивают как признаки ЦС и ноципластической боли.
Одним из доказательств участия выраженной ЦС в патогенезе боли при ОА и сочетании ноцицептивной боли с ноципластической являются исследования эффективности препаратов центрального действия из группы антиконвульсантов (прегабалин). Однако такие исследования малочисленны, носят преимущественно сравнительный характер и не содержат практических рекомендаций по использованию прегабалина при ОА.
Цель исследования: оценить эффективность и безопасность комбинированной терапии, включающей ацеклофенак и прегабалин, по сравнению с монотерапией ацеклофенаком хронического болевого синдрома с признаками ноципластической боли у пациентов с ОА коленных суставов (ОАк).
Методы
Рандомизированное открытое клиническое исследование проводилось в соответствии с принципами Хельсинкской декларации, протокол исследования был одобрен на заседании этического комитета ФГБНУ НИИР им В.А. Насоновой.
В исследование были включены 60 женщин, средний возраст – 59,8±4,5 года, с ОАк с признаками ноципластической боли.
Критерии включения: женщины в возрасте от 45 до 65 лет с первичным ОАк, установленным согласно критериям Американской коллегией ревматологов 1991 г. [15]; наличие признаков ноципластической боли оценивали с помощью опросника DN4 (>4 баллов).
Критерии невключения: отсутствие признаков ноципластической боли – DN4 <4 баллов; сопутствующие заболевания, сопровождающиеся хроническим болевым синдромом, не связанным с ОА (корешковый синдром, диабетическая или алкогольная полиневропатия и др); психические заболевания, затрудняющие адекватную оценку болевого синдрома, эмоционального состояния и заполнение опросников; противопоказания к назначению прегабалина; терапия хондропротекторами в течение по крайней мере 3 месяцев до начала исследования.
Все пациентки подписали информированное согласие на участие в исследовании. После заполнения информированного согласия и скрининга всех пациенток распределили в две группы с последующим наблюдением в течение 42 дней на фоне комбинированной терапии (I группа) – ацеклофенак в дозе 100 мг 2 раза в сутки в сочетании с прегабалином в дозе 150 мг/сут в течение 14 дней с последующим титрованием до 300 мг/сут в течение 28 дней или монотерапии (II группа) – ацеклофенак в дозе 200 мг/сут. Рандомизация производилась на основании порядкового номера: пациентки с нечетными порядковыми номерами (1, 3...) составили I группу, с четными (2, 4...) – II.
При неврологическом обследовании пациенток поражения соматосенсорной нервной системы выявлено не было, что позволило исключить нейропатический характер боли. Вместе с тем были обнаружены чувствительные нарушения (аллодиния, гипостезия и гиперестезия) в области не только пораженных коленных суставов (первичная зона), но и голеней, а в ряде случаев и бедер (вторичная зона).
Аллодиния (болевая реакция на неболевой стимул) отмечалась в области коленных суставов у 16 (26,7%), бедер у 2 (3,4%) и голеней у 7 (11,7%) из 60 пациенток, гиперестезия у 8 (13,4%), 1 (1,7%) и 13 (21,7%) соответственно. Чувствительные нарушения отсутствовали только у 8 (13,4%) больных, включенных в исследование. Выявленные чувствительные нарушения были анатомически нелогичными (топически не соответствовали какому-либо поражению нервной системы), а также в различных сочетаниях локализовались как в области, так и вне пораженного сустава (вторичная зона), что является характерным клиническим признаком ноципластической боли.
Перед началом исследования пациенты обследованных групп статистически не отличались по общему индексу WOMAC, DN4, Pain DETECT и визуальной аналоговой шкале (ВАШ) в покое; различия были отмечены только по длительности заболевания: в I группе длительность болезни была больше по сравнению со II: 14,0 (9,0–17,0) против 7,5 года (5,0–15,0; p=0,02, табл. 1).
На протяжении всего исследования выполнено три визита: на первом (исходном) проводилось клинико-неврологическое обследование, определялся индекс WOMAC, оценивалась интенсивность боли в покое по визуальной аналоговой шкале (ВАШ), наличие ноципластической боли (опросники DN4 и Pain DETECT), оценивалась эмоционально-аффективная сфера (опросник HADS) и качество жизни (опросник EQ-5D). Во время второго визита (на 14-й день) определяли индекс WOMAC и интенсивность боли по ВАШ. Во время третьего визита (на 42-й день) выполнялись исследования, аналогичные проведенным на первом визите.
Статистическая обработка материала проводилась с помощью компьютерной программы Statistiса-10.0. Для описания количественных переменных мы использовали методы описательной статистики: при нормальном распределении данные представлены в виде среднего значения (М) и стандартного отклонения (SD); данные, не имевшие нормального распределения, – в виде медианы и квартили. Для проверки статистических гипотез применялись параметрические и непараметрические критерии Манна–Уитни.
Результаты исследования
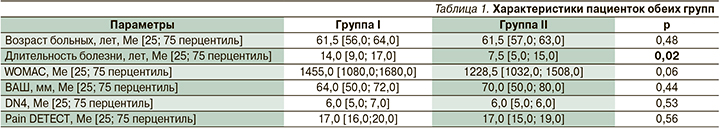
В результате терапии в обеих группах отмечалось достоверное уменьшение общего индекса WOMAC на всех трех визитах: I группа с комбинированной терапией: 1455,0 [1080,0;1680,0], 1139,5 [753,0; 1330,0] и 860,0 [491,0; 1282,0] соответственно (р=0,04); II группа на монотерапии нестероидными противовоспалительными средствами: 1228,5 [1032,0; 1508,0], 1099 [598,0; 1294,0] и 889 [769,0; 1271,0] соответственно (p=0,03) (рис. 1).
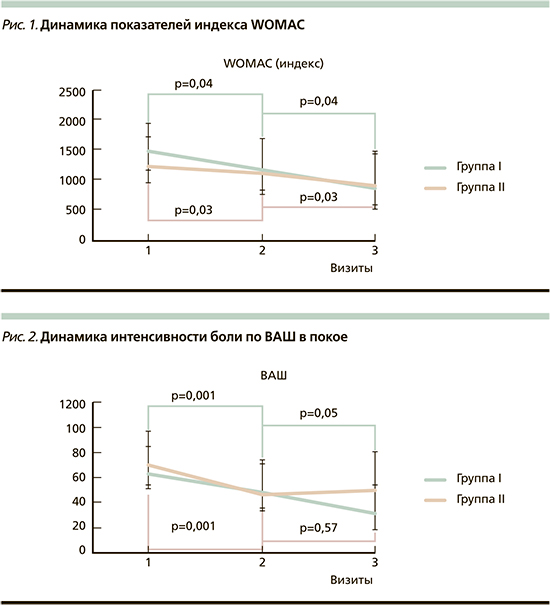
Интенсивность боли в покое в I группе достоверно снизилась через 14 дней терапии и еще в большей степени через 42 дня (различия были достоверными как между первым и вторым; 64,0 [50,0; 72,0] против 49,0 [33,0; 55,0] (р=0,001) так и между вторым и третьим визитами: 49,0 [33,0; 55,0] против 33,5 [22,0; 49,0] (p=0,05). Во II группе интенсивность боли по ВАШ в покое также снизилась через 14 дней: 70,0 [50,0; 80,0] против 48,0 [35,0; 58,0] (p=0,001), однако в последующем достоверно не изменилась: 48,0 [36,0; 58,0] против 53,0 [29,0; 62,0] (p=0,57, рис. 2).
Перед началом исследования достоверное различие между группами было выявлено лишь по показателю длительности заболевания. На фоне проводимой терапии в группе I, получавшей комбинированное лечение, на 3-м визите показатели DN4, Pain DETECT и интенсивность боли по ВАШ достоверно уменьшились по сравнению со II группой (табл. 2).
Качественные характеристики боли в двух группах до и после лечения оценивали с помощью опросника DN4. В I группе после лечения было выявлено статистически достоверное (p<0,005) уменьшение частоты ощущения жжения (на 53,3%), прострелов «как удар током» (на 50%), ползания мурашек (на 36,7%), покалывания (на 40%), онемения (на 33,3%), гипостерии (на 36,6%), аллодинии (на 10%), в то время как во II достоверно уменьшилась только частота зуда (на 13,3%) и болезненного ощущения холода (на 33,3%). Через 42 дня (визит 3) у пациентов обеих групп было выявлено достоверное снижение баллов по опросникам DN4 и Pain DETECT. Более выраженная положительная динамика ноципластической боли отмечалась у пациентов I группы, получавших комбинированную терапию. Во II группе средний показатель DN4 на 3-м визите был равен 5,0 [3,0; 6,0] баллам, что свидетельствует о сохранившемся ноципластическом компоненте болевого синдрома в отличие от I группы – 3,0 [1,0; 4,0] балла.
При оценке эмоционально-аффективной сферы с помощью опросника HADS перед началом терапии у пациентов обеих групп выявили умеренное тревожное расстройство (I группа – 9,0 [7,0; 14,0], II – 10,0 [8,0; 12,0]; p=0,89). Комбинированная терапия ацеклофенаком и прегабалином привела к достоверному уменьшению показателя тревоги в I группе (до 7,0 [4,0; 10,0]; p=0,001), в то время как при монотерапии ацеклофенаком данный показатель достоверно не изменился (9,0 [7,0; 12,0]; р=0,45), что указывало на сохранение субклинической тревоги.
Динамика показателей качества жизни по опроснику EQ-5D была достоверной и улучшилась в обеих группах (I группа – 0,520 [-0,020; 0,520] против 0,52 [0,52; 0,59]; р=0.001; II группа – 0,08 [-0,02; 0,52] против 0,52 [0,52; 0,52]; р=0,03).
Переносимость препаратов в обеих группах была хорошей. Побочные эффекты отмечены у 6 (20%) из 30 пациенток I группы в первые 3–5 суток от начала приема прегабалина в виде головокружения или ощущения «пьяной головы», самостоятельно купировавшихся в последующем. Дискомфорт и боли в эпигастральной области отмечены у 6 (20%) пациенток I группы и 7 (24%) – II. Добавление омепразола к основной терапии позволило купировать эти побочные эффекты. У 1 (3%) пациентки II группы во время лечения заподозрен инфаркт миокарда, в связи с чем она была исключена из исследования после второго визита (при дополнительном обследовании диагноз не подтвердился).
Обсуждение
Источники суставной боли (кость, мышцы, периартикулярные ткани) хорошо изучены в настоящее время. Исторически считается, что ОА представляет собой заболевание, обусловленное первичным повреждением хрящевой ткани. В здоровом суставе хрящ является аваскулярной структурой, не имеющей болевых рецепторов. При воспалении в суставе возникает патологический ангиогенез, вместе с кровеносными сосудами в хрящ прорастают нервы и пораженный сустав становится источником боли. Важным обстоятельством является то, что вновь образованные сосуды отличаются повышенной проницаемостью, что способствует хронизации воспаления [16].
Патологические изменения в суставах при ОА крайне неоднородны. Роль каждого из них должна быть оценена в каждом конкретном случае, для чего используются дополнительные методы исследования: рентгенологические, ультразвуковые (УЗИ) и нейровизуализация (МРТ).
В литературе много описаний несоответствия выраженности рентгенологических изменений в суставе и интенсивности болевого синдрома. От 15 до 81% пациентов, имеющих рентгенологические изменения, испытывают боль [17], по другим данным, до 40% пациентов не испытывают болевых ощущений, но имеют изменения на рентгенограммах [18].
МРТ – наиболее чувствительный метод диагностики поражения суставов. Он позволяет оценивать состояние мягких тканевых структур, в т.ч. синовиальной оболочки, хряща и субхондральной кости. Согласно международным данным, с помощью МРТ коленного сустава остеит выявляется у 272 (77,5%) из 351 человека с болевым синдромом по сравнению с 15 (30%) из 50 без боли в коленном суставе (р<0,001) [19, 20]. Полученные данные позволяют говорить о том, что, несмотря на корреляцию между наличием остеита и болью в суставе, у массы (30%) пациентов при наличии изменений на МРТ (в виде отека костного мозга) боли нет.
Наличие синовита также ассоциируется с болевым синдромом при ОА [21]. Гистопатологическое исследование синовиальной оболочки, полученной при тотальном эндопротезировании коленного сустава, показало достоверную корреляцию между наличием синовита и интенсивностью боли [22].
Однако около 44% пациентов после адекватно выполненного эндопротезирования коленного сустава продолжают испытывать боль, что свидетельствует о том, что не только периферические механизмы (локальное воспаление) принимают участие в генезе хронической боли [23]. Так, M.S. Kim (2018) показал, что у пациентов, имевших признаки ЦС после артропластики коленного сустава, наблюдалось больше послеоперационных осложнений (увеличение времени реабилитации, усиление болевого синдрома, необходимость в дополнительном обезболивании), чем у пациентов с ее отсутствием [24]. Таким образом, ЦС – не только фактор хронизации боли, но и причина недостаточной эффективности эндопротезирования и снижения функционального состояния пациентов после операции.
Патогенез хронического болевого синдрома сложен, включает нескольких типов боли: ноцицептивную, невропатическую и ноципластическую (обусловленную ЦС), что позволяет говорить о необходимости выбора механизм-обусловленной (патогенетической) терапии для более эффективного купирования болевого синдрома. Однако в реальной клинической практике врачи нередко сталкиваются со смешанной болью (overlap-синдромами), когда признаки воспалительной (ноцицептивной) боли перекрываются ноципластической болью. В таких случаях пациенты с ноцицептивной болью, описывая свои жалобы, зачастую используют ее различные «нейропатические» характеристики: жжение, онемение, усиление боли при прикосновении к суставу, «удары током» и др. В ранее проведенных исследованиях показано, что пациенты со смешанной болью при ОА составляют около 30% [25].
В наше исследование с помощью нейропатического опросника DN4 были специально отобраны пациенты с ОАк, предъявлявшие «нейропатические» жалобы, однако выявленные чувствительные нарушения были анатомически нелогичными (топически не соответствовали какому-либо уровню поражения нервной системы), и локализовались вне пораженного сустава, что является характерным клиническим признаком ноципластической боли. Кроме того, детальное неврологическое обследование не выявило признаков поражения соматосенсорной нервной системы, что исключает нейропатическую боль. Таким образом, все пациенты с ОА коленных суставов, участвовавшие в нашем исследовании, имели смешанную боль, включившую как ноцицептивный, так и ноципластический компоненты.
Основным препаратом, рекомендованным для терапии боли, связанной с ЦС, ноципластической боли, являются центральные анальгетики (антиконвульсанты), такие как прегабалин. Механизм действия данного препарата обусловлен его взаимодействием с дополнительной субъединицей (α-2-дельта-протеин) потенциал-зависимых кальциевых каналов в центральной нервной системе, что способствует его анальгетическому действию [26].
В 2013 г. S. Ohtori et al. изучили эффективность прегабалина в терапии болевого синдрома у пациентов с ОА. Были отобраны 89 пациентов с ОАк с последующим разделением их на три группы: первая получала прегабалин, вторая – сочетание прегабалина и мелоксикама, третья группа – мелоксикам. Оценка эффективности лечения проводилась на 1-й, 2-и 4-й неделях терапии. В результате показано, что наибольшая эффективность в отношении болевого синдрома была в группах, получавших прегабалин. Интенсивность боли по ВАШ в 1-й группе с 4,4±2,1 уменьшилась до 2,0±2,2 балла (р=0,03), во 2-й – с 3,4±2,0 до 1,0±1,2 балла (р=0.035). Полученные данные позволили сделать вывод, согласно которому болевой синдром при ОА обусловлен сочетанием ноцицептивного компонента и боли, связанной с ЦС/ноципластической болью, и требует комбинированной терапии [27]. Однако в приведенном исследовании не были выделены пациенты со смешанной болью, что не позволило представить конкретные практические рекомендации по применению прегабалина.
Эффективность прегабалина также была продемонстрирована на пациентах после тотального эндопротезирования суставов. Применение препарата в пред- и послеоперационный периоды приводило к достоверному (p<0,001) уменьшению интенсивности боли (с 80–90 до 20–40 мм по ВАШ) и уменьшало потребность в дополнительной анальгетической терапии уже в первые 2 суток и последующие 2 недели после операции [28].
В выполненном нами исследовании показана эффективность и безопасность комбинированной терапии, включившей препарат центрального действия прегабалин. У пациентов, получавших ацеклофенак и прегабалин, на протяжении всего периода наблюдения уменьшалась интенсивность боли в покое. Кроме того, в группе комбинированной терапии уменьшались проявления ноципластической боли – показатель опросника DN4 был ниже 4 баллов: 3,0 [1,0; 4,0] балла. Следует отметить анксиолитическое действие прегабалина, что также способствует снижению хронического болевого синдрома.
Показанием к назначению комбинированной терапии с включением прегабалина являются жалобы на жжение, онемение, усиление боли при прикосновении к суставу (аллодиния), «удары током» и др. В качестве скрининга пациентов ОА со смешанной болью можно использовать опросник DN4, который, изначально созданный для выявления нейропатической боли, в отсутствие поражения симпатической нервной системы выявляет признаки ноципластической боли. Например, при ОА показатель более 4 баллов может указывать на смешанный характер боли, включающей наряду с ноцицептивной и ноципластическую боль.
Заключение
Таким образом, использование в клинической практике опросника DN4 пациентами с ОА является удобным методом скрининга пациентов на наличие смешанной боли, обоснованием для консультации невролога с целью определения показаний к назначению прегабалина для эффективного контроля хронического болевого синдрома.


