Введение
В настоящее время в мире отмечается рост стойкой утраты трудоспособности за счет патологических состояний позвоночного столба, объединенных термином «болезни цивилизации». Среди них одно из ведущих мест принадлежит поясничнму остеохондрозу, занимающему 3-е место в структуре первичной инвалидности при заболеваниях нервной системы [5, 6].
Клинические проявления остеохондроза позвоночника составляют в структуре заболеваемости до 68% всех заболеваний нервной системы. На фоне общего нарастания частоты остеохондроза позвоночника отмечается увеличение в 2,2 раза числа больных среди лиц моложе 25 лет [8, 14].
Этиопатогенез остеохондроза позвоночника у людей в настоящее время представляет одну из наиболее актуальных проблем, недостаточно освещенную в научной литературе. Ее существенным звеном считается изучение гистологических изменений в тканях межпозвонковых дисков (МПД) при грыжах МПД позвоночника, среди которых наименее исследованные строение межклеточного вещества и содержание химических элементов при течении дегенеративного процесса. Диски дегенерируют гораздо раньше, чем другие ткани опорно-двигательного аппарата, первые однозначные признаки дегенерации поясничных дисков уже видны в возрастной группе 11–16 лет [3, 7, 12].
Современные исследования свидетельствуют: важнейшим звеном патогенеза является нарушение молекулярной структуры соединительной ткани, в которой происходят процессы ремоделирования, включающие как деградацию, так и синтез внеклеточного матрикса, составляющего основу межпозвонкового хряща. Прогрессирование патологического процесса в позвоночнике в значительной степени способствует изменениям метаболизма соединительной ткани, тесным образом связанной с нарушением микроэлементного баланса [1, 3].
Микроэлементы связаны с основными функциями организма: обменными процессами, ростом и развитием, размножением, кроветворением. Они входят в состав витаминов, металлоэнзимов, участвуют в синтезе белка, в обмене нуклеиновых кислот [4].
В современном мире все большее значение приобретают открытия и исследования, совершенные на стыке наук. Одним из наиболее перспективных в этом плане видится соединение биологических исследований и последних достижений в области физики. Получаемые результаты нередко приводят не только к переосмыслению концепций наук о живой природе, но зачастую и к значимым практическим результатам [8, 13].
Использование физико-химических методов исследования дает возможность получать данные в самых неожиданных областях медицинской биологии. В настоящее время в мировой практике применяются различные методы количественного определения химических элементов в биосубстратах человека [11]. Наиболее используемые методы – это атомно-абсорбционная спектроскопия, плазменная масс-спектрометрия и нейтронно-активационный анализ. Эти методы позволяют в одной пробе биосубстрата (кровь, волосы, ногти, моча) одновременно определять несколько микроэлементов, что очень важно для изучения их взаимовлияния. Каждый из этих методов имеет свои достоинства и недостатки [1, 2].
Инструментальный нейтронно-активационный анализ (ИНАА) – многоэлементный метод, который позволяет определять значительное число элементов в различных биосубстратах с исключительно высокой чувствительностью. К важным достоинствам метода относятся простая пробоподготовка, не требующая разложения пробы, поправки на холостой опыт, малый расход пробы, высокая селективность и исключительно высокая производительность. Пределы обнаружения отдельных элементов достигают 1 нг/г.
Целью настоящего исследования стала оценка изменения гомеостаза МПД, в частности изучение микроэлементного состава МПД при различных стадиях развития грыж поясничного отдела позвоночника с помощью ИНАА.
Методы
В исследование включили пациентов с грыжами поясничного отдела позвоночника на уровнях VL3–4, VL4–5, VL5–S1. Забор биоматериала проводился интраоперационно, при традиционной микродискэктомии. Все больные были распределены в три группы в зависимости от стадии развития грыжи диска и возраста. Первую группу составили 8 пациентов с начальной стадией развития дегенеративного процесса в дисках в возрасте от 24 до 36 лет (средний возраст – 29,5 лет). Клинико-неврологический статус характеризовался нестойким болевым синдромом (боли уменьшались в покое и при ходьбе, но усиливались при нагрузках), развитием нервно-мышечно-тонического синдрома и нарушением ортопедического статуса в виде рефлекторно-антальгической установки поясничного отдела позвоночника. Инструментальные методы исследования (спондилография, магнитно-резонансная томография, мультиспиральная компьютерная томография) указывали на начальные проявления остеохондроза с развитием грыжи диска размером от 3 до 5 мм [8, 13]. Удаленный фрагмент диска по консистенции был близок к нормальному, но творожистого характера, повышенной гидрофильности; фрагменты удаляли мелкими кусочками.
Вторую группу составили 7 пациентов со средней стадией дегенеративного процесса в дисках в возрасте от 37 до 44 лет (средний возраст составил 41 год). Клинико-неврологическая картина этих пациентов характеризовалась стойким болевым синдромом при ходьбе с незначительным уменьшением болей в покое в вынужденной позе, а также ограничением движения в позвоночнике, развитием мышечно-тонического синдрома и симптомов натяжения нервов. Рентгенологические данные указывали на развитие 2–3-й степеней развития остеохондроза [8, 13]. Удаленная часть грыжи по консистенции представляла собой волокнистую соединительную ткань, эластичную, растягивающуюся, но при этом быстро рвущуюся, диски удалялись частями. Фрагменты диска отличались от проб 1-й группы меньшей гидрофильностью.
Третью группу составили 7 пациентов с 3-й стадией развития дегенеративного процесса. Возраст пациентов колебался от 45 до 60 лет (средний возраст составил 53 года). Клиническая картина этих пациентов характеризовалась сильными стойкими болями, не уменьшающимися даже в покое, резким ограничением движения, ярко-выраженным мышечно-тоническим синдромом, симптомами натяжения нервов. Результаты инструментальных исследований констатировали 3–4-ю степени дегенеративно-деструктивных изменений позвоночно-двигательного сегмента позвоночника с развитием грыжи МПД интраканальной и подвязочной локализаций.
Исследование образцов биоматериала на содержание макро- и микроэлементов проводили в лаборатории активационного анализа Института ядерной физики АН Республики Узбекистан с помощью ИНАА, что позволило определить содержание 22 микроэлементов в дегенеративно-деструктивно измененных тканях МПД.
Методика подготовки образцов. Полученные интраоперационные фрагменты МПД были промыты дистиллированной водой и высушены до постоянного веса в сушильном шкафу при температуре не выше 60°С. Высушенные образцы растирали в фарфоровой ступке до однородной массы, затем взвешивали (по две навески: 40 мг – для анализа по короткоживущим радионуклидам и 90–100 мг – для анализа по средне- и долгоживущим радионуклидам) и упаковывали в маркированные полиэтиленовые пакеты.
Методика ИНАА определения элементов. ИНАА позволяет определять в одном образце более 20 элементов. При этом для их определения приходится прибегать к многократному облучению и достаточно длительному времени измерения. Для определения содержания элементов по нуклидам с различными периодами полураспада следовало применять различные временные режимы анализа (время облучения, остывания, измерения). Разные режимы требуют либо отдельных навесок образцов, либо использования одной навески для повторных облучений, что увеличивает время проведения анализа из-за необходимости выжидания распада короткоживущих нуклидов после первого облучения. После изучения характерных гамма-спектров активированных образцов были предложены следующие режимы:
1. Время облучения – 15 секунд, время остывания – 15 минут, время измерения – 100 секунд;
2. Время облучения – 15 секунд, время остывания – 4 часа, время измерения – 100 секунд;
3. Время облучения – 15 часов, время остывания – 10 дней, время измерения – 200 секунд;
4. Время облучения – 15 часов, время остывания – 30 дней, время измерения – 400 секунд.
Разработанная методика нейтронно-активационного определения элементов заключается в следующем:
Определение короткоживущих радионуклидов. Образцы вместе с эталонами упаковывали в полиэтиленовый контейнер и облучали в вертикальном канале реактора потоком нейтронов 5,1013 нейтрон/см2/с в течение 15 секунд. Измерение наведенной активности проводили дважды: через 15–10 минут после облучения для определения хлора и через 4 часа – для определения натрия, меди, калия и марганца.
Определение среднеживущих радионуклидов. Для определения содержания кальция, брома, лантана, золота те же образцы заворачивали в алюминиевую фольгу и облучали в мокром канале реактора в течение 15 часов. Измерение наведенной активности проводили через 10 дней после облучения по соответствующим нуклидам [9].
Определение долгоживущих радионуклидов. Для определения содержания долгоживущих радионуклидов облученные в течение 15 часов пробы измеряли через месяц после облучения по соответствующим гамма-линиям.
Для регистрации наведенной активности использовали детектор из германия высокой чистоты (V=120 см3) с разрешением 1,8 КэВ по гамма-линии Co-60 и гамма-спектрометр с компьютерным программным обеспечением. Обработка данных проводилась по программе GENIE 2000. Максимальная погрешность активационного метода определения элементов не превышала 12%. Проведенные исследования позволили определить более 20 химических элементов. Точность определения того или иного элемента проверяли сравнением полученных данных с аттестованными значениями стандартных образцов сравнения МАГАТЭ (IAEA-336, IAEA -375) и NIST Standard Reference Material 1572 – CITRUS LEAVES [9].
Статистическую обработку данных проводили с помощью пакета программ Microsoft Excel 2007 и Statistica 6.0.
Результаты
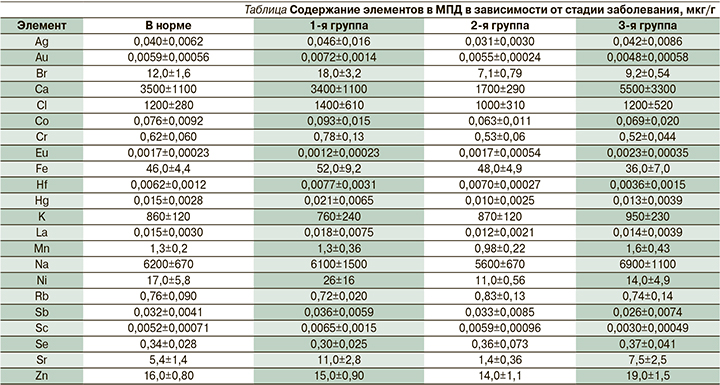
В результате проведенного ИНАА был изучен микроэлементный состав тканей при грыжах МПД поясничного отдела позвоночника и получены соответствующие количественные показатели содержания микроэлементов в исследуемых биосубстратах, полученных от пациентов 1–3-й групп (см. таблицу).
Обсуждение
Анализ содержания элементов позволил характеризовать изменение элементного состава тканей диска по мере развития дегенеративного процесса заболевания от одной группы к другой.
Сравнение изменений в содержании определенных элементов (Au, Br, Cr, Hg, Hf, Ni, Sc, Fe и Co) в 1–3-й группах показало, что снижение их содержания в тканях диска происходит по мере развития дегенеративно-деструктивного процесса и при этом увеличивается содержание калия, селена и цинка. Сравнивая уровни последних, можно сказать, что, теряя одни элементы (Fe, Cr, Br), организм повышает содержание других элементов (К, Zn).
Уменьшение содержания большинства элементов возможно в связи с тем, что основным переносчиком кислорода в клетки является железо, содержание которого по мере нарастания стадии заболевания уменьшается. Вместе с кислородом в клетки МПД доставляются вода и другие элементы.
Содержание Na меняется по мере развития заболевания: этот элемент, как известно, – важнейший внеклеточный катион, участвующий в регуляции распределения воды в организме. От натрия зависит транспорт аминокислот, сахаров, различных неорганических и органических ионов через мембраны клеток, он играет роль в процессах возбуждения и сокращения [1]. Во 2-й группе уровень натрия резко снижается, в 3-й он резко повышается, что, возможно, происходит в результате нарушения гомеостаза тканей из-за распределения водного баланса. За счет этого содержание эссенциального элемента хлора (Cl) незначительно уменьшается, точнее, происходят колебательные изменения количественного состава по группам. Это, видимо, происходит из-за включения компенсаторного механизма регуляции кислотно-щелочного равновесия в тканях.
Следует обратить внимание на ряд элементов, содержание которых в начале развития дегенеративного процесса снижается (2-я группа), а затем повышается. К таким элементам относятся Mn, Br, Ca, Sr, Ni. Их содержание во 2-й группе понижается от 25 до 60% для некоторых элементов. Что касается кальция, то во 2-й группе уровень кальция резко снижается, практически в 2 раза, а потом повышается почти в 3 раза. Это можно объяснить тем, что в начальный период заболевания происходит вымывание кальция из костной составляющей МПД, но по мере развития болезни и перехода в более тяжелую стадию происходит кальцинирование мягких тканей диска.
Обращает на себя внимание содержание марганца и цинка, которые являются синергистами, участвуют в конформации молекул РНК. По мере развития заболевания содержание этих элементов снижается, но в дальнейшем их уровни повышаются и приближаются к значениям таковых 1-й группы, что, возможно, объясняется адаптационными процессами, происходящими в организме человека.
Отметим поведение стронция (Sr) в процессе заболевания. До настоящего времени точно не установлена его роль как жизненно необходимого, но доказано, что стронций играет важную роль в образовании эмали зубов, ее прочности, в процессах костеобразования. Этот микроэлемент оказывает цитопротективное действие при костеообразовании. Он является остеотропным микроэлементом, участвующим в физиологических и морфологических процессах в кости, а также обладает хондропротекторным действием, играющим важнейшую роль в патоморфологических преобразованиях МПД при остеохондрозе [10]. В 1-й группе больных содержание стронция высокое (11,0±2,8 мкг/г), в процессе развития дегенеративного процесса во 2-й группе содержание его резко уменьшается (1,4±0,36 мкг/г), что объясняется естественной реакцией стронция на происходящие в тканях изменения. По мере развития заболевания в 3-й группе больных уровень стронция повышается, но все равно его содержание меньше, хотя и приближается к первоначальным значениям, что также возможно вследствие включения адаптационных процессов.
Заключение
Методом ИНАА определено содержание 22 макро- и микроэлементов в тканях МПД при дегенеративно-дистрофических процессах. Установлено, что в процессе развития дегенерации в тканях МПД происходит изменение содержания ряда эссенциальных элементов. Так, изменения в содержании натрия, калия, хлора приводят к нарушению регуляции кислотно-щелочного равновесия в тканях. Уменьшение содержания железа способствует снижению поступления кислорода в ткань МПД. Снижение уровня кальция в начале дегенеративного процесса, а затем резкое его повышение свидетельствуют о кальцинировании мягких тканей диска.
Таким образом, изменения микроэлементного состава свидетельствуют о нарушении метаболических процессов, происходящих в МПД, и требуют дальнейшего изучения данной проблемы.


