Введение
Лекарственные повреждения печени (ЛПП) составляют около 10% от всех нежелательных побочных эффектов, ассоциированных с применением лекарственных средств (ЛС) [1–2] и служат причиной 40–50% случаев острого повреждения печени [3]. Поскольку печень – одно из основных звеньев биотрансформации ЛС в организме человека, скорее всего ЛПП даже более распространены, чем о том свидетельствует официальная медицинская статистика. Это обусловлено рядом причин, среди которых латентное течение ЛПП, неадекватная трактовка клинической симптоматики и/или клинико-лабораторных показателей, недостаточно внимательный сбор анамнеза, а также недостаточная информированность и настороженность врачей разных специальностей в отношении развития лекарственно-индуцированных заболеваний разных органов и систем, в т.ч. печени. Не вызывает сомнений и факт, согласно которому ЛПП необходимо диагностировать как можно в более ранние сроки, т.к. продолжающийся прием лекарственного (ых) препарата (ов) – индуктора (-ов) способен многократно усиливать тяжесть клинических проявлений и существенно влиять на исход заболевания в целом – вплоть до развития летальных исходов и необходимости трансплантации печени, а также развития хронических заболеваний печени [4–5].
Согласно классификации (клинико-лабораторные варианты ЛПП), различают следующие типы ЛПП [6–7]:
1. Гепатоцеллюлярный вариант – характеризуется повышением активности аланинаминотрансферазы (АЛТ) более чем в 2 раза по сравнению с верхней границей нормы (ВГН) или соотношением АЛТ/щелочная фосфатаза (ЩФ) ≥5.
2. Холестатический вариант – типично повышение активности ЩФ>2 ВГН или соотношение АЛТ/ЩФ≤2 при хроническом течении.
3. Смешанный вариант – cвойственно повышение активности АЛТ>2ВГН и соотношение 2<АЛТ/ЩФ и <5 при хроническом течении.
В российских рекомендациях по ЛПП (2019) выделено несколько фенотипов ЛПП, среди них холестатический (острый внутрипеченочный холестаз без/с воспалительной инфильтрацией, хронический внутрипеченочный холестаз без/с воспалительной инфильт-рацией, с развитием билиарного склероза, с исчезновением желчных протоков) и смешанный гепатоцеллюлярный и холестатический варианты [8–10].
Холестатический вариант составляет от 20 до 40% всех ЛПП, смешанный – от 12 до 20%, гепатоцеллюлярный – от 40 до 78% [4, 11, 12]. Одно и то же ЛС может стать причиной развития разных типов ЛПП [13, 14]. Несмотря на то что лекарственно-индуцированное поражение печени с холестазом (ЛИППХ) ассоциируется с меньшей частотой летальных исходов, этот вариант ЛПП чаще имеет затяжное течение и у этих пациентов отмечается более высокий риск развития хронических поражений печени [4].
Выделяют несколько подходов к оценке степени вероятности связи между приемом ЛС [13, 14] и развитием ЛПП, в частности ЛИППХ. Наибольшую распространенность получил следующий алгоритм [13]:
A – хорошо установленная (доказанная и документированная) причина повреждения печени с клиническими проявлениями;
В – весьма вероятная причина повреждения печени с клиническими проявлениями;
С – вероятная причина повреждения печени с клиническими проявлениями;
D – возможная причина повреждения печени с клиническими проявлениями;
E – маловероятная причина повреждения печени с клиническими проявлениями;
E* – недоказанная, но подозреваемая причина повреждения печени с клиническими проявлениями.
Также для оценки степени доказанности между приемом ЛС и развитием любых лекарственно-индуцированных заболеваний, в т.ч. ЛИППХ, может применяться классификация, предложенная J.E. Tisdale и D.A. Miller в своей монографии [14]:
А – это уровень, который указывает на наличие причинно-следственной связи, основываясь на результатах одного или нескольких рандомизированных контролируемых клинических исследований;
B – это уровень, который указывает на наличие причинно-следственной связи, основываясь на результатах проспективных и ретроспективных наблюдательных исследований, когортных исследований, исследований типа случай–контроль, мета-анализов и/или постмаркетинговых наблюдательных исследований;
С – это уровень, который указывает на то, что в литературе имеются одна или несколько публикаций с описанием клинического случая или серии случаев, когда использование данного ЛС вызывало специфическую реакцию в виде определенного лекарственно-индуцированного симптома, синдрома или заболевания.
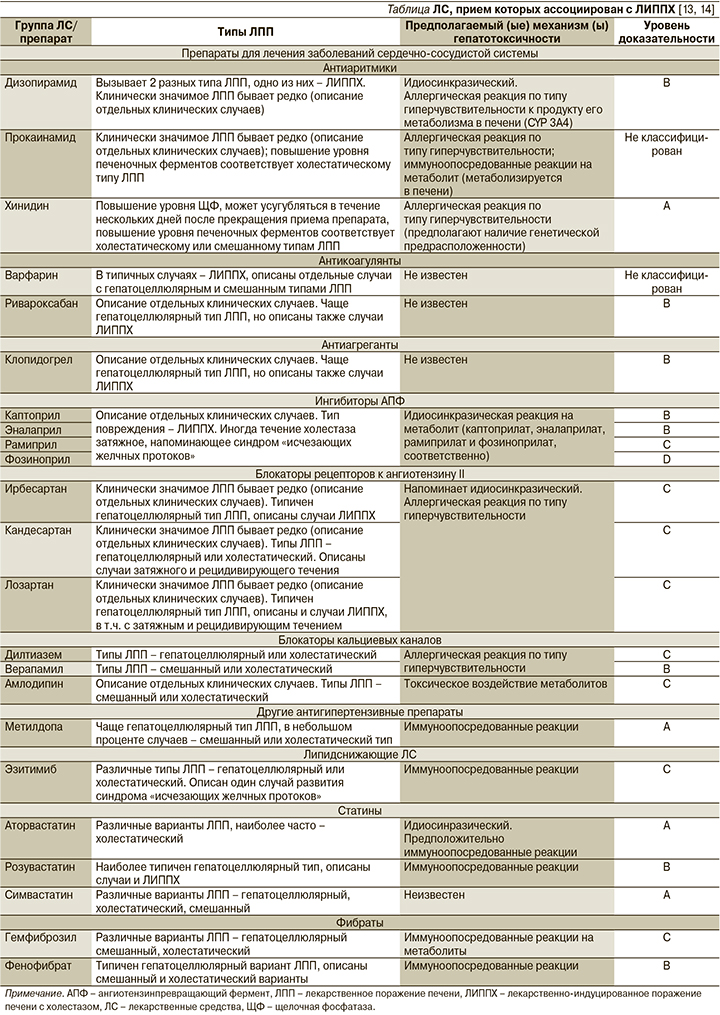
С развитием холестатического варианта ЛПП ассоциирован прием очень многих классов ЛС. Это ЛС, применяемые в лечении заболеваний центральной нервной системы, онкологических заболеваний; антибиотики, нестероидные противовоспалительные средства, гормоны, среди них также отдельные классы ЛС и отдельные препараты, часто назначаемые в кардиологической практике [13, 14]. Возможные механизмы развития ЛИППХ на фоне их приема, а также степень вероятности взаимосвязи ЛС–ЛПП суммированы в таблице.
Антиаритмики
Среди препаратов данного класса с развитием ЛИППХ ассоциируется терапия хинидином (степень вероятности взаимосвязи А), дизопирамидом (степень вероятности взаимосвязи В), прокаинамидом.
Лечение хинидином (подкласс IA антиаритмических средств, алкалоид коры хинного дерева, правовращающий изомер хинина) в некоторых редких случаях сопровождается повышением уровня печеночных ферментов, которое обычно выражено незначительно, не сопровождается клинической симптоматикой, носит транзиторный характер и не требует снижения дозы препарата. В редких случаях (у 2% пациентов) его прием ассоциирован с развитием лихорадки, незначительно выраженной желтухи [13, 14]. Описаны случаи развития серьезных побочных эффектов, сопровождающихся слабостью, тошнотой, рвотой, миалгиями, артралгиями и высокой лихорадкой, обычно они появляются в течение 1–2 недель после начала лечения хинидином, в случаях его повторного применения возникают раньше – в течение первых суток. Выраженность желтухи может нарастать в течение нескольких дней, даже несмотря на прекращение приема хинидина. Сыпь встречается редко, а эозинофилия нетипична, несмотря на наличие других признаков гиперчувствительности (лихорадка, артралгии). В биохимическом анализе крови на ранней стадии выявляют повышение уровня трансаминаз и ЩФ, характер повышения уровня сывороточных ферментов обычно холестатический или смешанный. При биопсии печени обычно выявляются легкие повреждения и небольшие эпителиоидные гранулемы, которые часто обнаруживаются и во многих других органах, если имеют место системные реакции гиперчувствительности. Симптомы ЛИППХ, ассоциированные с приемом хинидина, обычно самостоятельно купируются в течение 1–4 недель после прекращения приема препарата, однако нередко желтуха и изменения лабораторных показателей нарастают в течение нескольких дней после прекращения лечения, летальных случаев не описано [13, 14].
Терапия дизопирамидом (подкласс IA антиаритмических средств), по данным клинических исследований, может в редких случаях приводить к повышению уровня трансаминаз и ЩФ. Однако описано несколько случаев развития ЛПП с клиническими проявлениями, при этом дизопирамид ассоциирован с двумя разными типами ЛПП – гепатоцеллюлярным и холестатическим. ЛИППХ, связанное с приемом дизопирамида, развивается в типичных случаях через 1–3 недели после начала терапии и проявляется желтухой, кожным зудом, при этом значительно повышается уровень ЩФ с одновременным небольшим увеличением уровня трансаминаз [15]. Иммуноаллергические и аутоиммунные признаки встречаются редко. На фоне приема дизопирамида не описано случаев острой печеночной недостаточности, хронического гепатита или синдрома «исчезающих желчных протоков». После холестатического повреждения печени, вызванного дизопирамидом, типичен рецидив симптомов после повторного применения препарата, поэтому такому пациенту необходимо назначение другого антиаритмического ЛС.
Прокаинамид, еще один представитель подкласса IA антиаритмических средств, в клинических исследованиях демонстрировал низкую частоту повышения уровня печеночных трансаминаз и ЩФ. Однако прием этого препарата может быть ассоциирован с развитием ЛПП с клинической симптоматикой, что описано в литературе. В опубликованных сериях случаев обычно в течение 1–3 недель после начала лечения прокаинамидом (или в течение первых суток после повторного применения препарата) возникали лихорадка и иногда желтуха, обычно слабовыраженная, что сопровождалось холестатическим вариантом изменения активности печеночных ферментов. Обычно также имели место иммуноаллергические симптомы (лихорадка, сыпь, лейкоцитоз), при этом после отмены препарата лихорадка разрешалась немедленно, другие симптомы поражения печени – в течение нескольких дней или даже недель. Поскольку повторное применение прокаинамида неизменно приводит к рецидиву лихорадки и повышению уровня печеночных ферментов, необходимо назначать пациенту другой антиаритмический препарат. При биопсии печени могут выявляться гранулемы и слабовыраженные неспе-цифические изменения. На фоне приема пропафенона симптомы холестаза (желтуха, кожный зуд) обычно развиваются несколько позже – через 2–8 недель после старта терапии, паттерн изменения печеночных ферментов может быть холестатическим [16] или смешанным. Иммуноаллергические и аутоиммунные проявления встречаются редко. Хотя желтуха может быть продолжительной, пациенты обычно выздоравливают через 1–3 месяца.
Антитромботические средства
Варфарин. В типичных случаях острое ЛПП возникает в течение 3–8 недель после начала приема варфарина, хотя сообщалось и о редких случаях ЛПП, возникающих после нескольких месяцев или даже лет терапии [13]. Тип ЛПП холестатический, но также сообщалось о гепатоцеллюлярных и смешанных вариантах [13]. Иногда в общем анализе крови выявляют эозинофилию, другие иммуноаллергические проявления не характерны. В большинстве случаев варфарин-индуцированное повреждение печени имеет легкую или среднюю степень тяжести и после отмены препараты уровень печеночных ферментов постепенно возвращается к норме. В типичных случаях ЛИППХ, вызванных приемом варфарина, восстановительный период весьма продолжителен по времени [13], поэтому у больных варфарин-индуцированным ЛПП повторного назначения препарата следует избегать.
Ривароксабан. Среди нового класса прямых оральных антикоагулянтов (ПОАК) с развитием острого ЛПП c клиническими проявлениями (желтуха) ассоциирован прием ривароксабана (степень вероятности взаимосвязи В) [13]. В большинстве случаев ЛПП развивалось в течение 1–8 недель после начала приема ривароксабана и проявлялось желтухой, повышенной утомляемостью и гепатоцеллюлярным типом повышения уровня сывороточных ферментов. Однако описаны и случаи развития ЛИППХ [17–19]. Так, S. Russmann et al. [17] представили анализ 14 случаев повреждения печени на фоне приема ривароксабана (5 мужчин и 9 женщин в возрасте от 41 до 91 года), из них в половине случаев имел место гепатоцеллюлярный тип ЛПП, в двух – ЛППХ. A. Lambert et al. [18] представили 5 случаев ЛПП, ассоциированных с приемом ривароксабана, из них один – ЛППХ. Обычно ЛПП, вызванные ривароксабаном, имеет легкую или умеренную степень тяжести, после отмены препарата симптомы регрессируют, как правило, довольно быстро – в течение 2–4 недель [13]. Также в настоящее время не описано случаев рецидива ЛПП после повторного применения ривароксабана. Тем не менее в таких случаях, по-видимому, более правильной тактикой следует считать назначение другого ПОАК [13]. Другие ПОАК, по имеющимся на сегодняшний день данным, имеют более низкий риск развития нежелательных лекарственных реакций НЛР со стороны печени.
Клопидогрел. Опубликовано более десятка сообщений о клинически выраженных ЛПП, ассоциированных с приемом клопидогрела (степень вероятности взаимосвязи В) [13]. Дебют симптомов (желтуха, повышенная утомляемость, иногда лихорадка) обычно приходится на период от 2 до 24 недель (в среднем 6 недель) от начала терапии клопидогрелом [13].
В типичных случаях имеет место гепатоцеллюлярный тип ЛПП, но описаны случаи со смешанным или холестатическим типом ЛПП [20]. Хотя в большинстве случаев после отмены препарата симптомы ЛПП исчезали в течение 1–3 месяцев, имеются сообщения о фатальных исходах, а также описание случаев, когда возникала необходимость трансплантации печени [13]. Повторный прием клопидогрела обычно приводит к рецидиву ЛПП [13], и его следует избегать.
Антигипертензивные препараты
Среди ингибиторов ангиотензинпревращающего фермента (иАПФ) случаи развития ЛИППХ описаны при приеме каптоприла [21–24], эналаприла [25–27], рамиприла [28–29] и фозиноприла [30–31] (степень вероятности взаимосвязи – В, В, С и D соответственно) [13]. В клинических исследованиях прием иАПФ, в т.ч. и перечисленных выше, ассоциировался с низкой частотой повышения уровня печеночных трансаминаз (<2%), статистически значимо не отличавшейся от таковой в группе плацебо. Выявленные повышения уровня печеночных ферментов были преходящими и очень редко диктовали необходимость требовать снижения дозы. Несмотря на то что иАПФ редко ассоциируются с ЛПП, описано несколько десятков случаев клинически очевидного повреждения печени при терапии каптоприлом и эналаприлом, отдельные случаи – при лечении рамиприлом и фозиноприлом. Дебют симптомов обычно происходит в течение 2–12 недель после начала терапии, а паттерн изменения уровня печеночных ферментов в сыворотке обычно холестатический. В некоторых случаях на фоне приема всех 4 перечисленных иАПФ холестаз был длительным и рецидивирующим, сопровождался стойким повышением уровня ЩФ сыворотки крови, что позволяет заподозрить развитие синдрома «исчезающих желчных протоков». На фоне приема эналаприла описаны случаи с тяжелым течением и летальным исходом [32–34]. Иммуноаллергические проявления (сыпь, лихорадка, эозинофилия) встречаются нечасто. Хотя, как уже было сказано выше, для иАПФ характерно ЛИППХ, были также описаны и случаи с гепатоцеллюлярным типом ЛПП на фоне всех чеырех данных представителей класса иАПФ. У тех пациентов, у которых на фоне приема иАПФ возникало повреждение печени с клиническими проявлениями, обычно (хотя и не всегда) развивается рецидив симптомов при замене на другой иАПФ. Таким образом, если без иАПФ никак не обойтись в какой-то конкретной клинической ситуации, то после начала приема нового ЛС этого класса необходим тщательный мониторинг клинических симптомов и лабораторных параметров.
Описаны случаи развития ЛИППХ на фоне приема отдельных представителей класса блокаторов рецепторов к ангиотензину II (БРА): кандесартана [35], ирбесартана [36–38] и лозартана [13] (степень вероятности взаимосвязи для всех ЛС – С) [13]. БРА редко вызывают ЛПП с клиническими проявлениями, при этом характерен гепатоцеллюлярный вариант ЛПП [13]. Однако на фоне лечения перечисленными выше представителями данного класса ЛС в некоторых случаях развивался холестаз, который мог быть длительным и рецидивирующим, при этом терапия БРА не была ассоциирована с развитием синдрома «исчезающих желчных протоков» или хронического повреждения печени. Во всех описанных в литературе случаях острого повреждения печени на фоне БРА клинические и лабораторные симптомы были транзиторными и не требовали отмены препарата или снижения дозы. В отличие от иАПФ отсутствуют данные, согласно которым у пациентов с возникшим ЛПП на фоне приема одного БРА симптомы будут рецидивировать после применения другого препарата данной группы [13].
Среди блокаторов кальциевых каналов (БКК) ЛИППХ ассоциируется с приемом верапамила (степень вероятности взаимосвязи – В), дилтиазема и амлодипина (степень вероятности взаимосвязи для обоих ЛС – С) [13]. Тип ЛПП обычно бывает холестатическим или смешанным на фоне лечения верапамилом и амлодипином, холестатическим или гепатоцеллюлярным на фоне дилтиазема. На фоне терапии недигидропиридиновыми БКК верапамилом и дилтиаземом в очень редких случаях бывает ЛПП с клинической симптоматикой, проявляющейся усталостью, слабостью и иногда желтухой через 2–8 недель после начала приема препарата, степень тяжести от легкой до умеренной. Крайне редко возникают иммуноаллергические симптомы (лихорадка, сыпь, артралгии и эозинофилия), описано более 10 подобных случаев. После прекращения приема верапамила симптомы быстро исчезают (через 2–6 недель), а при повторе применении препарата рецидивируют, причем в более короткие сроки. Случаев развития хронического гепатита или синдрома «исчезающих желчных протоков» не описано. В литературе также представлены единичные случаи развития ЛПП с клиническими проявлениями на фоне терапии дигидропиридиновым БКК амлодипином, развившимися в большинстве случаев через 4–12 недель после старта терапии; иммуноаллергические симптомы отсутствовали. После прекращения лечения амлодипином симптомы регрессировали в течение 4–8 недель, но вновь появлялись после повторного применения препарата.
Степень вероятности взаимосвязи А между приемом ЛС и развитием ЛПП среди антигипертензивных препаратов имеется лишь у препарата метилдоп, который в настоящее время применяется лишь для лечения артериальной гипертензии у беременных [39]. Препарат используется с 1960-х гг., и за все время его применения накопилось около 700 случаев развития ЛПП с клиническими проявлениями. Описано два наиболее типичных типа ЛПП, ассоциированных с приемом метилдопа, один из них – острый гепатит, который развивается в течение нескольких недель или месяцев после начала приема, второй – это хронический гепатит (развивается через несколько месяцев или даже лет). При первом варианте ЛПП описано несколько отдельных случаев, протекавших с выраженным холестазом и длительной желтухой [13].
Липидснижающие ЛС
Статины. Большинство случаев ЛПП на фоне приема статинов классифицируются как гепатоцеллюлярный вариант, но холестатический гепатит также описан (аторва-, симва- и розувастатин) [40–41]. Больше всего сообщений о ЛПП поступило для аторвастатина и симвастатина (степень вероятности взаимосвязи – А). Наличие системных проявлений аутоиммунного генеза отмечено при приеме аторвастатина, симвастатина, розувастатина, а также при комбинации этих препаратов с эзетимибом (селективный ингибитор абсорбции холестерина в кишечнике).
Хотя прием аторвастатина и ассоциируется с ЛПП с клиническими проявлениями, но это редкий побочный эффект, который встречается у пациентов, получающих лечение аторвастатином, в соотношении ~1:3000–1:5000 [13]. Клинические проявления ЛПП сильно варьируются: описаны холестатические варианты, смешанный и гепатоцеллюлярный, наиболее распространенным является холестатический гепатит легкой или умеренной степени тяжести, симптомы которого разрешаются самостоятельно [13]. Время появления клинических симптомов также сильно разнится – от 1 месяца до нескольких лет. Однако большинство случаев заболевания манифестирует в течение 6 месяцев после начала приема аторвастатина или через несколько месяцев (после повышения дозы) [40, 42]. Cимптомы аторвастатин-индуцированного ЛПП обычно самостоятельно проходят в течение 1–4 месяцев, однако в некоторых случаях период восстановления может быть гораздо более продолжительным. Так, M. Merli et al. [43] описали случай острого ЛИППХ, ассоциированного с приемом аторвастатина. На момент дебюта ЛПП пациент 72 лет принимал данное ЛС в течение 40 дней по поводу смешанной дислипидемии. Пациент предъявлял жалобы на астению, тошноту, желтушность кожных покровов, обесцвечевание кала, темный цвет мочи.
В биохимических анализах наблюдалось резкое увеличение билирубина (общий билирубин – 22 мг/дл; прямой билирубин – 21 мг/дл) и ЩФ (до 4-кратного превышения верхней границы нормы) с менее выраженным повышением уровня трансаминаз. При гистологическом исследовании печени выявлена картина холестаза с явными признаками холангиолита и поражением междольковых желчных протоков. Уровень сывороточных трансаминаз и билирубина возвратился к норме в течение 5 месяцев после отмены аторвастатина, в то время как ЩФ нормализовалась только через 8 месяцев.
Прием розувастатина также ассоциирован с клинически выраженным ЛПП (степень вероятности взаимо-связи – В), но это бывает редко – менее чем у 1 на 10 тыс. пролеченных пациентов. Заболевание обычно дебютирует через 2–4 месяца, и хотя сообщалось о случаях ЛИППХ, наиболее характерным вариантом ЛПП на фоне приема розувастатина является гепатоцеллюлярный [13]. При клинически очевидном повреждении печени, связанном с применением розувастатина, симптомы обычно исчезают в течение 1–2 месяцев. Случаи ЛПП с клиническими проявлениями на фоне приема симвастатина также редки, латентный период от начала терапии до появления симптомов заболевания печени колеблется в очень широких пределах – от 1 недели до 3 лет, но в большинстве случаев его продолжительность составляет от 1 до 6 месяцев. Характер повреждения вариабелен, описаны все варианты ЛПП, включая ЛИППХ.
В большинстве случаев выздоровление наступает в течение 1–3 месяцев. На фоне приема как розувастатина, так и симвастатина иммуноаллергические симптомы (сыпь, лихорадка, эозинофилия) встречаются редко, а случаев развития синдрома «исчезающих желчных протоков» не описано.
Поскольку имеются сообщения о рецидиве ЛПП при повторном применении того же статина, в частности аторвастатина, более оправданна тактика перевода пациента на терапию другим статином: согласно нескольким сообщениям, в этих случаях рецидива ЛПП зафиксировано не было. В любом случае при возобновлении статинотерапии после развития ЛПП на фоне их приема необходимо очень тщательное мониторирование уровня печеночных ферментов.
Эзетемиб. Щироко используется в лечении дислипидемий, в подавляющем большинстве случаев его назначают в дополнение к статинам, в случае если не достигнуты целевые уровни холестерина липопротеидов низкой плотности или на фоне лечения статинами имеются побочные эффекты [44]. В связи с этим, хотя и описаны случаи развития ЛПП, в т.ч. ЛИППХ на фоне лечения эзитимибом (степень вероятности взаимосвязи – С) [45–46], очень трудно определить причинно-следственную связь, т.к. все пациенты получали статины, гепатотоксичность которых хорошо известна. Клинические симптомы ЛПП в тех случаях, где эзетимиб рассматривался как один из возможных препаратов-индукторов, возникали во временнόм промежутке от 2 до 10 месяцев после начала терапии. Описан один случай развития синдрома «исчезающего желчных протоков» на фоне лечения эзетимибом пациента, который продолжал принимать препарат в течение нескольких месяцев, несмотря на наличие желтухи.
Фибраты. В настоящее время используются в основном пациентами с гипертриглицеридемией и/или в комбинации со статинами для лечения гиперхолестеринемии [44]. С развитием ЛПП с клиническими проявлениями чаще всего ассоциирован прием фенофибрата (степень вероятности взаимосвязи – В), также подобные данные имеются и в отношении гемфиброзила (степень вероятности взаимосвязи – С) [13, 47–48]. В случае ЛПП на фоне приема фенофибрата типичен гепатоцеллюлярный вариант, но холестатический и смешанный варианты также описаны. Время дебюта клинических симптомов весьма вариабельно, сами симптомы также различаются. В случае острого развития клинической симтоматики характерны короткий латентный период (от 2 до 8 недель) и появление иммуаллергических симптомов (сыпь, лихорадка, эозинофилия), а в случаях с более длительным бессимптомным периодом обычно имеют место неспе-цифические симптомы (слабость и повышенная утомляемость). Повторное применение фенофибрата обычно приводит к рецидиву клинико-лабораторных симптомов повреждения печени, поэтому его следует избегать. На фоне приема фенофибрата описаны случаи синдрома «исчезающих желчных протоков» [49–51].
Заключение
Таким образом, холестатический вариант ЛПП является достаточно частым осложнением фармакотерапии, в т.ч. препаратами для лечения сердечно-сосудистых заболеваний, таких как антиаритмики, антигипертензивные средства, липидснижающие ЛС, антикоагулянты, антиагреганты и др. Настороженность специалистов практического здравоохранения в отношении потенциального гепатотоксического действия ЛП и его своевременная диагностика способствуют повышению безопасности, улучшают прогноз пациентов, получающих лечение сердечно-сосудистых заболеваний.
Вклад авторов. О.Д. Остроумова, А.П. Переверзев, Е.Е. Павлеева, А.Г. Комарова – написание текста. О.Д. Остроумова – редактирование текста.
Финансирование. Работа выполнена без спонсорской поддержки.


