Введение
Акромегалия представляет собой тяжелое полиорганное заболевание, жизненный прогноз которого зависит от своевременной диагностики и адекватности лечебного пособия. Выраженность клинических проявлений данной патологии зависит от возраста диагноза, уровня секреторной активности опухоли, особенностей ее патоморфологического строения, величины масс-эффекта и длительности активной стадии. Чем дольше экспозиция избыточной продукции гормона роста (ГР) и инсулиноподобного ростового фактора-1 (ИРФ-1), тем выше коморбидность заболевания, проявляющаяся развитием сердечно-сосудистой патологии, артериальной гипертензии, респираторной недостаточности, артропатии, сахарного диабета (СД), доброкачественных и злокачественных неопластических процессов, негативно влияющих на качество и продолжительность жизни пациентов [1, 2]. Согласно классификации Всемирной организации здравоохранения от 2017 г., ГР-секретирующие аденомы включают несколько гистологических подтипов, различающихся морфологическим строением, клиническими проявлениями и биологическим поведением [3]. Среди «чистых» соматотропином выделяют густогранулированные аденомы, редкогранулированные аденомы и промежуточный тип аденом. Смешанные аденомы подразделяются на соматопролактиномы, маммосоматотропиномы. К более редко встречающимся ГР-секретирующим аденомам относятся аденомы из ацидофильных стволовых клеток, плюригормональные аденомы и «молчащие» соматотропные аденомы. Густо- и редкогранулированные опухоли встречаются в 40 и 30% случаев соответственно. При этом редкогранулированные аденомы отличаются большим размером, меньшей экспрессией 2а-подтипа соматостатиновых рецепторов (ССР, 50 против 100%) и более высоким пролиферативным индексом Ki-67. По данным J. Brzanaс et al., в редкогранулированных опухолях пролиферативный индекс >3% наблюдался в 67% случаев, тогда как в густогранулированных аденомах в 89% случаев Ki-67 составил <3%. В результате повышенной пролиферативной активности редкогранулированные аденомы, как правило, требуют более агрессивного лечебного подхода с участием полидисциплинарной команды нейрохирургов, радиологов, эндокринологов. При этом медикаментозная терапия обычно носит комбинированный характер и отличается большей резистентностью по сравнению с густогранулированными аденомами [4].
Промежуточный тип гранулированных соматотропином по своему клиническому поведению сходен с густогранулированными аденомами. Низкодифференцированные опухоли (ацидофильные аденомы из стволовых клеток, плюригормональные аденомы, а также «молчащие» соматотропные аденомы) заведомо отличаются агрессивным поведением и инвазивным ростом. Все это подчеркивает исключительную важность проведения иммуногистохимического исследования оперативно удаленного материала для уточнения клинического прогноза и определения тактики вторичного лечебного пособия [5].
Существующее многообразие рецепторных фенотипов ГР-секретирующих аденом определяет сложность подбора персонализированной медикаментозной терапии для достижения биохимической ремиссии. Определенные трудности для клиницистов привносит запоздалый характер диагностики заболевания и наличие у вновь выявленных больных множественных необратимых органных и метаболических осложнений, выраженность которых требует учета и дополнительной лечебной коррекции. Все это объясняет современную тенденцию развития мультидисциплинарного и мультимодального подходов к лечению акромегалии с привлечением разнонаправленных лекарственных препаратов и комбинированных схем фармакотерапии, повышающих эффективность и безопасность длительной курации [6, 7].
Согласно международному консенсусному соглашению, регламент лечебного пособия при акромегалии включает три основные лечебные модальности (оперативное лечение, медикаментозную терапию и лучевое лечение) в различном сочетании. Методом выбора является транссфеноидальная аденомэктомия, эффективность которой зависит от размеров опухоли, степени ее инвазивности и опыта нейрохирурга. При микроаденомах радикальная аденомэктомия достигается в 80% случаев, в то время как при макроаденомах хирургическая курация наблюдается примерно в 50% случаев, что требует облигатного подключения вторичной фармакотерапии. Первичная медикаментозная терапия назначается гораздо реже – как правило, в случаях выявления противопоказаний для оперативного вмешательства из-за периоперационного риска и необходимости предоперационной подготовки для улучшения соматического статуса. Лучевая терапия как третья линия лечения назначается при агрессивных опухолях, резистентных к хирургическому и лекарственному пособиям [8].
Следует отметить, что линейка лекарственных препаратов, используемых при акромегалии, постоянно расширяется и в настоящее время включает аналоги соматостатина 1-й генерации – АС1 (продленные формы октреотида и ланреотида), аналоги соматостатина 2-й генерации (продленные формы пасиреотида), неселективные и селективные агонисты дофаминергических рецепторов (бромокриптин, каберголин), блокаторы рецепторов ГР (пэгвисомант).
В настоящее время АС1 являются первой линией первичной или вторичной медикаментозной терапии. Эти препараты преимущественно воздействуют на 2а-подтип ССР и обеспечивают нормализацию уровней ГР и ИРФ-1 в неселективной группе примерно в 30–50% случаев. Антитуморозный эффект препаратов с уменьшением опухолевого объема более 20–25% от исходного наблюдается у 63–66% больных. Как свидетельствуют литературные данные, биохимическая чувствительность к АС может служить предиктором рецепторного фенотипа аденоматозных клеток. Наибольшая чувствительность к АС1 наблюдается при густогранулированных эозинофильных аденомах, экспрессирующих 2а-подтип ССР. Напротив, редкогранулированные аденомы, образующиеся из хромофобных клеток, отличаются низкой экспрессией 2а-подтипа ССР, следовательно, низкой чувствительностью к АС1. Этот вид опухолей характеризуется ранним возрастом диагноза, быстрым и инвазивным ростом с развитием интраселлярной и интракраниальной компрессии. В отличие от густогранулированных эти опухоли экспрессируют преимущественно 5-й подтип ССР и потому проявляют чувствительность к супрессивному действию продленной формы пасиреотида (пасиреотид ЛАР) [9, 10].
Таким образом, величина соотношения между 2а- и 5-м подтипами ССР определяет степень чувствительности опухолевых клеток к октреотид- и ланреотидсодержащим препаратам, а также отдаленный прогноз использования АС1. Данные относительно индивидуальной особенности рецепторной экспрессии можно получить либо опытным путем, анализируя чувствительность к АС1 или АС2 в условиях клинической практики, либо с помощью иммуногистохимического исследования оперативно удаленного опухолевого материала. Дополнительным подспорьем служат данные об интенсивности опухолевого сигнала на Т2-взвешенных МР-изображениях. Выявление гипо- или гиперинтенсивного сигнала указывает на наличие густо- или редкогранулированной опухоли, соответственно, на наличие или отсутствие чувствительности к АС1. Аденомы с гипоинтенсивным сигналом, выявляемые более чем у 50% соматотропином, отличаются малым размером, неинвазивным ростом и более выраженной гормональной активностью. Через 12 месяцев лечения АС1 нормализация уровня ИРФ-1 у больных с гипо- и гиперинтенсивными опухолями наблюдалась в 71 против 20% случаев соответственно. Уменьшение объема опухолевой ткани также в большей степени регистрировалось в гипоинтенсивных опухолях [5, 11].
Однако в существующих реалиях подбор оптимального препарата, как правило, осуществляется методом «проб и ошибок» с большим риском пролонгации активной стадии заболевания и высоким процентом клинических, моральных и финансовых издержек. Стартовыми препаратами фармакотерапии, согласно международным рекомендациям, являются пролонгированные препараты АС1, используемые в качестве предоперационного лечения, вторичной или первичной медикаментозной терапии. Множественные клинические исследования, посвященные эффективности монотерапии АС1, показали, что биохимическая ремиссия достигается в 50%. При этом не было выявлено различий в антисекреторном и антипролиферативном действиях между продленными формами октреотида и ланреотида. Возникающая проблема относительной или полной резистентности к АС1 решается с помощью эскалации дозы, уменьшения межинъекционных интервалов, добавления высоких доз агонистов дофамина или перевода на другие лекарственные субстанции [12].
Монотерапия селективным агонистом дофамином (каберголином), воздействующая на Д2-рецепторы опухолевых клеток, также может относиться к первой линии вторичной медикаментозной терапии при умеренно повышенных концентрациях ГР и ИРФ-1 (ИРФ-1 <2,5 от верхней границы нормы) [13].
В том случае, если на фоне максимальной дозы препаратов биохимический контроль не достигается, последующий алгоритм предполагает индивидуализированное лечение с учетом наличия (или отсутствия) клинически значимой резидуальной опухоли, а также нарушенного углеводного обмена. При этом выделяют несколько опций вторичной линии фармакотерапии: использование продленной формы пасиреотида или пэгвисоманта в сочетании или вместо АС1. Если остаточная опухолевая ткань не подходит для резекции, предлагается перевод пациента на АС 2-й генерации (пасиреотид ЛАР). При наличии симптоматического СД (или при развитии ятрогенной гипергликемии на пасиреотид) рекомендуется назначение пэгвисоманта. Если остаточная ткань опухоли небольших размеров и изначально имеется нарушение углеводного обмена, к АС 1-й генерации показано добавление пэгвисоманта.
В том случае, если при подключении второй линии терапии биохимический контроль не достигается, рекомендуется 3-я линия лечения: стереотаксическая радиохирургия, хирургическая реинтервенция или использование темозоломида [14].
Реальным решением проблемы первичной резистентности к АС1 является использование препарата с иным механизмом действия. Пэгвисомант (Сомаверт) является антагонистом рецепторов ГР и способен дозозависимо блокировать его стимулирующее влияние на периферические ткани, обеспечивая стойкую биохимическую ремиссию заболевания. Препарат представляет собой генно-инженерный аналог эндогенного ГР человека с 9 мутациями. Произведенные аминокислотные замены способствуют разнонаправленному изменению связывания с различными субъединицами рецептора ГР (повышению аффинности с одной субъединицей и блокированию связывания с другой), таким образом препятствуя процессу димеризации рецептора и внутриклеточной трансдукции сигнала. В итоге путем конкурентного ингибирования препарат блокирует биологическое действие ГР в периферических тканях и органах, способствуя стойкому снижению уровня ИРФ-1 и профилактике осложнений, несмотря на сохраняющееся повышенное содержание ГР в крови. Следует отметить, что пэгвисомант обладает высокой селективностью в отношении рецепторов ГР и не взаимодействует с рецепторами других цитокинов, включая пролактин. Подавление действия ГР под влиянием пэгвисоманта приводит к снижению концентраций не только ИРФ-1, но и сывороточных белков, чувствительных к ГР, включая свободный ИРФ-1, кислотно-лабильную субъединицу ИРФ-1 и ИРФ-связывающий белок-3 (ИРФСБ-3) [15, 16].
Использование пэгвисоманта рекомендуется больным акромегалией с агрессивным течением заболевания после нерадикальной аденомэктомии, неэффективной лучевой терапии, при наличии резистентности к АС 1-й и 2-й генераций. Своевременное добавление пэгвисоманта позволяет избегать повторного оперативного вмешательства, радиохирургического лечения или избыточно высоких доз АС.
В условиях реальной клинической практики обсервационные исследования (ACROSTUDY и GPOS – GermanPegvisomantObservationStudy) подтвердили, что препарат обеспечивает нормализацию уровня ИРФ-1 у 60–90% больных и регресс многих клинических симптомов. Наблюдались улучшение показателей углеводного обмена, снижение инсулинорезистентности, повышение кардиальной функции, увеличение толерантности к физической нагрузке, снижение кардиоваскулярного риска [17, 18].
Совместное использование пегвисоманта с АС (или агонистами дофамина) позволяет повышать эффективность и уменьшать суммарную терапевтическую дозу препаратов.
В редких случаях (при невозможности или наличии противопоказаний к операции) препарат может использоваться в качестве первичной терапии. При монотерапии пэгвисомантом нормализация уровня ИРФ-1 наблюдалась в 75% случаев [19].
В 2020 г. в Эндокринологическом диспансере ДЗ Москвы было инициировано отечественное пилотное клиническое исследование, посвященное перспективам использования пэгвисоманта в отношении больных акромегалией со стойкой резистентностью к АС1. Ниже представлены промежуточные итоги комбинированного использования АС1 и пэгвисоманта.
Методы
В клиническую группу были включены 15 больных акромегалией (4 мужчины и 11 женщин) в среднем возрасте 52 (23–74) года. Возраст диагноза составил 42 (±13) года, длительность акромегалии – 9 (±8) лет, объем аденомы гипофиза – 5,8 (±7,7) см3. Всем больным проведено лабораторно-инструментальное обследование. В качестве критерия контроля акромегалии использовался показатель ИРФ-1 – индекс, характеризующий степень превышения уровня ИРФ-1 выше верхней возрастной нормы. Биохимическая ремиссия регистрировалась при величине ИРФ-1 индекса ≤1.
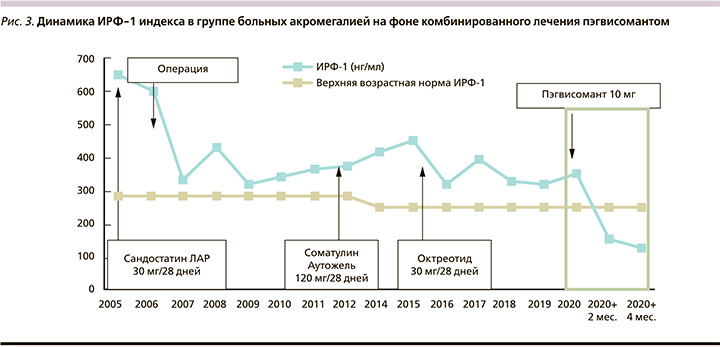
При постановке диагноза уровень ИРФ-1 составлял 653 (±221) нг/мл, величина ИРФ-1 индекса – 2,6 (±1,2), что значительно превышало норму. Хирургическое лечение, включая повторное, было предпринято в отношении 12 (80%) больных. Предварительная лучевая терапия не проводилась. В качестве второй линии лечения все больные получали АС1 в максимальной дозе (октреотид 30 мг в/м 1 раз в 28 дней или ланреотид Аутожель 120 мг п/к 1 раз в 28 дней). Длительность медикаментозного лечения составила 69 (±48) месяцев с максимальным интервалом до 178 месяцев (около 15 лет). Семь больных дополнительно получали каберголин в дозе от 1,5 до 3 мг в неделю.
Статистический анализ проводили с использованием пакета статистических программ «Statistica-8.0 (StatSoft,2001). Меры центральной тенденции и дисперсии количественных признаков представлены в виде среднего арифметического (М) и среднего квадратического отклонений (s). При сравнении двух связанных групп использовался критерий Вилкоксона. Анализ зависимостей проводился с использованием коэффициента ранговой корреляции Спирмена. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты
Как показали итоги, несмотря на длительную многолетнюю фармакотерапию, никому из пациентов не удалось достичь биохимической ремиссии. Содержание ИРФ-1 составило 409 (±174) нг/мл, величина ИРФ-1 индекса – 1,8 (±0,7). У 7 из 15 пациентов к началу комбинированной терапии выявлено нарушение углеводного обмена, у 6 – избыточная масса тела. Таким образом, представленная группа больных исходно отличалась ранним возрастом диагноза, большими размерами опухоли с высокой секреторной активностью и низкой чувствительностью к АС1, что характерно для слабогранулированных соматотропином, отличающихся агрессивным и рецидивирующим течением (см. таблицу).

Следует отметить, что непосредственно доза АС1 служит дополнительным маркером, указывающим на перспективность дальнейшего использования данного лекарственного препарата. Исходя из опыта медикаментозной терапии больных акромегалией, входящих в Московский регистр, была выявлена умеренная обратная корреляция между фармакологической дозой АС1 и длительностью эффективного лечения (R=-0,31; p=0,0000). Данное обстоятельство указывает, что продолжительное (в течение 12 месяцев) сохранение активной стадии заболевания на фоне максимальных доз АС1 и каберголина свидетельствует о бесперспективности продолжения текущей лечебной схемы и является показанием к фармакологической коррекции. При этом прогностическими отрезными точками, по нашим данным, являются процент снижения уровня ИРФ-1 через 3 месяца лечения и содержание ИРФ-1 через 12 месяцев от начала фармакотерапии АС1.
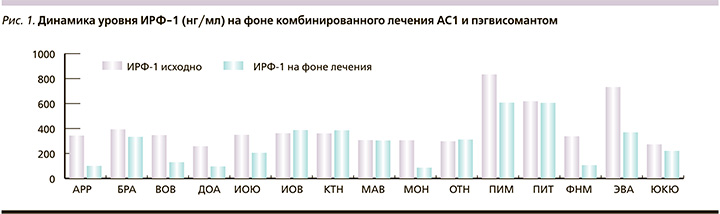
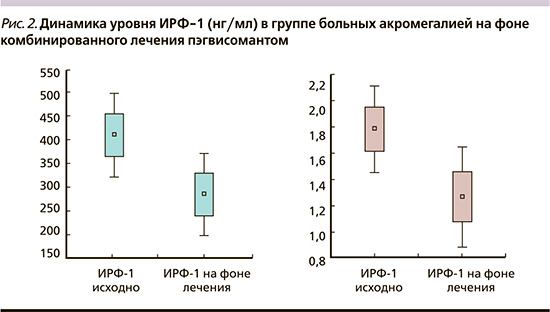
Для достижения биохимической ремиссии всем больным дополнительно к АС1 был назначен блокатор рецепторов ГР – пэгвисомант (Сомаверт). Препарат назначался в стартовой дозе 10 мг/сут, п/к (насыщающая доза – 40 мг). В настоящее время длительность лечения составила у 3 больных 1 месяц, у 6 – 2, у 4 – 3 и у 2 – 4 месяца. Как следует из промежуточных итогов, несмотря на кратковременный период лечения, положительный эффект от лечения пэгвисомантом зафиксирован у 8 (53%) из 15 пациентов: у 5 больных отмечена биохимическая ремиссия (величина ИРФ-1 индекса <1), у 3 выявлено снижение величины ИРФ-1 индекса на 27–49% от исходного уровня (рис. 1). Средний уровень ИРФ-1 в группе снизился с 409 (±174) до 284 (±171) нг/мл (р=0,0064), величина ИРФ-индекса с 1,8 (±0,7) до 1,3 (±0,7) (р=0,0089, рис. 2, 3).
Семи пациентам с отсутствием положительного результата в настоящее время проводится дальнейшая титрация дозы: 4 пациентам с величиной ИРФ-1-индекса на фоне терапии от 1,34 до 1,59 дозы пэгвисоманта увеличена до 15 мг, 3 пациентам с ИРФ-1-индексом от 1,64 до 2,97 – до 20 мг ежедневно. Что касается пациентов, достигших медикаментозного контроля: средний уровень ИРФ-1 индекса составил 0,5 (±0,1), то в настоящее время планируется поступательное снижение дозы АС1 до поддерживающих значений в качестве профилактики продолженного роста резидуальной аденомы.
Стоит отметить, что на данный момент после добавления пэгвисоманта к АС1 у больных не было выявлено существенных побочных эффектов.
У 12 из 15 пациенток уровень печеночных ферментов оставался в пределах референсных значений как до начала терапии, так и на ее фоне. У 1 пациента отмечено незначительное повышение уровня γ-глутамилтрансферазы (ГГТ) через 4 месяца от начала терапии; у 1 пациентки наблюдалось повышение уровня ГГТ как до начала терапии, так и через 3 месяца с поступательным снижением; у 1 пациента исходное повысился уровень аланинаминотрансферазы (АЛТ) с последующей нормализацией. У 13 из 15 пациентов как с нарушением углеводного обмена, так и без него не было существенных изменений уровня глюкозы и гликированного гемоглобина (HbA1c); у 2 пациенток отмечалось незначительное повышение уровня HbA1c.
Ниже представлен клинический случай положительного результата комбинированного использования АС1 и пэгвисоманта.
Больная В.О.В. 1978 г.р. Диагноз акромегалии, макроаденомы гипофиза поставлен в 2005 г. (27 лет). В связи с неэффективностью первичной медикаментозной терапии АС1 в 2006 г. была проведена трансназальная аденомэктомия. При контрольном послеоперационном обследовании подтверждена сохраняющаяся активность заболевания. Назначен прием АС1 (ланреотид Аутожель 120 мг 1 раз в 28 дней). В связи с плохой переносимостью препарата переведена на пролонгированную форму октреотида (30 мг/28 дн.), которую больная принимает и в настоящее время. Также выявлена непереносимость каберголина. Таким образом, несмотря на длительное лечение различными формами АС1 в максимальных дозах, контроля акромегалии не достигнуто. Вследствие стойкой резистентности к АС1 к терапии был добавлен пэгвисомант (Сомаверт) в дозе 10 мг п/к ежедневно. Через 2 месяца от начала комбинированного лечения уровень ИРФ-1 снизился с 348 до 155 нг/мл, через 4 месяца – до 131 нг/мл.
Обсуждение
Согласно литературным данным, эффективность монотерапии пэгвисомантом достигает 89%. Комбинация пэгвисоманта с АС1 способна обеспечивать биохимическую ремиссию большинству пациентов. Согласно консенсусному соглашению, применение пэгвисоманта в качестве монотерапии (или комбинации с АС1) рекомендуется пациентам с отсутствующей чувствительностью к АС1, т.е. снижение уровня ИРФ-1 составляет менее 20%. Coopmans et al. рекомендуют комбинацию пэгвисоманта и АС1 в качестве второй линии лечения при всех случаях отсутствия чувствительности, определяемой как сохранение величины ИРФ-1 индекса >1,3. Комбинированное лечение, воздействующее на различные патогенетические механизмы развития заболевания, обеспечивает более надежный контроль соматотропной функции и уменьшение суммарной дозы препаратов.
Поскольку монотерапия пэгвисомантом не уменьшает объема опухоли, его комбинация с АС1 блокирует продолженный рост аденомы гипофиза у большинства пациентов. В данном случае играет роль антипролиферативный эффект АС1, который реализуется независимым путем в отличие от антисекреторного действия [12].
В обзоре S.J. Neggers et al. приводятся обоснования наблюдаемого снижения терапевтической дозы пэгвисоманта при комбинированном лечении. Поскольку эффективность пэгвисоманта как ингибитора рецепторов ГР зависит от его концентрации в крови, действие АС1, направленное на подавление опухолевой секреции ГР, снижает его содержание и уменьшает потребность в препарате. Кроме того, аналоги соматостатина 1-й генерации осуществляют внегипофизарное действие: а) снижают численность и экспрессию рецепторов ГР в печени в результате уменьшения концентрации инсулина в портальной системе; б) оказывают прямое ингибирующее действие на секрецию ИРФ-1, не зависимое от ГР; в) ингибируют продукцию ИРФ-1 гепатоцитами; г) способствуют 20%-ному повышению концентрации пэгвисоманта в крови. Таким образом, прямое и опосредованное действие АС объясняет снижение терапевтической дозы пегвисоманта при его комбинации с АС1.
Из сказанного следует, что терапевтическая доза пэгвисоманта зависит от дозы АС1. По данным Датского регистра, при высокой дозе АС1 средняя еженедельная терапевтическая доза пэгвисоманта составляла 80 мг (с интервалом от 30 до 300 мг), что позволило достичь нормализации уровня ИРФ-1 97% больных. В то время как монотерапия пэгвисомантом требовала более высокой еженедельной кумулятивной дозы препарата (около 130 мг) для достижения контроля акромегалии [20, 21].
Выделяют отдельные группы пациентов, которым требуется бόльшая стартовая доза и более быстрая титрация препарата: больные с высокой гормональной активностью (ИРФ-1 индекс >2,7); имеющие СД2; избыточную массу тела; молодой возраст и женский пол [22, 23].
Комбинация каберголина и пэгвисоманта может иметь дополнительные опции у определенной группы пациентов с умеренно повышенным уровнем ИРФ-1 на фоне монотерапии пэгвисомантом. Однако ее использование не особенно распространено в клинической практике и, согласно обсервационному исследованию ACROSTUDY, используется не более чем у 10% больных. Ретроспективные исследования показали, что комбинация каберголина и пэгвисоманта способствовала нормализации уровня ИРФ-1 у 28% больных. Наиболее чувствительными к такой терапии оказались больные с уровнем ИРФ-1 индекса <1,6 женского пола, с повышенной концентрацией пролактина и низкой массой тела. Совместное применение пэгвисоманта и каберголина имеет несколько относительных преимуществ перед комбинацией пэгвисоманта и АС1, поскольку каберголин принимается перорально, является более дешевым и отличается лучшей переносимостью [24, 25].
Комбинированная терапия и опухолевый рост
Предупреждение дальнейшего опухолевого роста и масс-эффекта – предпочтительная цель лечения акромегалии, поскольку наличие опухоли больших размеров ассоциируется с плохим клиническим прогнозом. Антитуморозный эффект АС известен более 30 лет. Клинические данные доказывают, что АС1 обладают антипролиферативным действием и вызывают уменьшение объема опухоли у большинства пациентов. При этом наибольшее уменьшение объема наблюдалось у впервые выявленных пациентов и у тех, кто находился на монотерапии АС1 более 1 года.
Как следует из литературных данных, пасиреотид ЛАР обладает более выраженным деструктивным действием на аденому гипофиза по сравнению с АС1. При проведении клинического исследования РАРЕ на фоне комбинации ПАС ЛАР и пэгвисоманта у 14 (30%) из 47 больных отмечалось повышение сигнала на Т2-взвешенных МР-изображениях, что связывают с развитием кистозной дегенерации и некрозом опухолевых клеток. При этом наблюдалось клинически значимое (≥25%) сокращение опухолевого объема у 5 из 14 больных с гиперинтенсивными аденомами при 9-месячном лечении препаратом пасиреотид ЛАР. Полагают, что первичная терапия пасиреотидом в качестве предоперационной подготовки способна улучшить результаты хирургического вмешательства. Потенциальный антитуморозный эффект пасиреотида ЛАР может способствовать снижению гормональной активности с улучшением клинической симптоматики или даже способствовать развитию гипофизарной недостаточности.
Вследствие этого рекомендуется динамический контроль тропных функций при длительном применении пасиреотида как в качестве монотерапии, так и в сочетании с пэгвисомантом [26].
Агонисты дофамина также оказывают антипролиферативное действие на опухолевые клетки. Отмечено, что у больных, резистентных к АС1, добавление каберголина в дозе 0,25–2 мг в неделю способствовало уменьшению объема опухоли через 6 месяцев от начала лечения. Авторы полагают, что для пациентов, резистентных к АС1, применение каберголина полезно, поскольку АС1 контролируют рост опухолевой массы, тогда как каберголин снижает уровень ИРФ-1 [12, 27].
Вопросу о возможном увеличении размеров опухоли на фоне приема пэгвисоманта уделялось пристальное внимание. Результаты относительно динамики опухолевого объема на фоне моно- или комбинированной терапии с АС1 оказались противоречивыми. Некоторые исследователи отмечали увеличение объема аденомы на фоне лечения у 5–7% больных. В итальянском обсервационном наблюдении ACROSTUDY (249 пациентов) при контрольном МРТ уменьшение объема опухоли отмечалось у 13,7%, тогда как увеличение – у 8,8%. В работе A. Bianchi et al. отмечено, что только у 1 из 35 наблюдаемых пациентов был выявлен небольшой рост аденомы, который в дальнейшем не прогрессировал после 6 месяцев лечения.
В том же исследовании установлено, что среди 27 пациентов, получавших пэгвисомант в комбинации с АС, достоверный рост (>25%) резидуальной аденомы возник лишь в одном случае. Причем данный пациент отличался агрессивным течением заболевания с плохим контролем, и когда у него отмечался дальнейший рост аденомы, он получал 40 мг пэгвисоманта и 120 мг ланреотида Аутожель каждые 4 недели [28].
Обычно продолженный опухолевый рост наблюдается в течение года лечения пэгвисомантом и может отражать агрессивный характер опухолевого развития или быть следствием прекращения лечения АС (ребаунд-эффект). Отсутствие предварительного облучения или небольшая продолжительность лечения АС до назначения пэгвисоманта ассоциируется с повышенным риском опухолевого роста. Показательно, что изменение опухолевого объема не коррелирует с уровнем ИРФ-1. Таким образом, при оценке влияния пэгвисоманта на рост опухолевой ткани следует принимать во внимание исходный сценарий опухолевого развития, предварительную чувствительность к терапии (включая АС), а также исходный объем опухолевой ткани. Вследствие интерперсонализированного колебания объема гипофиза следует внимательно контролировать все МР-изображения опухоли до и на фоне лечения пэгвисомантом для исключения ложных результатов [29].
Безопасность и качество жизни
АС 1-й генерации отличаются хорошей толерантностью и маловыраженными транзиторными побочными эффектами. Как правило, они проявляются преходящими гастроинтестинальными нарушениями. К более серьезным ятрогенным последствиям относятся алопеция, холелитиаз и брадикардия. Развитие холестаза обусловлено снижением секреции холецистокинина и сократительной способности желчного пузыря, что вызывает повышение концентрации желчи, развитие билиарного сладжа и холелитиаза [30]. Негативное влияние АС1 на углеводный обмен считается незначительным. В 47 проспективных клинических исследованиях, в которых принимали участие 1297 пациентов, оценивалось влияние АС1 на углеводный обмен. Авторы показали, что АС1 снижают секрецию инсулина, что не всегда сочеталось с уменьшением уровней ГР и ИРФ-1.
К сожалению, следует отметить, что монотерапия пасиреотидом имела негативное влияние на метаболизм глюкозы, обусловленное синхронным подавлением секреции инсулина и инкретина, что приводило к развитию гипергликемии и СД. В двух клинических исследованиях проводилось сопоставление результатов лечения больных акромегалией АС1 и пасиреотидом ЛАР. Гипергликемия при АС1 наблюдалась в 22–20% случаев против 57–65% больных на лечении пасиреотидом. В РАРЕ-исследовании частота больных СД увеличилась с 33 до 69% через 24 недели и повысилась до 77% через 48 недель от начала лечения.
Среди побочных эффектов комбинированного применения АС1 и каберголина упоминаются тошнота, головная боль, головокружение и гипотония. Высокие дозы каберголина, применяемые при болезни Паркинсона, вызывали вальвулопатию. Однако низкие дозы или кратковременное использование каберголина не вызывало развития клапанной недостаточности у больных акромегалией [12].
Побочные эффекты при лечении пэгвисомантом обычно незначительные и транзиторные. Наиболее часто встречается транзиторное повышение уровня печеночных ферментов, чаще наблюдаемое при комбинации пэгвисоманта с АС1. Обычно повышение уровня трансаминаз более 3 норм наблюдалось только у 5% больных. В наблюдательном исследовании ACROSTUDY только у 2,5% больных наблюдалось повышение уровня трансаминаз более 3 норм. К факторам риска повышения уровня трансаминаз относятся СД2, синдром Жильбера, мужской пол.
Реже наблюдаются липогипертрофии в местах инъекций, появление которых объясняют локальным снижением соотношения между липолитическим действием ГР и липосинтетическим влиянием инсулина в местах инъекций. Их профилактика требует необходимости частой ротации мест введения препарата.
Примечательным свойством пэгвисоманта является его положительное влияние на углеводный обмен. По данным испанской когорты ACROSTUDY, у больных акромегалией и СД лечение пэгвисомантом вызывало достоверное снижение тощаковой гликемии, величины HbA1c без изменения режима сахароснижающей терапии [22, 31].
Заключение
Согласно опроснику качества жизни, комбинация АС1 и пэгвисоманта положительно влияла на самочувствие больных. К преимуществам комбинированной терапии также относилось уменьшение головных болей вследствие ингибиции ноцицептивных пептидов, что свидетельствует о предпочтительности использования такой схемы лечения больных краниалгиями [12]. Таким образом, на основании многолетних клинических наблюдений можно сделать вывод: использование пэгвисоманта в комбинации с АС1 обеспечивает достаточный биохимический и опухолевый контроль пациентов, плохо контролируемых при монотерапии АС1.



