Введение
Острые кишечные инфекции (ОКИ) остаются одной из актуальных проблем здравоохранения, нанося значительный экономический ущерб как нашей стране, так и всему миру [1, 2]. Уровень заболеваемости ОКИ у детей значительно выше, чем у взрослых, причем наибольшее количество их регистрируемых случаев приходится на детей в возрасте до 7 лет [3]. Причиной возникновения ОКИ могут быть как бактериальные (сальмонеллы, шигеллы, диареегенные кишечные палочки, иерсинии), так и вирусы (рота-, норо-, энтеро-, аденовирусы, астро-, корона-, калицивирусы) и протозойные возбудители (лямблии, амебы, балантидии, изоспоры, крипто-, микроспоридии). Воздействие возбудителя на микробиоту кишечника, а также этиотропная терапия, используемая в терапии ОКИ, ведут к нарушению кишечного микробиоценоза и развитию дисбиотических нарушений, наблюдаемых при инфекционном процессе любой этиологии [4]. Одним из важнейших аспектов медикаментозного лечения ОКИ считается пробиотическая терапия.
Пробиотики – это живые микроорганизмы, при введении в адекватном количестве оказывающие положительный эффект на здоровье хозяина (World Gastroenterology Organisation, 2008).
Наиболее часто в качестве пробиотиков используются штаммы лакто- и бифидобактерий как основных представителей облигатной микрофлоры. Также для этой роли могут применяться дрожжевые Saccharomyces spp. и некоторые штаммы Escherichia coli.
Попытки воздействовать через коррекцию микробиоценоза на здоровье человека имеют долгую историю. Еще И.И. Мечников в 1910 г. предлагал использовать кисломолочные продукты для омоложения и продления жизни, видя в этом ключ к долголетию. С 1930-х гг. начали разрабатываться лекарственные препараты, содержавшие лакто- и бифидобактерии, которые могут использоваться при широком спектре заболеваний человека.
Положительное воздействие пробиотиков осуществляется за счет следующих механизмов [5–7]:
- Предотвращение адгезии чужеродных микробов (конкуренция за сайты связывания на эпителии кишечника).
- Конкуренция за пищевые субстраты с патогенными и условно-патогенными микроорганизмами.
- Синтез важнейших нутриентов: аминокислот (аргинин, триптофан, тирозин, цистеин и др.), витаминов (группа В, К), летучих (короткоцепочечных) жирных кислот, биоаминов (гистамин, серотонин, пиперидин, ГАМК), гормонально-активных веществ (норадреналин, стероиды), антиоксидантов (витамин Е, глутатион).
- Продукция антимикробных субстанций (бактериоцины, лизоцим, проглутамат, пероксид, кислоты).
- Утилизация пищевых субстратов – переваривание пищи за счет активизации пристеночного пищеварения, синтеза ферментов.
- Продукция цитопротективных веществ (аргинин, глутамин, полиамины).
- Стимуляция иммунного ответа на патогены (синтез sIgA, IgG, повышение синтеза цитокинов макрофагами и T-клетками, усиление фагоцитоза).
- Участие в переваривании пищи (продукция ферментов, отвечающих за гидролиз клетчатки, белков, жиров, крахмала, деконъюгацию желчных кислот).
- Синтез витаминов, аминокислот, холестерина, мочевой кислоты, органических кислот.
- Снижение клеточной проницаемости (фосфорилирование белка межклеточных соединений).
- Повышение синтеза муцина (стимуляция гена MUC-3).
- Препятствование микробному декарбоксилированию пищевого гистидина и повышению количества гистамина, уменьшению антигенной нагрузки за счет защиты стенки кишки от проникновения антигенов в кровь.
Использование данных эффектов в лечении ОКИ – основная и наиболее традиционная сфера применения пробиотических препаратов. На сегодняшний день проведена масса клинических исследований по оценке эффективности пробиотиков для различных групп детей: при нозокомиальных и внебольничных ОКИ, при ОКИ в развивающихся и развитых странах, при ОКИ вирусной и бактериальной этиологии.
Цель данного исследования состояла в анализе литературных публикаций исследований эффективности пробиотиков при лечении и профилактике ОКИ у детей и оценка штаммовой чувствительности ряда кампилобактерий – распространенных возбудителей ОКИ – к различным пробиотическим штаммам.
Методы
Проведен анализ публикаций в системах PubMed, EMBASE и Web of Science с декабря 2000 по июнь 2020 г., осветивших исследования по клиническому применению пробиотиков при ОКИ у детей. Использованы следующие поисковые термины: «пробиотики», «аутопробиотики», «острый гастроэнтерит», «диарея», «патогенетическая терапия», «колит», «гемоколит», «кал» без каких-либо языковых ограничений. Основным источником сведений служили полнотекстовые научные публикации. Дополнительные источники определялись на основании анализа списка литературы включенных работ.
Помимо этого проведено исследование чувствительности Campylobacter spp. к различным пробиотическим штаммам.
Для исследования антикампилобактерной активности были взяты следующие пробиотики: Enterococcus faecium L3, Lactobacillus plantarum 8 R-A3, смесь Lactobacillus acidophilus, Enterococcus faecium SF68, Bifidobacterium bifidum и Saccharomyces boulardii.
Антагонистическую активность оценивали с помощью метода двухслойного агара. В питательную среду (триптиказеино-соевый агар, Conda Pronadisa, Испания) добавляли проботические культуры в концентрации 7 и 5 lg КФЕ/мл. После застывания на поверхность нижнего слоя наносили второй слой той же питательной среды, не содержавшей пробиотиков.
Далее на поверхность верхнего слоя засевали культуры кампилобактерий в концентрациях 6, 7 и 8 lg КФЕ/мл. Определяли минимальное количество пробиотических бактерий ингибирующих рост Campylobacter spp.
Пять клинических изолятов Campylobacter spp. (два штамма С. coli и три – С. jejuni) получены из коллекции бактериальных культур ФГБНУ «Детский научно-клинический центр инфекционный болезней».
Результаты исследования
Применение пробиотиков с целью профилактики ОКИ
Понимание пробиотических препаратов как безопасных и эффективных средств, которые могут длительное время приниматься в составе детских смесей или других продуктов повседневного рациона, позволяет говорить о профилактике ОКИ у здоровых детей групп риска как о рациональном методе терапии.
В большинстве исследований профилактического действия пробиотической терапии изучали штаммовые эффекты в составе кисломолочных продуктов. Группа британских исследователей еще в 2002 г. показала, что применение пробиотиков приводит к активации иммунных клеток лимфоидной ткани, ассоциированной с микробиотой [8]. Группы индийских и российских исследователей в аналогичных по дизайну работах продемонстрировали снижение частоты диарейных заболеваний и ускорение прибавки веса на фоне применения пробиотиков [9, 10].
В других исследованиях результаты профилактического действия пробиотиков не столь значительно высоки. В частности, в обзорной статье польских авторов показан незначительный эффект пробиотических штаммов Lactobaccillus rhamnosus GG (LGG) и B. lactis, применяемых отдельно или в комбинации с S. thermophilus, L. reuteri, L. rhamnosus и L. acidophilus [10, 11]. В то же время в одном из крупных исследований последних лет показано, что ежедневное введение пробиотического штамма L. reuteri DSM 17 938 здоровым детям способно снижать частоту возникновения ОКИ у детей дошкольного возраста. Эти противоречивые результаты могут быть частично объяснены различиями в дозах и жизнеспособности штаммов пробиотиков, применяемых в различных регионах [12].
Европейское и Североамериканское педиатрические общества пришли к консенсусу о недостаточности доказательств в поддержку использования обогащенных пробиотическими штаммами детских смесей или кисломолочных продуктов, а также других лекарственных форм для профилактики ОКИ. Более того, Европейское общество детской гастроэнтерологии и питания (ESPHGAN) охарактеризовало данные об эффективности пробиотиков как неубедительные [13, 14]. По мнению Американской академии педиатрии, использование пробиотиков может быть эффективным для ряда детей определенных групп, в частности нуждающихся в долгосрочной медицинской помощи или длительное время находящихся в закрытых коллективах, центрах по уходу или в медицинских организациях [15].
Профилактика нозокомиальных ОКИ
Несмотря на трудности с объективной оценкой распространенности и регистрации, нозокомиальные ОКИ – одна из наиболее частых причин увеличения срока госпитализации. У детей ротавирус остается основной причиной нозокомиальных ОКИ, уступая в странах с широким охватом вакцинацией только гастроэнтеритам норовирусной этиологии [16]. Мытье рук и изоляция инфицированных детей представляют собой первые и недорогие процедуры для предотвращения внутрибольничной диареи, но эффективности этих мер недостаточно.
Наибольшие ожидания в отношении протективного действия пробиотиков связывают с действием LGG. Однако, даже принимая во внимание ряд исследований, указывающих на снижение риска развития ротавирусной инфекции при приеме пробиотиков, содержащих LGG, до сих пор остается не вполне доказанным: эффективны ли они в качестве средства профилактики нозокомиальной диареи [17]? По данным Европейского агентства по безопасности пищевых продуктов и продуктов питания, только одно исследование, проведенное H. Szajewska et al., показало позитивное влияние LGG на частоту развития или длительность ОКИ у госпитализированных детей [18].
В мета-анализе, проведенном той же группой ученых, показано, что применение LGG по сравнению с плацебо госпитализированными детьми позволяет снижать общую частоту нозокомиальных ОКИ, в частности ротавирусной инфекции, в 2,7 раза [19].
Высокую эффективность показало применение пробиотических бифифдобактерий при профилактике нозокомиальной инфекции у детей первого года жизни [20]. В частности, группа японских ученых продемонстрировали положительные эффекты Bifidobacterium breve для детей на фоне иммуносупрессии, вызванной химиотерапией по поводу онокологических заболеваний: после введения пробиотика снижалась частота кишечных осложнений и вынужденного назначения антибактриальных препаратов в связи с избыточным ростом условно-патогенной анаэробной флоры [21].
Лечение ОКИ
Острые инфекционные заболевания служат основным, наиболее часто встречающимся показанием к применению пробиотиков в педиатрической практике. На сегодняшний день в зависимости от региона, где врач осуществляет свою клиническую практику, подходы к пробиотической терапии различаются. В частности, это было отражено в согласительных документах и крупных многоцентровых исследованиях, формулирующих региональные клинические рекомендации для врачей (табл. 1).
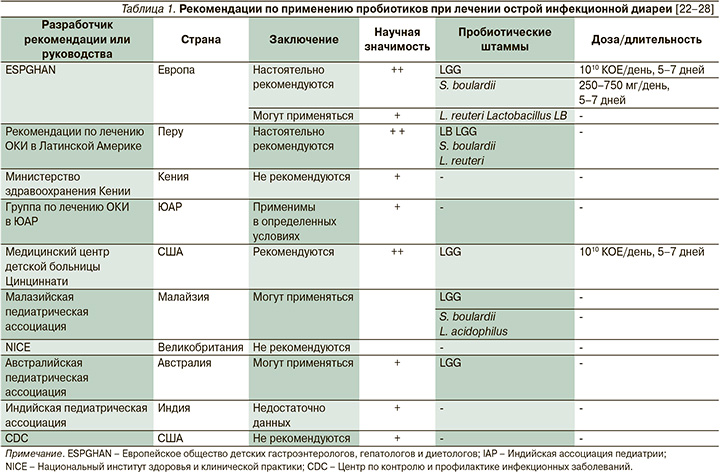
Различия в рекомендациях во мном определяются неоднородностью структуры ОКИ, уровнем развитости системы здравоохранения и доступностью пробиотиков на рынке. В частности, в Австралии сложилась парадоксальная ситуация, когда, несмотря на высокий уровень доказательности эффективности использования этих средств по заключению локальной экспертной группы, пробиотиков на рынке медикаментов нет.
В 2014 г. ESPGHAN подготовило два документа, определивших порядок назначения пробиотиков в Европейском регионе [27]. В документах содержится отдельная оценка моно- и мультиштаммовых пробиотиков. Пробиотические штаммы включались в рекомендации только при наличии не менее двух многоцентровых исследований препарата. В составе комплексного лечения ОКИ в дополнение к пероральной регидратационной терапии рекомендовано добавление одного из четырех штаммов пробиотиков. Было показано, что LGG, S. boulardii, L. reuteri и Lactobacillus LB снижают продолжительность диареи и лихорадки при ОКИ примерно на 24 часа (без существенных различий в эффективности), а также уменьшают риск тяжелой дегидратации.
LGG и S. boulardii получили статус «настоятельно рекомендуемых» по результатам широких исследований. Недостаточно высокий уровень научной значимости определяется различиями в методологии при проведении исследований различными группами исследователей. Latobacillus LB не соответствует стандартному определению пробиотика, представляя собой инактивированный нагреванием лекарственный препарат на основании симбиотического микроорганизма.
Применение Enterococcus faecium SF68 не рекомендовано детям, несмотря на несомненные положительные клинические эффекты, из-за риска передачи плазмидных генов резистентности к ванкомицину. Доказательная база по другим пробиотическим штаммам оказалась недостаточной для формирования однозначных рекомендаций в соответствии с критериями доказательности ESPGHAN.
При анализе рекомендаций других ассоциаций обращает на себя внимание частое упоминание LGG в качестве потенциального элемента комбинированной терапии ОКИ. Рекомендации CDC (США), признавая положительные эффекты пробиотической терапии, предоставляют принятие решение о необходимости назначения пробиотика на усмотрение родителей пациента. Также в ряде документов отмечается необходимость использования больших доз пробиотических препаратов. В частности, показано уменьшение длительности вирусовыделения при назначении высоких доз Lactobacillus rhamnosus.
Суммируя заключения различных групп исследователей, можно сделать следующий вывод: при лечении ОКИ LGG и S. boulardii – по-прежнему наиболее изученные и эффективные пробиотики.
Персонифицированная терапия пробиотиками
Несмотря на необходимость разработки унифицированных рекомендаций с учетом максимальной эффективности пробиотиков при большинстве нозологических форм ОКИ, для оптимизации терапии тяжелых форм инфекции у пациентов групп риска целесообразно проведение лабораторной диагностики с индивидуальным подбором пробиотика.
Было установлено, что E. faecium L3, L. acidophilus, L. plantarum 8 R-A3 проявляли антагонистическую активность в отношении Campylobacter spp. в концентрациях 5 и 7 lg КФЕ/мл (табл. 2).
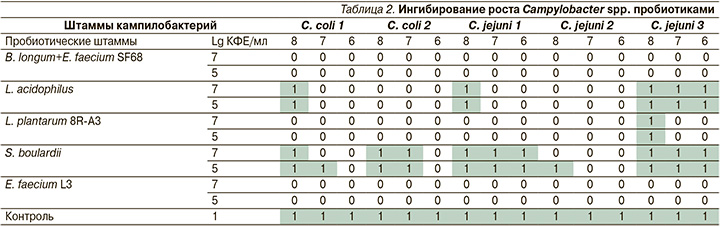
S. boulardii не ингибировал роста всех штаммов кампилобактерий при добавлении в нижний слой агара культуры сахаромицетов в концентрации 5 lg КФЕ/мл и посеве индикаторных культур в дозе 6–7 lg КФЕ/мл. Как следует из описания антикампилобактерной активности S. boulardii, для задержки роста кампилобактерий под влиянием метаболитов сахаромицетов (действовавших только в дозе 7 lg КФЕ/мл) важно было количественное соотношение антагониста и кампилобактерий.
Для более активно действующих культур молочнокислых бактерий доза антагониста также была важна и имела свои особенности для каждого пробиотика. Максимальное действие при концентрации 5 lg КФЕ/мл проявляли E. faecium L3, E. faecium SF68 и B. bifidum, которые ингибировали индикаторные культуры во всех концентрациях. L. acidophilus вне зависимости от дозы не действовал на три индикаторные культуры (С. coli 1, C. jejuni 2 и C. jejuni 3 в количестве 8–7 lg КФЕ/мл). L. plantarum 8R-A3 был более активен, не подавлял размножения только культуры C. jejuni 3 в количестве 8 lg КФЕ/мл.
Высокая антикампилобактерная активность лактобацилл может быть связанной с выработкой молочной кислоты, а энтерококков – дополнительно со способностью продуцировать бактериоцины.
Заключение
Таким образом, лечение и профилактика ОКИ служат наиболее достоверным показанием к применению пробиотиков. В настоящий момент существуют значимые подтверждения эффективности пробиотических штаммов как при лечении, так и при профилактике кишечных инфекций. Не до конца решенными остаются проблемы с дозировкой и длительностью пробиотической терапии при различных нозологических формах ОКИ у детей. Дальнейшего изучения требуют мультиштаммовые пробиотики. Для пациентов с тяжелыми формами кишечных инфекций целесообразен индивидуальный подбор пробиотика для повышения эффективности комплексной терапии.


