Введение
В настоящее время исследование генетических маркеров, отвечающих за наследственную предрасположенность к мультифакториальным заболеваниям, к которым относится бронхолегочная дисплазия (БЛД) у детей, остается одной из приоритетных задач предиктивной педиатрии и медицинской науки в целом. Различные варианты генетических полиморфизмов затрагивают практически все звенья патогенетической реализации БЛД у детей, чем и объясняется вариабельность клинического течения и исходов заболевания при идентичных условиях респираторной поддержки, гестационного возраста и коморбитных состояний. Согласно современным медицинским литературным обзорам, наибольший интерес представляет изучение генов модификаторов сурфактанта, клеточных протеиназ и генов, ассоциируемых с иммунным воспалением [1, 2]. Сурфактантный белок D (SFTPD) – один из ключевых регуляторов функций альвеолярных макрофагов, чем и объясняется ведущая роль его полиморфизмов в реализации и течении БЛД. Биологическая активность сурфактантного протеина D на клетки макроорганизма реализуется через взаимодействие со специфическими рецепторами макрофагов, в свою очередь приводящее к выработке провоспалительных и противовоспалительных цитокинов [3].
Цель исследования: определить влияние полиморфизма rs721917 гена SFTPD на течение и исходы БЛД у детей.
Методы
Исследование было проведено на базе ГБУЗ АО «ОДКБ им. Н.Н. Силищевой», Астрахань, в период с 2016 по 2019 г. Дети обследовались на этапе пересмотра диагноза (в возрасте 3 лет) в связи с возрастной трансформацией легочной ткани и реализацией того или иного варианта выхода из заболевания. Основную группу составили 106 пациентов с диагнозом БЛД. Сроки гестации колебались от 25 до 38 недель (29,3±3,2), масса при рождении от 732 до 3052 г (1543±280). Группа контроля была представлена 93 недоношенными новорожденными, не сформировавшими диагноз БЛД. Все пациенты основной группы были обследованы стандартизированными методами, включившими общеклинические (сбор анамнеза, клинический осмотр, лабораторные исследования) и инструментальные исследования (бронхофонография, компьютерная томография легких, ультразвуковое исследование сердца). Оценка степени тяжести заболевания и форма БЛД определялись согласно рабочей классификации клинических форм бронхолегочных заболеваний у детей [4]. В ходе анализа катамнестических данных пациенты были разделены на три группы в зависимости от степени тяжести БЛД. В 1-ю группу вошли 14 (9,6%) детей с легкой степенью тяжести; 2-я группа включила 72 (49,3%) ребенка со средней тяжестью БЛД; 3-ю группу составили 60 (41,1%) детей, имевших в анамнезе тяжелое течение заболевания.
В качестве исходов БЛД мы рассматривали следующие варианты: выздоровление, рецидивирующий бронхит, облитерирующий бронхиолит и хронический бронхит. В зависимости от варианта исхода были сформированы две подгруппы: в первой были пациенты с благоприятным вариантом выхода из БЛД, в которую вошли дети с полной реабилитацией легочной ткани (выздоровление) и рецидивирующим воспалением бронхиального дерева на фоне острой респираторной инфекции с последующим полным восстановлением (рецидивирующий бронхит). Вторую группу составили дети, у которых произошли необратимые изменения легочной ткани с переходом в такие нозологические формы, как хронический бронхит и облитерирующий бронхиолит. Генетическое типирование полиморфизма rs721917 гена SFTPD проведено медом полимеразной цепной реакции (ПЦР) с последующим рестрикционным анализом. Статистический анализ данных проведен с использованием программы Statistica, 13.3 (разработчик StatSoft.Inc). Сравнение номинальных данных проводилось при помощи χ2-критерия Пирсона. В качестве количественной меры эффекта при сравнении относительных показателей нами использован показатель отношения шансов (ОШ).
Результаты и обсуждение
Для оценки влияния генетической вариабельности полиморфизма rs721917 гена SFTPD на течение и исходы БЛД проведен анализ ассоциаций клинических проявлений заболевания с полиморфными вариантами данного гена, а также изучена вероятность ассоциации данного полиморфизма с реализацией БЛД при сравнении частот аллелей и генотипов в контрольной и основной группах больных.
В ходе исследования выявлено, что у пациентов контрольной группы генотип C/C полиморфизма rs721917 гена SFTPD определен в 42,0% (39 больных) случаев. У детей с БЛД данный генотип наблюдался у 36 (34,0%) детей. Частота встречаемости генотипа С/Т у пациентов, у которых формирования БЛД не произошло, составило 37,6%, при этом в основной группе – 54,7%. Гомозиготное состояние мутантного аллеля Т гена SFTPD обнаруженo лишь у 12 (11,3%) пациентов с диагностированным недугом, в то время как у младенцев группы сравнения в 20,4% (19 детей) случаев (табл. 1).
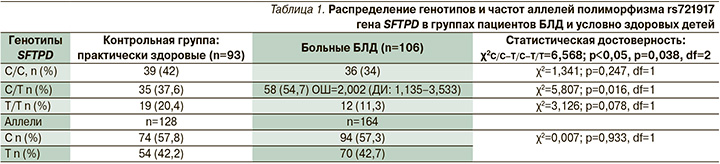
Таким образом, согласно полученным статистическим данным, гетерозиготный генотип С/Т предрасполагает к формированию БЛД у младенцев (χ2=5,807; р=0,016, df=1; OШ=2,002, доверительный интервал [ДИ]: 1,135–3,533). В то же время сравнительный анализ частоты встречаемости дикого (С) и мутантного аллеля (Т) в контрольной и основной группах не выявил достоверных различий (χ2=0,007; р=0,933, df=1).
Приняв во внимание, что степень тяжести БЛД имеет основополагающее значение для дальнейшего прогноза и морфофункциональной реабилитации легочной ткани с дальнейшим вариантом исхода БЛД, мы проанализировали возможность влияния полиморфизмов rs721917 гена SFTPD на степень тяжести заболевания. В ходе сравнительного анализа распределения частот аллелей (С, Т) и генотипов (С/С, С/Т, Т/Т) не было выявлено достоверных различий между группами пациентов с легкой, среднетяжелой и тяжелой формами БЛД. (χ2=1,153; р=0,562, df=2 и χ2=7621; р=0,107 соответственно) (табл. 2).
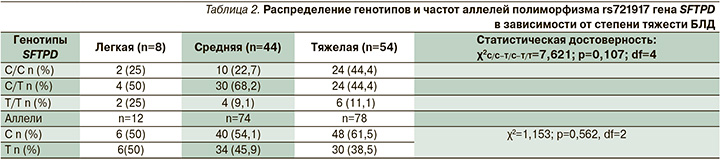
В то же время, несмотря на отсутствие статистически достоверных различий (достоверность на уровне 10%: χ2=7,621; p>0,05; р=0,107; df=4), при генотипе Т/Т чаще наблюдалась легкая форма заболевания относительно среднетяжелой и тяжелой (25,0%, 9,1 и 11,1% соответственно), в то время как у носителей дикого аллеля С в гомозиготном состоянии регистрировались тяжелые формы БЛД у 44,0% пациентов.
Изучение влияния полиморфизма rs721917 гена SFTPD на варианты исходов БЛД у детей, а именно на частоту выздоровления или формирования хронического бронхолегочного процесса, выявило статистически значимые различия (табл. 3).
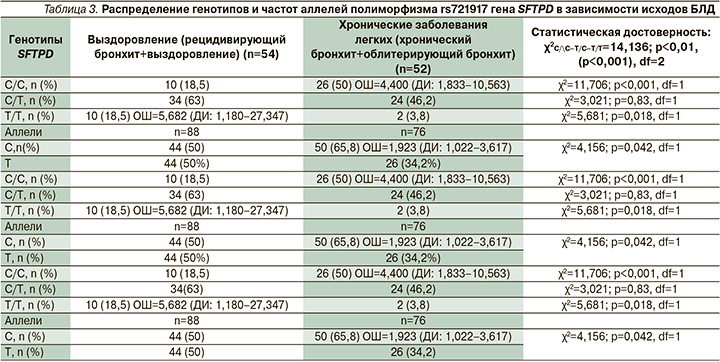
Выявлено, что у детей с генотипами С/С достоверно чаще формировались хронические заболевания легких, такие как хронический бронхит и облитерирующий бронхиолит (χ2=11,706; р<0,001, df=1). Показано, что доля генотипа Т/Т существенно увеличена в группе пациентов с благоприятным исходом в виде выздоровления или рецидивирующего бронхита (χ2=5,681; р=0,018).
Таким образом, генотип С/С служит маркером предрасположенности к формированию хронических заболеваний легких (OШ=4,400, ДИ: 1,833–10,563), в то время как генотип Т/Т представляет собой упреждающий или проективный вариант благоприятного исхода заболевания (OШ=5,682, ДИ: 1,180–27,347). Статистический анализ демонстрирует ассоциацию дикого аллеля С с неблагоприятным вариантом морфофункциональной способности к восстановлению легких с формированием в качестве исхода БЛД хронического бронхита и облитерирующего бронхиолита (OШ=1,923, ДИ: 1,022–3,617) (см. табл. 3).
Доказано, что обострение БЛД, как правило, ассоциировано с присоединением респираторной вирусной инфекции. Приняв во внимание биологическую активность сурфактантного протеина D в отношении неспецифического звена иммунитета, мы изучили влияние генотипов SFTPD на частоту и старт вирусных инфекций у детей с БЛД. Согласно полученным статистическим данным, ассоциаций между генотипами полиморфизма rs721917 гена SFTPD и частотой острых респираторный вирусных заболеваний (ОРВИ), а также наличием первых эпизодов ОРВИ до года не выявлено (χ2=0,281; р=0,869, df=2 и χ2=1,520; р=0,468 df=2 соответственно).
Развитие ОРВИ у пациентов с БЛД ассоциировано с реализацией бронхообструктивного синдрома (СБО), который может носить как эпизодический, так и рецидивирующий характер. В зависимости от тяжести и кратности СБО пациенты основной группы нуждались в краткосрочном или в длительном применении ингаляционных глюкокортикостероидов (ИГКС). При поиске возможных ассоциаций генотипов полиморфизма rs721917 гена SFTPD с длительностью использования ИГКС достоверных различий не выявлено (χ2=3,985; р=0,139; df=2). В то же время необходимо отметить, что ни один из пациентов с генотипом Т/Т не нуждался в длительной ингаляционной противовоспалительной гормональной терапии.
Учтя влияние различных вирусных и бактериальных инфекций, а также компонентов аутовоспаления при БЛД, сопровождавшихся развитием бронхоспазма, проведен анализ спектра и характера поражения функции внешнего дыхания детей по данным бронхофонограммы в ассоциации с полиморфными вариантами гена SFTPD. Согласно статистическому анализу, влияния генотипов и аллелей гена SFTPD на степень нарушения функции внешнего дыхания – легкие умеренные, выраженные (χ2=4,767; p>0,05; р=0,313; df=4), и уровень поражения дыхательных путей, а именно верхних, средних и нижних, не выявлено (χ2=4,767; р=0,313; df=4).
При генетической вариабельности полиморфизма rs721917 гена SFTPD получены статистически значимые различия по влиянию генотипов на характер микробиоты дыхательных путей у детей основной группы. У пациентов с генотипом Т/Т достоверно чаще отсутствует колонизация патогенной бактериальной флорой дыхательных путей (χ2=6,238; р=0,045, df=2) (табл. 4).
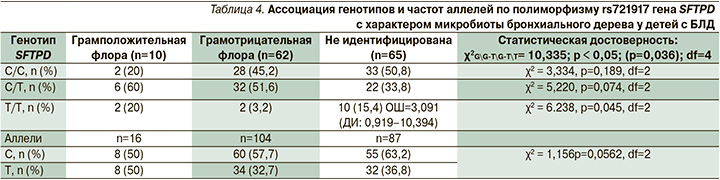
В то же время, несмотря на отсутствие достоверных различий, у пациентов с аллелем С в генотипах респираторная микробиота чаще характеризовалась присутствием грамотрицательных бактерий.
Обсуждение
Сурфактантный белок D (SFTPD) является одним из ключевых регуляторов функций альвеолярных макрофагов – основных клеток системы иммунитета в легких. Биологическая активность сурфакталного протеина D на клетки макроорганизма реализуется через взаимодействие со специфическими рецепторами – C1qR, SP-R210, гликопротеином gp340, CD91, коингибиторным рецептором SIRP-α иммунокомпетентных клеток, которые в свою очередь приводят в выработке провоспалительных и противовоспалительных цитокинов [3].
Для оценки влияния генетической вариабельности полиморфизма rs721917 гена SFTPD на развитие, течение и исходы БЛД, нами был проведен анализ ассоциаций клинических проявлений заболевания с полиморфными вариантами данного гена, а так же изучена вероятность ассоциации данного полиморфизма с реализацией бронхолегочной дисплазии при сравнении частот аллелей и генотипов в контрольной и основной группе пациентов.
С ходе исследования, было определено предрасполагающее влияние гетерозиготного генотипа С/Т полиморфизма rs721917 гена SFTPD на развитие БЛД у недоношенных младенцев. В тоже время, в ходе статистического анализа выявлено предрасполагающее влияние генотипа С/С и упреждающее генотипа Т/Т в реализации хронической бронхолегочной патологии (хронический бронхит, облитерирующий бронхиолит) в качестве исходов бронхолегочной дисплазии.
В современной медицинской литературе рассматривается вопрос о влиянии генетических полиморфизмов белков сурфактанта на течение и исходы хронических заболеваний легких. Так, согласно данным литературных обзоров, изучавших концентрации SFTPD в сыворотке крови в призме генетических полиморфизмов SFTPD, была выявлена сильная ассоциация между повышением уровня SFTPD в сыворотке крови с развитием хронической обструктивной болезни легких (ХОБЛ) у взрослых. При этом прослеживалась ассоциация риска для аллеля Т rs721917 гена SFTPD с ХОБЛ [5]. В настоящее время активно проводятся исследования по изучению влияние генетических модификаций белков сурфактанта на реализацию респираторного дистресс синдрома (РД) и вариантов респираторной поддержки у недоношенных детей. Наиболее масштабное было проведено у 211 зрелых и 202 недоношенных детей с измерением уровня SP-D, а также были генотипированы 7 однонуклеотидных полиморфизмов SFTPD (SNPs). В ходе работы было определено, что 3 гаплотипа, включавших минорные аллели rs1923534, rs721917 и rs3088308, демонстрировали весьма значимые ассоциации со снижением уровня SP-D и снижением отношения шансов для РД и объема респираторной поддержки [6].
В ходе нашего исследования при генетической вариабельности полиморфизма rs721917гена SFTPD получены статистически значимые различия по влиянию генотипов на характер микробиоты дыхательных путей у детей с БЛД. У пациентов с генотипом Т/Т достоверно чаще, отсутствует колонизация патогенной бактериальной флорой дыхательных путей. В тоже время, не смотря на отсутствие достоверных различий, у пациентов с аллелем С в генотипах, чаще микрофлора дыхательных путей характеризовалась присутствием грамотрицательных бактерий или патогенных грамположительных организмов (MRSA). Исходя из полученных данных, можно предположить, что, генотипы T/T, С/С и С/Т, вероятно, является генетическими маркерами устойчивости или восприимчивости дыхательных путей к инфекционным агентам. В исследованиях ряда авторов, было показано, что SP-D способствует очистке легких от бактериальных и вирусных патогенов, связываясь с гликококонъюгатами и частью липидов. Возможно, эффект их связан с модификацией уровня SP-D который оказывает антимикробное действие и гасит воспаление за счет прямых микробных взаимодействий и модуляции реакций клеток хозяина через ряд клеточных рецепторов. Однако, низкие концентрации белка, генетическая изменчивость, биохимическая модификация и протеолитический распад могут индуцировать разложение мультимерных SP-D в низкомолекулярные формы, которые могут индуцировать провоспалительную сигнализацию SP-D.
Результаты нашей работы расширяют и подтверждают значимость полиморфизма rs721917 гена SFTPD, как фактора, влияющего на легочную адаптацию и реализацию хронического бронхолегочного процесса у недоношенных детей, как исход заболевания.
Выводы
Таким образом, результаты проведенного исследования свидетельствуют, что полиморфизм rs721917 гена SFTPD ассоциирован с развитием БЛД у детей, а присутствие в генотипе дикого аллеля С в гомозиготном состоянии служит предрасполагающим генетическим предиктором реализации хронических заболеваний легких у детей. Генотип Т/Т прогностически благоприятен в отношении полного морфофункционального восстановления легочной ткани и снижает риск инфицирования дыхательных путей патогенной микрофлорой.
Вклад авторов
Концепция и дизайн исследования – П.Б. Хиштилова, Д.Ф. Сергиенко. Сбор и обработка материала – П.Б. Хиштилова. Статистическая обработка данных – П.Б. Хиштилова, Написание текста – П.Б. Хиштилова, Д.Ф. Сергиенко. Редактирование – Д.Ф. Сергиенко.


