Введение
Вирусы простого герпеса (ВПГ) 1-го и 2-го типов широко распространены в человеческой популяции и способны вызывать ряд состояний в организме человека, варьирующихся от бессимптомных до тяжелых генерализованных форм заболевания [1, 2]. Причиной такого клинического варьирования служит, с одной стороны, генетическая предрасположенность к инфицированию ВПГ и состояние иммунной системы человека, с другой – свойства вируса: способность к инфицированию сенсорных ганглиев вегетативной нервной системы и пожизненной персистенции в организме человека, а также тропизм к эпителиальным и нервным клеткам, обусловливающий полиморфизм клинических проявлений заболевания. К наиболее распространенным формам рецидивирующей ВПГ-инфекции относятся поражения кожи и слизистых оболочек (herpes simplex stomatitis, gingivostomatitis, herpes labialis, herpes genitalis и др.), встречающиеся у людей в любом возрасте – от младенцев до пожилых людей, и способные вызывать значительную боль, дисфункцию, дискомфорт [1]. Рецидивирующие поражения ВПГ-этиологии чаще встречаются у иммунокомпрометированных пациентов с прогрессирующим СПИДом, реципиентов органов и тканей, онкологических больных, получающих химиотерапию или иммуносупрессивные препараты [2]. У системно здоровых людей и иммунокомпрометированных пациентов ВПГ могут имитировать другие состояния слизистой оболочки полости рта и гениталий, вызывая у врачей трудности в диагностике этих состояний, а также приводить в синергизме с бактериями, грибами к развитию других заболеваний, являясь ко-фактором или триггером их тяжелого течения [3]. Так, рядом авторов установлено, что ВПГ и Porphyromonas gingivalis способны вызывать развитие и прогрессирование заболеваний пародонта и периимплантата. Предполагают, что между периодонтальными герпесвирусами и пародонтопатическими бактериями происходит двустороннее взаимодействие, при котором герпесвирусы способствуют росту бактерий, а бактериальные факторы – реактивации латентных герпесвирусов. Следует отметить, что герпесвирусная инфекция (ГВИ) оролабиальных и генитальной областей является также наиболее стигматизирующей из всех кожных заболеваний [4].
Для лечения ГВИ применяют медикаментозные средства системного и местного действий: этиотропные (ацикловир и его аналоги), иммунотропные препараты (интерфероны, индукторы интерфорона, иммуноглобулины); средства патогенетической и симптоматической терапии: пероральные анальгетики (аспирин, парацетамол, ибупрофен), антигистаминные препараты, витамины, адаптогены, пробиотики, спреи и растворы для полоскания горла или спринцевания (хлоргексидин, мирамистин, бензидамин), пастилки (содержащие бензокаин, гексилрезорцин, флурбипрофен), а также немедикаментозные вмешательства. Несмотря на широкий арсенал лекарственных средств, терапия ГВИ вызывает значительные трудности и не всегда приводит к ожидаемому результату [4]. Одной из причин неэффективности терапии служит формирование штаммов ВПГ с измененными свойствами, резистентных к традиционным методам лечения [1, 2]. В связи с этим активно проводится поиск новых препаратов, обладающих противовирусной активностью и иным механизмом действия, отличным от общепринятых средств, в т.ч. и среди ранее применяемых лекарственных средств по другим показаниям. Одним из таких средств является бензидамина гидлохлорид (БГ).
БГ (Benzidamine hydrochloride, C19H23N3O) относится к нестероидным противовоспалительным средствам – к группе индазолов, имеет широкий спектр применения при различных воспалительных процессах в ротовой полости, влагалище, в т.ч. и инфекционной этиологии [5]. При местном применении БГ хорошо абсорбируется через слизистые оболочки и проникает в воспаленные ткани, оказывая противовоспалительное, обезболивающее, местное анестезирующее, а также антисептическое действия [6]. Об изучении антигерпетических свойств БГ в настоящее время известно мало.
Цель настоящей работы состояла в оценке противовирусной активности БГ в отношении ГВИ, обусловленной ВПГ-1 и ВПГ-2 in vitro.
Методы
Культура клеток. Исследование проводили на перевиваемой культуре клеток почек африканских зеленых мартышек (VERO-В), полученной из коллекции культур тканей ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. В качестве ростовой среды и среды поддержки использовали ИГЛА («ПанЭко», Россия), содержащую 10 и 2% инактивированной нагреванием эмбриональной телячьей сыворотки (ЭТС, «ПанЭко», Россия) соответственно, а также 2 мМ L-глутамина (Sigma, USA) и антибиотики (100 ЕД/мл пенициллина, 100 мкг/мл стрептомицина и 40 мкг/мл гентамицина («ПанЭко»). Клеточную культуру в концентрации ~1,0×105 клеток/мл рассевали в 96-луночные пластиковые культуральные планшеты (Сostar, GB) за 24 часа до эксперимента, чтобы к его началу плотность клеток составляла приблизительно 80–90%-ного состояния монослоя и культивировали в термостате при температуре +37±0,5°С во влажной атмосфере, содержащей 5% СO2.
Вирусы. В исследовании использовали тест-вирусы: ВПГ-1, штамм «Кл», ВПГ-2, штамм «ВН», полученные из Государственной коллекции вирусов ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. Вирусы пассировали и титровали на монослойной культуре клеток VERO-В по общепринятой методике. Инфекционные титры ВПГ-1 и ВПГ-2 определяли стандартным методом титрования и рассчитывали по методу Рида и Менча [7], выражая в логарифмических единицах: lg ТЦД50 (тканевая цитопатогенная доза, вызывающая гибель 50% клеток монослоя) на 0,1 мл. Лизат культуральной вируссодержащей жидкости разливали по аликвотам и сохраняли до проведения опытов при -70±10,0°С.
Вещества. БГ (Benzidamine hydrochloride, C19H23N3O) производства Angelini Acraf S.p.A. (Италия), серия 588004, срок годности до 04.2020. Препарат растворяли в стерильной дистиллированной воде, фильтровали с помощью фильтра типа Swinnex с диаметром пор 0,22 мкм, разливали по аликвотам и сохраняли до проведения опытов при -20°С. Непосредственно перед проведением исследований готовили серийные разведения БГ на питательной среде ИГЛА без добавления сыворотки.
Также в исследовании использовали лекарственную форму БГ (Тантум Верде спрей, 0,15%-ный раствор БГ производства Angelini Acraf S.p.A. (Италия), серия 1620, срок годности до 06.2021).
В качестве препарата-сравнения использовали противовирусный препарат Зовиракс (ГлаксоСмитКляйн Маньюфэкчуринг С.п.А., Италия) – синтетический аналог пуринового нуклеозида (2-амино-1,9-дигидро-9-[(2-гидроксиэтокси)метил]-6H-пурин-6-он). Зовиракс (лиофилизат для приготовления раствора для инфузий) растворяли в стерильной дистиллированной воде, фильтровали с помощью фильтра типа Swinnex с диаметром пор 0,22 мкм. Серийные разведения Зовиракса готовили на питательной среде ИГЛА без добавления сыворотки.
Дизайн исследования
Исследование активности препаратов проводили в соответствии с требованиями Фармакологического государственного комитета РФ по экспериментальному (доклиническому) изучению новых фармакологических веществ [8].
Изучение препаратов предусматривало две схемы исследования: изучение их цитотоксического действия в интактной перевиваемой культуре клеток VERO-В по влиянию на морфологию и жизнеспособность клеток [8, 9], а также изучение их противовирусной активности [9, 10].
На первом этапе исследований оценивали цитотоксическое действие БГ на неинфицированные клетки VERO-В. Для этого в суточные культуры клеток, предварительно освобожденные от ростовой среды и трижды отмытые теплым раствором Хенкса, вносили различные концентрации препарата в составе питательной среды ИГЛА. В качестве контроля состояния клеточной культуры использовали питательную среду без препарата (отрицательный контроль). Культуру клеток в присутствии препарата и без него инкубировали при +37±0,5°С в СО2-инкубаторе. Результаты учитывали визуально методом световой микроскопии с помощью инвертированного микроскопа ежедневно в течение 96 часов по появлению цитодеструктивных изменений и изменению морфологии клеточного монослоя.
Также ежедневно определяли количество жизнеспособных клеток методом исключения витального красителя трипанового синего. Для этого клетки ежедневно в течение 96 часов снимали смесью трипсина и версена и прижизненно окрашивали 0,4%-ным раствором трипанового синего в течение 5 минут при +37±0,5°С. Затем подсчитывали число жизнеспособных (неокрашенных) и нежизнеспособных (голубых) клеток в камере Горяева. Жизнеспособность клеток в популяции оценивали по количеству неокрашенных клеток в процентах от общего числа клеток.
Концентрацию образца БГ, которая вызывала через 96 ч после внесения видимые при микроскопии изменения морфологии у 50% клеток или гибель 50% клеток в популяции, принимали за 50%-ную цитотоксическую концентрацию (ЦТК50).
На втором этапе исследований изучали противовирусную активность БГ в отношении экспериментальной ГВИ, обусловленной ВПГ-1 и ВПГ-2 в культуре клеток VERO-В.
Система оценки противовирусного действия БГ в культуре клеток включала изучение подавления цитопатического действия вируса (ВПГ-1, ВПГ-2) в культуре клеток (сytopathic еffect (СРЕ) reduction assay), а также влияния на репродукцию вируса (ВПГ-1, ВПГ-2) в культуре клеток.
В работе использовали однодневный монослой культуры клеток. В качестве инфицирующего препарата использовали лизат инфицированной ВПГ-1 или ВПГ-2 культуры клеток VERO-В с биологической активностью 6,0±0,5 lg ТЦД50/0,1 мл и 5,62±0,3 lg ТЦД50/0,1 мл соответственно. Инфицирование клеток VERO-В проводили одной дозой вируса из расчета 100 ТЦД50 на монослой. Исследование противовирусной активности БГ проводили по лечебной схеме: через час после инфицирования.
Эксперименты сопровождали соответствующими контролями. В качестве позитивного контроля использовали инфицированные тест-вирусами культуры клеток, к которым добавляли поддерживающую среду без препарата; в качестве позитивного контроля ингибиции вируса применяли инфицированные тест-вирусами культуры клеток, к которым добавляли через час после инфицирования Зовиракс в составе среды поддержки. В качестве негативного контроля использовали неинфицированные культуры клеток, к которым добавляли поддерживающую среду без препарата; в качестве негативного контроля цитотоксичности применяли неинфицированные культуры клеток, в которые вносили различные концентрации БГ в составе среды поддержки.
Учет результатов проводили, когда уровень накопления тест-вирусов в контрольных пробах достигал максимума и отмечалось их выраженное (100%) цитопатическое действие (ЦПД).
Вирусингибирующий эффект препарата оценивали по общепринятым показателям [1]: по снижению уровня накопления вируса под воздействием препарата (Δ, lg) и коэффициенту ингибирования (КИ,%).
Снижение уровня накопления вируса под влиянием препарата (Δ, lg) определяли по формуле 1:
Δ = Ак – Ао (1),
где Ак – уровень накопления вируса при культивировании без внесения в питательную среду изучаемого препарата (lg ТЦД50/0,1 мл), Ао – уровень накопления вируса при культивировании с внесением в питательную среду изучаемого препарата (lg ТЦД50/0,1 мл).
КИ (%) рассчитывали по формуле 2:
КИ = (Аконтр – Аоп)/Аконтр)×100% (2),
где Аконтр — уровень накопления вируса при культивировании без внесения в питательную среду изучаемого препарата (lg ТЦД50/0,1 мл); Аоп – уровень накопления вируса при культивировании с внесением в питательную среду изучаемого препарата (lg ТЦД50/0,1 мл).
Химиотерапевтический индекс (ХТИ) рассчитывали как отношение ЦТК50 к минимальной эффективной вирусингибирующей концентрации, снижающей, согласно нормативным требованиям, титры ВПГ-1 и ВПГ-2 не менее чем на 1,5 lg ТЦД50.
Статистическая обработка данных
Для получения статистически достоверных результатов эксперименты проводили трижды. Статистический анализ результатов выполняли общепринятыми для биологических исследований методами с применением прикладных программ анализа данных Microsoft Excel 5.0 и Statistica 7. Достоверность различий определяли по величине р. Различия признавали достоверными при p<0,05.
Результаты исследования
На первом этапе исследований оценивали цитотоксическое действие БГ на неинфицированные клетки VERO-В по его влиянию на морфологию и жизнеспособность клеток (табл. 1).
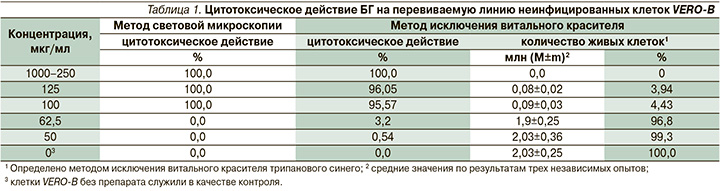
В результате проведенных экспериментов установлено, что ЦТК50 БГ для клеток VERO-В составляет 81,25 мкг/мл. В дальнейшем использовали БГ в концентрациях, не превышавших ЦТК50.
На втором этапе исследований изучали противовирусную активность БГ в отношении экспериментальной ГВИ, обусловленной ВПГ-1 и ВПГ-2 в культуре клеток VERO-В. Результаты изучения противовирусной активности БГ представлены в табл. 2–4.
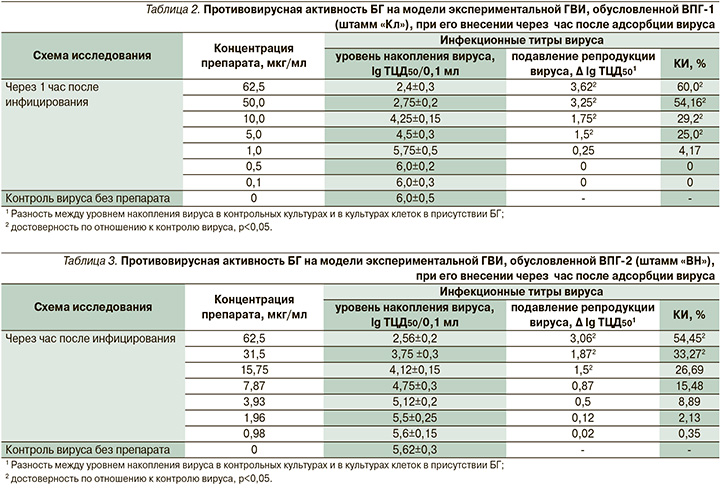
Как следует из данных табл. 2, использование БГ через час после адсорбции вируса (по лечебной схеме) приводило к снижению инфекционной активности тест-вируса ВПГ-1 на 1,5–3,6 lg ТЦД50 по сравнению с активностью вируса в контроле.
Максимальное статистически достоверное снижение инфекционных титров ВПГ-1 на 3,6 lg ТЦД50 отмечено при использовании БГ в максимальной изученной концентрации 62,5 мкг/мл (КИ – 60%), минимальной – на 1,5 lg ТЦД50 – в концентрации 5,0 мкг/мл (КИ – 25%; р<0,05). Концентрация БГ 5,0 мкг/мл рассматривалась как минимальную эффективную вирусингибирующую концентрацию препарата, снижающую, согласно нормативным требованиям, титры ВПГ не менее чем на 1,5 lg ТЦД50. ХТИ составил 16,25.
Следует также отметить, что применение БГ через час после адсорбции вируса приводило к отсроченному развитию цитопатического действия вируса (ЦДВ) в культуре клеток. Если в контрольных инфицированных ВПГ-1 культурах, инкубируемых в среде без добавления препарата, уже через 24 часа после инфицирования отмечали развитие ЦДВ, то в инфицированных ВПГ-1 культурах, инкубируемых в среде с добавлением БГ в концентрациях от 5,0 до 50,0 мкг/мл – через 48 часов после инфицирования.
Результаты применения БГ по отношению к экспериментальной инфекции, обусловленной ВПГ-2, представлены в табл. 3.
Применение БГ приводило к значимому снижению репродукции ВПГ-2, о чем свидетельствовали показатели инфекционных титров вируса. Максимальное статистически достоверное снижение инфекционных титров ВПГ-2 на 3,06 lg ТЦД50 отмечено при использовании БГ в концентрации 62,5 мкг/мл (КИ – 54,45%; р<0,05); минимальное снижение на 1,5 lg ТЦД50 – на фоне применения БГ в концентрации 15,75 мкг/мл (КИ – 26,69%). ХТИ составил 5,15.
Для референсного препарата Зовиракс ЦТК50 составила 500 мкг/мл, МИК (минимальная ингибирующая концентрация) по отношению к ВПГ-1 составила 0,2 мкг/мл (ХТИ – 2500); МИК по отношению к ВПГ-2 составила 0,5 мкг/мл (ХТИ – 1000).
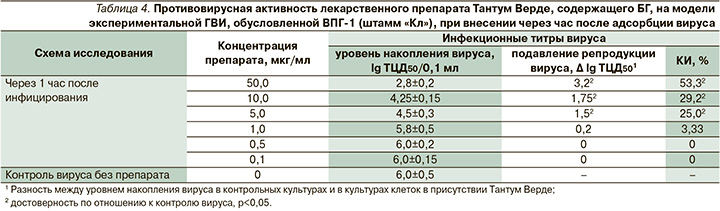
Аналогичные по сравнению с БГ данные получены для лекарственной формы препарата Тантум Верде (табл. 4).
Как следует из данных табл. 4, использование препарата Тантум Верде через час после адсорбции вируса (по лечебной схеме) приводило к снижению инфекционной активности тест-вируса ВПГ-1 на 1,5–3,2 lg ТЦД50 по сравнению с активностью вируса в контроле. Максимальное статистически достоверное снижение инфекционных титров ВПГ-1 на 3,0 lg ТЦД50 было отмечено при использовании препарата в концентрации 50,0 мкг/мл (КИ – 50%), минимальное – на 1,5 lg ТЦД50 в концентрации 5,0 мкг/мл (КИ – 25%; р<0,05). Концентрация 5,0 мкг/мл рассматривалась как минимальная эффективная вирусингибирующая концентрация препарата Тантум Верде, снижающая, согласно нормативным требованиям, титры ВПГ-1 не менее чем на 1,5 lg ТЦД50. ХТИ составил 12,5.
Следует также отметить, что применение препарата Тантум Верде в концентрациях от 5,0 до 50,0 мкг/мл через час после адсорбции вируса, как и при использовании субстанции БГ, приводило к отсроченному развитию ЦДВ в культуре клеток. Если в контрольных инфицированных ВПГ-1 культурах, инкубируемых в среде без добавления препарата, ЦДВ отмечали через 24 часа после инфицирования, то при инкубации в среде с добавлением Тантум Верде через 48 часов.
Таким образом, в проведенном исследовании установлено, что БГ в форме как субстанции, так и готового лекарственного средства Тантум Верде обладает противовирусной активностью в отношении экспериментальной инфекции, обусловленной ВПГ-1 и ВПГ-2 in vitro при использовании по лечебной схеме (через час после заражения), т.е. в раннем периоде репликации вируса.
Противовирусная активность препарата дозозависима.
Обсуждение
Среди актуальных проблем современной инфектологии заболевания кожи и слизистых оболочек герпесвирусной этиологии (herpes simplex stomatitis, gingivostomatitis, herpes labialis, herpes genitalis и др.) занимают одно из ведущих мест. Значимость их как медицинской проблемы определяется широким распространением в мире среди людей разного возраста, а также трудностями в лечении, несмотря на наличие этиотропных препаратов – синтетических ациклических нуклеозидов (ацикловира и его аналогов), являющихся препаратом выбора для лечения ГВИ как у иммунокомпетентных, так и у иммунокомпрометированных лиц [1, 4].
Одной из причин неэффективности терапии служит формирование штаммов ВПГ, резистентных к традиционным методам лечения [8, 9]. Согласно клиническим рекомендациям по ведению больных рецидивирующей ГВИ, ее лечение должно быть комплексным и индивидуализированным с учетом стадии заболевания и коморбидных состояний [4]. Терапия должна включать не только этиотропные, но и патогенетические, симптоматические средства, которые больные могли бы принимать и в периоде ремиссии с целью купирования воспалительных и токсических проявлений заболеваний иной этиологии, которые в свою очередь могут быть триггерами или ко-факторами развития рецидива ГВИ и связанных с ней осложнений.
В настоящее время в комплексной терапии острого тонзиллофарингита, вызванного ГВИ, применяют различные средства – антисептики, например цетилпиридиния хлорид, мирамистин, хлоргексидин [11].
Установлено, что цетилпиридиния хлорид – антисептик группы четвертичных аммониевых соединений, оказывает противомикробное, противогрибковое, а также вирулицидное действие, в т.ч. и в отношении ВПГ [12]. Аналогичные свойства показаны для других антисептических препаратов, таких как Мирамистин [13] и Гексорал [14].
В нашей работе показана эффективность БГ, применяющегося в настоящее время при различных воспалительных процессах в ротовой полости, влагалище, а также в отношении ГВИ, обусловленной наиболее распространенными среди людей ВПГ-1 и -2. Максимальный эффект по отношению к ВПГ-1 и ВПГ-2 был установлен при использовании препарата по терапевтической схеме в концентрации 62,5 мкг/мл. КИ ВПГ-1 и ВПГ-2 составил 60 и 54,45% соответственно (р>0,05). Противовирусная активность БГ выражена при его использовании на ранней стадии репликации ВПГ.
Несмотря на то что по своей активности БГ уступает таковой коммерческого референсного препарата (Зовиракс), полученные результаты позволяют предположить, что местное применение БГ может быть эффективным в ранней продромальной стадии заболевания, обычно сопровождающейся субклиническими симптомами. У некоторых пациентов с заболеваниями полости рта, половых органов такое раннее ингибирование репликации ВПГ в эпителиальных клетках полости рта и влагалища сможет изменить естественное течение инфекционного процесса.
Интерес к БГ обусловлен также наличием у него наряду с антимикробным действием противовоспалительной и анальгезирующей активности, т.к. у больных с herpes simplex stomatitis, gingivostomatitis, herpes labialis, herpes genitalis как в периоде рецидива, а у части больных и в периоде ремиссии сохраняются воспалительные изменения, жжение, боль разной степени выраженности в области бывших или будущих высыпаний. Противовоспалительное действие БГ связано с его способностью стабилизировать клеточные мембраны и ингибировать синтез простагландинов, а также синтез провоспалительных цитокинов, таких как фактор некроза опухоли α и интерлейкин (ИЛ) 1β без значительного влияния на другие провоспалительные (ИЛ-6, -8) или противовоспалительные цитокины (ИЛ-10, -1) [15]. У иммунокомпрометированных пациентов частым спутником ГВИ является грибковое поражение (кандидоз) ротовой полости, генитальной области, обусловленное Candida albicans [4]. БГ обладает противогрибковым действием, например, в отношении C. albicans за счет способности вызывать структурные модификации клеточной стенки грибов и метаболических цепей мицетов, препятствуя их репродукции.
Также БГ обладает антимикробным действием в отношении широкого спектра бактерий (в т.ч. Streptococcus pyogenes, являющегося частым возбудителем заболеваний полости РТ и ЛОР-органов, а также Escherichia coli и Streptococcus, имеющих клиническое значение в сфере гинекологических заболеваний) благодаря способности быстро проникать через мембраны микроорганизмов, вызывать повреждение клеточных структур, нарушение метаболических процессов и лизис клеток [16].
Заключение
БГ и готовая лекарственная форма на его основе Тантум Верде обладают противовирусными свойствами в отношении двух наиболее распространенных патогенов – ВПГ 1-го и 2-го типов in vitro – и перспективны в применении в комплексной терапии ГВИ как в острый период, так и с целью минимизации или профилактики развития рецидивов заболевания.
Вклад авторов: авторы сделали эквивалентный вклад в подготовку публикации.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов. Исследование проводилось при научном сотрудничестве с ООО «Анджелини Фарма Рус».



