Гистамин и гистаминовые рецепторы
Гистамин – один из важнейших медиаторов, относящийся к биогенным аминам и синтезирующийся из аминокислоты гистидина путем декарбоксилирования. В организме человека гистамин осуществляет ряд физиологических функций и участвует во многих патобиологических процессах. Основное депо гистамина в организме – тучные клетки и базофилы, где он находится в виде гранул в связанном состоянии. Наибольшее количество тучных клеток размещается в коже, слизистых оболочках бронхов и кишечника. Гистамин реализует свою активность посредством взаимодействия со специфическими гистаминовыми рецепторами (ГР), расположенными на клетках различных тканей. Они относятся к обширному семейству рецепторов, ассоциированных с G-белками (G protein-coupled receptors – GPCRs). Группа GPCRs принимает активное участие в трансмиссии внеклеточных сигналов через клеточную мембрану путем специфического распознавания и связывания разнообразных лигандов, таких как белки, ионы, нейропередатчики и даже световые стимулы (фотоны). GPCRs широко представлены в организме и принимают участие во многих процессах, как физиологических, так и патологических, таких как обоняние, вкус, зрение, когнитивные функции, эмоции, иммунный ответ, в т.ч. аллергия, а также в регуляции деятельности сердечно-сосудистой, нервной, пищеварительной, дыхательной и других систем организма [1]. К настоящему времени описано четыре типа ГР (табл. 1), среди которых наиболее изученные – это H1- и H2-рецепторы, которые распределяются как в периферической, так и в центральной нервной системе (ЦНС) и позволяют гистамину оказывать воздействие на гладкие мышцы и секреторную активность желез слизистых оболочек.

Действуя на H1-рецептор, гистамин вызывает зуд, стимулирует секрецию слизистой оболочки носа, сокращает гладкую мускулатуру в бронхах и кишечнике, расслабляет гладкую мускулатуру в мелких кровеносных сосудах. Кроме того, гистамин стимулирует секрецию желудочной кислоты через Н2-рецепторы. Н3-рецепторы в основном экспрессируются в ЦНС и действуют как ауторецепторы на гистаминергических нейронах, ингибируя высвобождение гистамина и модулируя другие нейротрансмиттеры. Н4-рецепторы обнаружены в клетках иммунной системы, желудочно-кишечном тракте, в ЦНС и первичных афферентных нейронах. Действие гистамина на Н4-рецепторы вызывает хемотаксис тучных клеток, секрецию цитокинов и активацию адгезивных молекул [7].
В развитии аллергии принимают участие преимущественно H1-рецепторы, однако к настоящему времени накоплены данные и о роли при иммунопатологических состояниях H4-рецепторов [7–10]. Обсуждается возможность применения препаратов, воздействующих на H4-рецепторы при различных заболеваниях, в т.ч. при аллергии [11]. H2-рецепторы могут также участвовать в развитии аллергических проявлений [12, 13].
Важен следующий факт: все GPCRs обладают конститутивной (спонтанной) рецепторной активностью, т.е. их активность проявляется даже в отсутствие агониста и его связи с рецептором [14]. Это наглядно объясняется моделью равновесного состояния рецептора: одновременного существования его спонтанно активных и неактивных форм. Под воздействием различных агентов может происходить нарушение равновесия и смещение в сторону активации (в случае ГР – под воздействием гистамина) или, напротив, в сторону неактивного состояния рецептора (при воздействии блокаторов, вернее – обратных агонистов H1-рецепторов). Кроме того, существуют нейтральные агонисты, которые связываются и с активной, и с неактивной формами рецепторов, сохраняя их равновесное состояние. Исходя из вышеизложенного, H1-антигистаминные средства, по сути, являются не блокаторами, а обратными агонистами рецепторов, хотя до настоящего времени традиционно сохраняется привычная терминология [15].
Действие гистамина на H1-рецепторы представлено широким разнообразием клинических проявлений:
- в кожных покровах – отек, гиперемия, ощущение зуда, высыпания;
- в верхних дыхательных путях – зуд, чихание, отек слизистой оболочки носа и придаточных пазух, увеличение секреции слизи;
- в нижних дыхательных путях – отек стенки бронхов, гиперсекреция и бронхоспазм;
- в слизистой оболочке глаз – зуд, гиперемия, отек и слезотечение;
- в желудочно-кишечном тракте – боли в животе, рвота, диарея, усиление выработки слизи, пепсина и соляной кислоты;
- в сердечно-сосудистой системе – системная артериальная гипотензия и нарушение сердечного ритма.
Гистамину принадлежит одна из ключевых ролей в развитии таких аллергических заболеваний, как атопический дерматит, аллергический ринит, бронхиальная астма, аллергический конъюнктивит, крапивница, а также системных анафилактических реакций [16].
Активация H1-рецепторов сопровождается продукцией фосфолипазы C, D и A2, что в итоге приводит к высвобождению ионов кальция (Ca2+), соответственно, к активации функции клетки. Кроме того, повышается активность ядерного фактора kB (NF-kB), что сопряжено с продукцией провоспалительных цитокинов и молекул межклеточной адгезии, таких как P-селектин, ICAM-1, VCAM-1, iNOS, TNF-α, GM-CSF, IL-1β, IL-6. Установлено, что NF-kB играет немаловажную роль в активации лимфоцитов, в частности способствует дифференцировке Т-хелперных клеток 2-го типа (Th2-лимфоцитов), что особенно актуально при аллергических болезнях. Повышенный уровень NF-kB обнаруживается у больных с различными типами аллергии, в т.ч. с бронхиальной астмой [17]. Таким образом, H1-рецепторы не только участвуют в ранней фазе аллергической реакции, но и обладают более широкими иммунологическими свойствами, в т.ч. играют немаловажную роль в развитии поздней фазы аллергического воспаления. Следовательно, противоаллергическое действие антигистаминных препаратов (АГП) многоплановое и включает в т.ч. противовоспалительный эффект [12].
Классификация антигистаминных препаратов
Согласно классификации, принятой Европейской академией аллергологов и клинических иммунологов, все АГП подразделяются на два поколения в зависимости от их влияния на ЦНС.
АГП первого поколения
Обратные агонисты Н1-рецепторов первого поколения проникают через гематоэнцефалический барьер и могут как стимулировать, так и подавлять ЦНС. Как правило, у большинства пациентов это проявляется подавлением ЦНС. Седативное действие при приеме АГП первого поколения субъективно отмечают 40–80% больных. Его отсутствие у отдельных пациентов не исключает объективного отрицательного действия этих средств на когнитивные функции, на что пациенты могут не жаловаться (способность к управлению автомобилем, обучению и др.). Нарушение функции ЦНС наблюдается даже при использовании минимальных доз этих средств. Влияние АГП первого поколения на ЦНС такое же, как при использовании алкоголя и седативных препаратов [18–20]. Стимуляция встречается у некоторых пациентов, получавших обычные дозы АГП, проявляясь беспокойством, нервозностью и бессонницей. Обычно центральное возбуждение характерно для передозировки АГП первого поколения, оно может приводить к судорогам, особенно у детей.
Для АГП первого поколения помимо седативного эффекта и влияния на когнитивные функции характерны следующие свойства:
- кратковременный эффект (вынужденный прием 3–4 раза в сутки);
- быстрое развитие тахифилаксии (необходимо менять препарат через каждые 7–10 дней);
- низкая избирательность действия: помимо Н1-рецепторов они блокируют рецепторы ацетилхолина, адреналина, серотонина, дофамина и ионные каналы, вызывая множество побочных эффектов: тахикардию, сухость слизистых оболочек, повышение вязкости мокроты.
АГП первого поколения могут способствовать повышению внутриглазного давления, нарушать мочеиспускание, вызывать боли в желудке, запоры, тошноту, рвоту, увеличивать массу тела [21]. Именно поэтому указанные препараты имеют ряд серьезных ограничений к применению среди пациентов с глаукомой, сердечно-сосудистой патологией, болезнями мочеполовой системы и т.д.
При остром отравлении H1-АГП первого поколения их центральные эффекты представляют собой наибольшую опасность: синдром включает галлюцинации, возбуждение, атаксию, нарушение координации, судороги и др. Фиксированные расширенные зрачки на раскрасневшемся лице вместе с синусовой тахикардией, задержкой мочи, сухостью во рту и лихорадкой весьма похожи на признаки отравления атропином. У детей при передозировке АГП первого поколения могут возникать возбуждение и судороги. Поэтому специалисты во многих странах призывают отказываться от этой группы препаратов для детей или применять их под строгим контролем. Кроме того, седативный эффект может ухудшать обучение и успеваемость детей в школе [22].
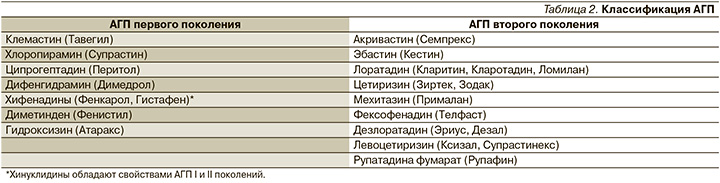
АГП второго поколения
Новые АГП (второго поколения) в отличие от старых препаратов, АГП первого поколения, отличаются селективным воздействием на H1-рецепторы, почти не проникают через гематоэнцефалический барьер, что уменьшает вероятность развития седативного эффекта при их применении, поэтому их можно рекомендовать водителям, людям, работа которых требует концентрации внимания, школьникам и студентам. Для АГП второго поколения характерна более высокая аффинность к H1-рецепторам, соответственно, быстрота развития клинического эффекта и более длительное действие (на протяжении 24 часов) по сравнению со средствами первого поколения, что позволяет применять большинство из них не чаще 1 раза в сутки. Для АГП второго поколения характерна низкая вероятность развития толерантности к препарату (нет тахифилаксии), и они имеют более благоприятный профиль безопасности.
H1-АГП (обратные агонисты Н1-рецепторов) второго поколения в настоящее время считаются препараом выбора при аллергическом рините, крапивнице, других зудящих дерматозах [16, 23–25].
Побочные эффекты АГП
Побочные эффекты АГП включают холинолитические эффекты (сухость во рту, синусовая тахикардия, запор, задержка мочи, нарушение зрения), адренолитическое (гипотензия, рефлекторная тахикардия, тревожность), антисеротониновое (повышение аппетита), центральное антигистаминовое действие (седация, повышение аппетита), блокада калиевых каналов в сердце (желудочковая аритмия, удлинение интервала G-T) [26]. Избирательность действия препаратов на целевые рецепторы и способность проникать через гематоэнцефалический барьер определяют их эффективность и безопасность [27].
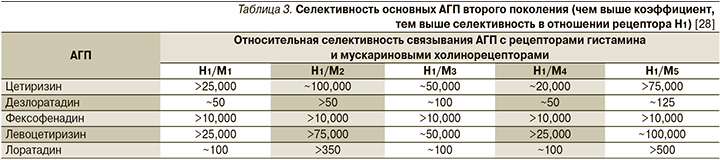
Среди АГП второго поколения наименьшим сродством к М-холинорецепторам, а значит, и практически полным отсутствием холинолитического действия обладают препараты цетиризин и левоцетиризин (табл. 3) [28].
Некоторые АГП могут вызывать развитие аритмий вплоть до жизнеугрожающих форм. «Потенциально кардиотоксичны» терфенадин и астемизол. Из-за способности вызывать потенциально фатальную аритмию – трепетание–мерцание (нарушение метаболизма при болезни печени или на фоне ингибиторов CYP3A4) терфенадин и астемизол запрещены к применению во многих странах, в т.ч. и в России, с 1998 и 1999 гг. соответственно. В отношении существующих в настоящее время АГП имеются предостережения, касающиеся кардиотоксичности уэбастина и рупатадина. Их не рекомендуется применять лицам с удлиненным интервалом QT, а также с гипокалиемией. Кардиотоксичность повышается при одновременном приеме с препаратами, удлиняющими интервал Q-Т: макролидами, противогрибковыми средствами, блокаторами кальциевых каналов, антидепрессантами, фторхинолонами.
Многие АГП метаболизируются в печени с участием цитохрома-P450, в связи с чем не рекомендован их одновременный прием с ингибиторами этого фермента: ряд противогрибковых препаратов (итраконазол, кетоконазол), многие макролиды, некоторые антидепрессанты, циметидин и др. [12]. Печеночному метаболизму не подвергаются цетиризин и левоцетиризин [29], минимально – фексофенадин [30].
По данным токсикологических служб США, АГП первого поколения в 8,3% случаев служат причиной смерти в результате отравления от передозировки среди взрослых. Кроме того, ряд исследований свидетельствует, что не только димедрол, но и другие АГП первого поколения (декстрометорфан, доксиламин, хлорфенирамин и др.), распространенные в США, обнаружены у детей, преимущественно до 12 лет, умерших от различных причин, возможно связанных с передозировкой АГП первого поколения [31, 32].
Применение АГП у детей
Основным показанием к назначению АГП детям служит устранение аллергических симптомов, связанных с высвобождением гистамина, таких как зуд, чихание, ринорея и заложенность носа. Предпочтительны обратные агонисты H1-рецепторов второго поколения без седативного действия или с незначительным подобным эффектом [33]. Показано, что использование АГП второго поколения детьми с аллергическим ринитом не приводит к снижению их школьной успеваемости [34].
Основной путь введения – пероральный, в то время как парентеральный путь, возможный только для некоторых АГП первого поколения (клемастин, хлоропирамин), используется при купировании острых аллергических реакций (крапивница, ангионевротический отек) или для премедикации перед диагностическими и хирургическими вмешательствами [16]. Наружное использование топических форм для интраназального, внутриконъюнктивального и накожного применения АГП первого поколения (табл. 4) предназначено для устранения симптомов аллергии при заболеваниях глаз, ринитах, кожном зуде [33].

Немаловажное значение в педиатрической практике имеют наличие специальных детских лекарственных форм и возраст-разрешенный диапазон применения препаратов. В настоящее время в России ни один АГП второго поколения не разрешен к применению детьми до 6 месяцев. В этой возрастной категории врач может назначать лишь диметинден и хлоропирамин (с 1-го месяца), при этом детская лекарственная форма для перорального применения (капли) есть только у диметиндена. Из других препаратов, использующихся в более старшем возрасте и имеющих детские лекарственные формы, в настоящее время только цетиризин разрешен к применению детьми с 6 месяцев (капли внутрь, применение детьми от 6 до 12 месяцев возможно только по назначению врача под строгим медицинским контролем).
В табл. 5 рассмотрены показания к назначению АГП.

Цетиризин
Особое место среди АГП второго поколения занимает цетиризин. Наряду со всеми преимуществами неседативных АГП цетиризин демонстрирует свойства, выделяющие его из ряда препаратов нового поколения, обеспечивающие его высокие клиническую эффективность и безопасность [46, 47]. В частности, он характеризуется дополнительной противоаллергической активностью, быстрой скоростью наступления эффекта, у него отсутствует опасность взаимодействия с другими лекарственными веществами и продуктами питания, что открывает возможность безопасного назначения препарата пациентам при наличии сопутствующих заболеваний.
Эффект действия цетиризина складывается из влияния на обе фазы аллергического воспаления. Противоаллергический эффект включает т.н. вне-Н1-рецепторное действие: торможение высвобождения лейкотриенов, простагландинов в слизистой оболочке носа, коже, бронхах, стабилизацию мембран тучных клеток, торможение миграции эозинофилов и агрегации тромбоцитов, подавление экспрессии ICAM-1 клетками эпителия [48, 49].
Многие авторы, как зарубежные, так и отечественные, считают цетиризин эталоном современного АГП. Он является одним из наиболее изученных АГП, доказавший свою эффективность и безопасность во множестве клинических исследований. Для пациентов, которые плохо отвечают на другие АГП, рекомендуется именно цетиризин [50]. Он полностью соответствует требованиям, предъявляемым к современным АГП.
Для цетиризина характерны T½ 7–11 часов, длительность эффекта – 24 часа, после курсового лечения эффект сохраняется до 3 суток, при длительном применении (до 110 недель) не наблюдается развития толерантности. Длительность эффекта цетиризина (24 часа) объясняется тем, что эффект АГП определяется не только концентрацией в плазме, но и степенью связывания с белками плазмы крови и рецепторами. Связывание с рецепторами 24 часа у цетиризина около 60%, что превышает данный параметр у других АГП.
Цетиризин практически не метаболизируется в печени и выводится преимущественно почками, поэтому может применяться даже пациентами с нарушениями функции печени, для больных с почечной недостаточностью требуется коррекция дозы препарата.
Одним из важнейших аспектов действия препарата является скорость наступления эффекта (табл. 6). Среди АГП второго поколения самый короткий показатель TСmax (время достижения максимальной концентрации) отмечен у цетиризина и левоцетиризина. Следует отметить, что антигистаминное действие начинает развиваться значительно раньше и является минимальным у АГП, не требующих предварительной активации в печени, например у цетиризина – уже через 20 минут. Максимальная концентрация цетиризина достигается через 1±0,5 часа от приема, в отличие, например, от лоратадина/дезлоратадина, для которых Tmax≈3 часа. Пища снижает общую скорость, но не влияет на полноту всасывания цетиризина. Длительный период полувыведения (T½=10 часов) позволяет применять препарат один раз в сутки. В детском возрасте период полувыведения укорачивается: от 6 месяцев до 2 лет – 3,1 часа; с 2 до 6 лет – 5 часов; с 6 до 12 лет – 6 часов, что требует изменения режима дозирования у детей в соответствии с возрастной фармакодинамикой: суточную дозу целесообразно разделить на 2 приема с целью поддержания оптимальной высокой концентрации препарата в организме [51].

На фармацевтическом рынке Российской Федерации из препаратов цетиризина, помимо оригинального (Зиртек), в настоящее время зарегистрировано более десятка генерических лекарственных средств (дженериков) разных производителей (РЛС, 2020). Однако не все дженерические цетиризины имеют сопоставимую с оригинальной молекулой терапевтическую эффективность и безопасность, доказанные в ходе проведенных клинических исследований. В сравнительном исследовании препаратов цетиризина в каплях показано, что Зодак сопоставим по терапевтической эффективности, переносимости и безопасности оригинальному лекарственному средству Зиртек в купировании симптомов сезонного аллергического ринита у детей [52].
Заключение
H1-АГП часто используются в педиатрической практике для лечения аллергических болезней в соответствии с принципами доказательной медицины, в то время как их применение не по прямому назначению дает противоречивые результаты (табл. 5). Эффективность АГП второго поколения хорошо изучена, и именно они предпочтительнее для использования в педиатрической практике, когда требуется свести к минимуму побочные эффекты. Фармакологические характеристики цетиризина – быстрое начало и продолжительность действия, высокая специфичность к H1-рецепторам, воздействие не только на раннюю, но и на позднюю фазу аллергической реакции немедленного типа, эффективность, безопасность и возможность длительного применения, подтвержденные в многочисленных клинических исследованиях, а также наличие удобной капельной формы, разрешенной к назначения младенцам с 6 месяцев, делают его подходящим препаратом для лечения и профилактики различных аллергических заболеваний у детей.


