Введение
Нарушения речи, афазия – крайне распространенные состояния, которыми может проявляться как сосудистая, так и нейродегенеративная патологии [1]. Из 75 различных состояний и заболеваний, причем как общесоматических, так и неврологических, с включением более 66 тыс. пациентов, афазия оказалась на первом месте среди состояний, влияющих на качество жизни, опережая онкологическую патологию, болезни Альцгеймера и Гентингтона, другие крайне инвалидизирующие заболевания [2]. Постинсультная афазия (ПИА), по разным данным, развивается у 20–40% пациентов, перенесших острое нарушение мозгового кровообращения (ОНМК). Исследования последних нескольких лет свидетельствуют о том, что нарушение речи после инсульта является одним из ключевых предикторов последующей инвалидизации, по некоторым данным, значительно опережая значимость пареза и двигательных нарушений в целом [1]. Ограничение возможности коммуникации, трудности социального взаимодействия служат одним из основных факторов риска развития депрессии, тревоги, апатии, кроме того, нарушение вербального общения может в значительной степени усугублять, а также непосредственно провоцировать когнитивные нарушения и деменцию [3]. Родственники пациентов с ПИА по сравнению с теми, кто ухаживает за пациентами с последствиями инсульта, но без речевого дефекта, имеют более высокую степень депрессии, инвалидизации и в целом характеризуются более низким уровнем качества жизни [4]. Поиск оптимальных стратегий, направленных на восстановление и компенсацию нарушений речи, важен как с медицинской, так и с социальной стороны, поскольку ограничение коммуникации в значительной степени сказывается на уровне жизни не только пациента, но и всей его семьи. В данной статье будет дан обзор возможностей медикаментозной и немедикаментозной терапии пациентов с ПИА и речевыми нарушениями в рамках нейродегенеративной патологии с позиции доказательной медицины, будут обсуждаться возможности комбинации различных методик, а также дальнейшие перспективы их развития.
Постинсультные афазии и тромболитическая терапия
Тромболитическая терапия (ТЛТ) является наиболее эффективным методом лечения инсульта и в значительной степени может способствовать улучшению функционального исхода, уменьшению степени инвалидизации. Данные об эффективности влияния реперфузионной терапии на речевые нарушения вследствие инсульта неоднозначны. По результатам мета-анализа, уменьшение речевых нарушений на фоне ТЛТ отмечено только в первые четверо суток, при этом достоверных различий в отдаленном периоде на фоне ТЛТ и без нее не наблюдалось [5]. Более обнадеживающие результаты получены в 2019 г. На примере 45 пациентов показано, что на фоне проведения ТЛТ достоверно чаще отмечается полный регресс афатических нарушений и при дальнейшем наблюдении за группой, получавшей альтеплазу, частота встречаемости тотальной афазии была достоверно ниже по сравнению с теми, кому по каким-либо причинам тромболизис не был проведен [6]. Однако в этом исследовании «положительный» эффект заключался только в более высоком проценте пациентов с полным регрессом симптомов, при этом если афазия сохранялась, то по степени выраженности нарушений существенных различий получено не было. Многими авторами афазия признается неблагоприятным предиктором, который может предопределять плохой клинический ответ на ТЛТ, причем сила «негативного эффекта» может даже опережать общую тяжесть неврологического дефицита по NIHSS [7]. В целом афазия видится «изолированным» симптомом инсульта, зачастую не связанным и не коррелирующим с выраженностью других проявлений. Так, параллельный регресс двигательных и речевых нарушений на фоне ТЛТ отмечен только у пациентов с относительно легкими речевыми нарушениями, в тех же случаях, когда афазия расценивалась как тяжелая, отмечалась четкая диссоциация: при значительном уменьшении выраженности пареза степень афатических нарушений оставалась очень значимой, несмотря на проведенный тромболизис, и в дальнейшем определяла общую степень инвалидизации [8]. Эффективность ТЛТ при относительно «изолированной» ПИА также была наибольшей именно при легкой и умеренной степенях выраженности речевых нарушений, что даже привело к тому, что авторами работы было предложено проводить реперфузию при балле NIHSS <5, если у пациента ключевым проявлением является афатический дефект [9]. Трудности адекватной оценки эффективности ТЛТ у пациентов с ПИА и неоднозначность результатов исследований, по всей видимости, связаны с высоким процентом спонтанного восстановления речевых нарушений, которое может происходить как при активной терапии, так и в случае плацебо, что в значительной степени затрудняет проведение клинических испытаний. В любом случае пока, по имеющимся данным, явный афатический дефект должен расцениваться как симптом, который может предопределять низкий эффект реперфузионных методик, что вынуждает наиболее активно искать дополнительные возможности его восстановления.
Лекарственная терапия постинсультной афазии
Стимуляция и модуляция работы синапсов как сохранных зон мозга, окружающих очаг как инсульта, так и контрлатерального полушария, служат наиболее реальной «мишенью» для лекарственной терапии, направленной на увеличение реабилитационного потенциала для пациентов с ПИА. Для улучшения синаптической передачи наиболее перспективным видится использование средств, действующих на нейротрасмиттерные системы, а также средств нейротрофического ряда [10, 11].
Дофаминергическая терапия
Применение средств, действующих на дофаминергические системы, было одной из первых попыток улучшить восстановление афатического дефекта после перенесенного инсульта. Идея применения противопаркинсонических препаратов в терапии пациентов с ПИА впервые возникла в связи с тем, что дофаминергическая терапия пациентов с болезнью Паркинсона наряду с уменьшением двигательных нарушений способствовала значительному улучшению речевой функции [12]. Бромокриптин, агонист постсинаптических D2-рецепторов, был первым препаратом, который начал активно изучаться у пациентов с ПИА. На фоне его приема у больных достоверно улучшалась инициация речевой продукции, уменьшалось количество парафазий и пауз на поиск слов, хотя положительные результаты отмечены только у пациентов с транскортикальной, адинамической и умеренною степенью выраженности моторной афазией, при этом эффекта в отношении более тяжелого речевого дефекта и тотальной афазии получить не удалось [13–15]. Наилучших результатов использования бромокриптина удалось добиться при его комбинации с логопедическим тренингом: подобный подход улучшал показатели спонтанной речевой продукции, повторения, письма, а также чтения [16]. В мета-анализе 2018 г. бромокриптин был отмечен как один из препаратов, достоверно улучшающих показатели речевой функции у пациентов с ПИА [17]. Однако эрголиновые агонисты дофаминовых рецепторов сейчас не применяются даже при болезни Паркинсона в связи с их неблагоприятным профилем безопасности. Показатель в 45% досрочного выбывания из исследования вследствие нежелательных явлений, таких как аритмии, припадки и зрительные галлюцинации, полностью ограничил дальнейшие испытания [13, 14]. Поэтому, несмотря на первично показанную эффективность, риск применения бромокриптина не оправдывает ожидаемой пользы.
В качестве альтернативного препарата предложено применение амантадина – антагониста глутаматных рецепторов NMDA-типа, который за счет стимуляции непрямого пути может усиливать дофаминергические влияния. Положительное действие амантадина на функцию речи впервые описано при постгипоксической энцефалопатии с транскортикальной сенсорной афазией [18]. На фоне терапии отмечено достоверное улучшение спонтанной речевой продукции с увеличением беглости речи, что, однако, требовало постоянного приема препарата, и состояние больных возвращалось к исходному уровню на фоне отмены лечения. У пациентов с остро возникшей афазией различной этиологии в открытом исследовании также показано увеличение беглости речи на фоне назначения амантадина, однако гетерогенность выборки, отсутствие подтверждения в крупных рандомизированных исследованих не позволяют сделать окончательный вывод о его эффективности в отношении больных именно с речевыми нарушениями вследствие инсульта [19].
«Золотым» стандартом дофаминергической терапии служит леводопа, интерес к которой у пациентов с инсультом актуален и в настоящее время, о чем можно судить по значительному количеству исследований препарата не только для коррекции афазии, но и в целом для улучшения общего реабилитационного потенциала [20–23]. В плацебо-контролируемом исследовании пациенты, за 30 минут до речевого тренинга получавшие препараты леводопы, по сравнению с плацебо демонстрировали достоверно лучшие показатели речевой активности и способности к повторению фраз [20, 21]. В последующих испытаниях не удалось подтвердить эти данные, что, возможно, связано с неоднородностью включенной в исследование популяции: наряду с ПИА в основную группу были включены пациенты с последствиями черепно-мозговых травм, а также церебрального венозного тромбоза, что могло повлиять на «чистоту» полученных результатов [24]. В 2018 г. по результатам мета-анализа леводопа не была включена в список препаратов с доказанным эффектом на речевую функцию пациентов с ПИА, однако выводы базировались только на одном плацебо-контролируемом исследовании [17]. В целом во многих странах леводопа в настоящее время используется как «премедикация» для улучшения эффекта различных реабилитационных технологий и даже включена в клинические рекомендации некоторых стран, что подчеркивает ее терапевтический потенциал, однако необходимы дальнейшие исследования для подтверждения клинического эффекта на большей и однородной выборке пациентов.
Холинергическая терапия
В экспериментальных моделях показано, что повышение уровня ацетилхолина способствует лучшему восстановлению поврежденной зоны в ЦНС, что обозначило интерес к применению средств холинергического ряда у пациентов с инсультом. Холинергические системы участвуют в реализации памяти, внимания и способности к обучению, что является неотъемлемой частью речевой функции, поэтому ожидаемо, что использование холиномиметиков у пациентов с ПИА может способствовать лучшему восстановлению как когнитивных, так и речевых нарушений [25]. Применение функциональной МРТ позволило выявить более значимое усиление активности слуховой коры при комбинации слуховых стимулов со средствами, увеличивающими уровень ацетилхолина; таким образом, можно предположить, что комбинация логопедического тренинга со средствами холиномиметического ряда может способствовать дополнительной активизации ответственных за речь корковых зон и лучшему восстановлению дефекта [26]. Действительно, применение ингибитора холинэстеразы донепезила у пациентов с хронической ПИА способствовало улучшению показателей спонтанной речи, называния и понимания, что подтверждается как в открытых, так и в рандомизированных плацебо-контролируемых исследованиях [27–29]. Комбинация 10 мг донепезила с логопедическими занятиями в течение 16 недель у пациентов с ПИА даже в позднем восстановительном периоде (где эффективность речевой реабилитации значительно снижается) приводила к достоверному улучшению по сравнению с комбинацией логопедического тренинга с плацебо по всем конечным точкам: оценкам речевой функции с использованием современных шкал, а также способности к коммуникации с более высокими показателями функциональной активности [29]. К сожалению, в большинстве исследований эффект был краткосрочным и нивелировался при дальнейшем наблюдении. Однако мета-анализ 2018 г. с включением более 600 пациентов с ПИА показал достоверное уменьшение на фоне лечения донепезилом общей тяжести афазии с улучшением называния, повторения, слухового восприятия, а также «четкости» речи, что позволяет рекомендовать препарат к применению у пациентов с различными типами афазии [17]. Использование других средств, способных усиливать холинергическую активность, таких как галантамин, ривастигмин, физостигмин, в комбинации с логопедическим тренингом в небольших исследованиях также показало умеренный положительный эффект с лучшим восстановлением афатического дефекта после инсульта даже в хронической стадии по сравнению с плацебо [31–32], хотя результаты систематизированных обзоров не подтвердили их эффективность.
Серотонинергическая терапия
Тесная сопряженность депрессии и речевой функции обозначили поиски возможностей серотонинергической терапии в лечении ПИА. Серотонин улучшает синаптическую пластичность и в целом способствует ускорению корковой реорганизации в ответ на повреждение [33]. Стимуляция выработки нейротрофического фактора в ответ на повышение уровня серотонина, что было неоднократно показано в экспериментальных моделях, способствует лучшему восстановлению зоны инфаркта и как следствие – уменьшает остаточные явления после перенесенного инсульта [34]. Интересно, что именно серотонин рассматривается в качестве основного нейротрансмиттера, способствующего усиленному нейрогенезу в проекции гиппокампа у взрослых, что опять-таки позволяет надеяться на его нейропротекторные свойства и возможность патогенетического действия [11]. Все эти эффекты и легли в основу активных поисков возможности использования селективных ингибиторов обратного захвата серотонина (СИОЗС) у пациентов с речевыми нарушениями после ОНМК [11]. Так, назначение эсциталопрама больным в подострой стадии перенесенного инсульта приводило к достоверному улучшению оценок основных шкал на речевую функцию, причем положительный эффект отмечен вне связи с уменьшением выраженности депрессии [35]. Аналогичные результаты получены и на фоне применения флувоксамина, когда после 4-недельной терапии в основной группе по сравнению с плацебо достоверно улучшалась функция называния и уменьшались персеверации. В последующем данные о положительном действии СИОЗС на восстановление при ПИА были подтверждены еще в нескольких клинических испытаниях [36, 37]. Несмотря на то что в ряде других работ были получены противоречивые результаты, целесообразность применения СИОЗС в настоящее время не вызывает сомнений. Уменьшение депрессии на фоне использования СИОЗС, которая по разным данным отмечается у 30–60% пациентов после инсульта, способствует более активному участию пациента в реабилитации, увеличивая «тропность» к логопедическим занятиям, тем самым дополнительно улучшая прогноз на восстановление [11]. Таким образом, непосредственное участие серотонинергических систем в речевой функции, возможность увеличения реабилитационного потенциала при коррекции аффективных нарушений, а также нейропротекторный потенциал позволяют рассматривать назначение СИОЗС всем пациентам с ПИА.
Средства, действующие на глутаматергические системы
Эксайтотоксичность – гиперактивация глутаматных рецепторов, приводящая к избыточному поступлению кальция в клетку и последующему апоптозу, рассматривается в качестве одной из ведущих концепций гибели нейронов в острую фазу инсульта [38]. Несмотря на то что избыток глутамата может приводить к запуску апоптоза, глутаматергическая передача остается неотъемлемой частью процессов обучения, памяти, формирования поведения, что определяет необходимость поиска средств, способных модулировать активность NMDA-рецепторов: с одной стороны, уменьшая негативные влияния активации внесинаптических терминалей, с другой – поддерживая адекватный уровень синаптической глутаматергической передачи [11]. Мемантин, частичный антагонист глутаматных NMDA-рецепторов, активно изучается как возможный препарат, как раз и обеспечивающий модуляцию глутаматергической нейротрансмиссии. В плацебо-контролируемом исследовании, где препарат назначался в остром периоде инсульта, к концу 4-го месяца терапии отмечена достоверная разница относительно плацебо по основным шкалам, оценивающим речевую функцию, правда, наибольший эффект достигался при комбинации мемантина с логопедическим тренингом [39]. В 2015 г. при использовании вызванных потенциалов в качестве одного из методов объективизации показана более значимая активизация корковых отделов как пораженного, так и непораженного полушария в ответ на назначение мемантина, что коррелировало с улучшением показателей оценочных речевых шкал [40]. Эффект мемантина на ПИА оказался достаточно стойким и сохранялся даже после отмены препарата. В систематизированном обзоре 2018 г. при мета-анализе четырех рандомизированных плацебо-контролируемых исследований обобщение данных позволило показать достоверное улучшение называния, спонтанной речи и повторения на фоне назначения мемантина, правда, без значимого влияния на «понимание», что позволяет рекомендовать мемантин к применению у пациентов с моторной афазией [17].
Ноотропные и нейротрофические препараты
Классическим «ноотропным препаратом» является пирацетам, именно для обозначения его эффектов на интеллектуально-мнестическую сферу в 1972 г. и был введен этот термин. Несмотря на длительную историю применения и массу исследований препарата, на настоящий момент в США пирацетам зарегистрирован исключительно как пищевая добавка, в Европе он рекомендован к применению только в терапии миоклонуса [11]. Ранние исследования, свидетельствующие об уменьшении постинсультных когнитивных нарушений на фоне применения пирацетама, обозначили перспективы его применения и у пациентов с афатическими нарушениями [41]. В ряде исследований действительно удалось получить улучшение речевых показателей при комбинации логопедического тренинга с пирацетамом при сравнении с плацебо. Правда, полученный положительный эффект был нестойким, а исследуемая в данной работе популяция включала пациентов как с инсультом, так и с черепно-мозговой травмой, что не позволяет однозначно трактовать полученные результаты [42]. Систематизированный обзор 2016 г. по использованию пирацетама при ПИА с включением 261 пациента принес противоречивые результаты. На фоне применения препарата достоверно увеличивалась оценка только по разделам, включившим тесты на письменную речь, без существенной разницы по остальным речевым доменам [43]. Таким образом, с учетом краткосрочности эффекта, а также вариабельности клинического ответа к настоящему моменту нет убедительных данных о целесообразности использования пирацетама у пациентов с афатическим дефектом после ОНМК.
В данный момент активно изучается возможность применения средств, действующих на белковый синтез и обладающих нейротрофическими свойствами, у пациентов с ПИА. Так, на фоне интраназального введения пептидного гормона вазопрессина у 50% пациентов было продемонстрировано улучшение как минимум в 3 из 10 оцениваемых речевых параметров [44]. Однако протокол не подразумевал сравнения с контрольной группой и не учитывалась роль логопедического тренинга.
У пациентов с ПИА изучалась эффективность Церебролизина, классического нейротрофического препарата, причем в отличие от вазопрессина исследование проводилось с плацебо-контролируемым дизайном. Пациенты были рандомизированы к приему Церебролизина или плацебо в первые 72 часа после перенесенного инсульта. Средний возраст составил 66±8 лет. В группе активного препарата отмечалось достоверное улучшение показателей спонтанной речи, повторения и называния по сравнению с группой плацебо. Кроме того, авторами отмечено достоверное уменьшение степени инвалидизации по шкале Рэнкин. Доза Церебролизина, примененная в этом протоколе, составила 30 мл в сутки в течение 21 дня [45]. Следует отметить, что, несмотря на высокие дозы, переносимость и безопасность терапии были абсолютно сопоставимыми в основной и контрольной группах. Несмотря на то что дозозависимость от эффекта в этом исследовании не изучалась, адекватность применяемых доз видится важным условием достижения положительного результата и должна учитываться при назначении терапии. Положительный эффект Церебролизина был подтвержден еще в одном рандомизированном исследовании, в котором на фоне введения 20 мл препарата отмечено достоверное уменьшение выраженности афазии по количественной оценке речи по сравнению с группой контроля. Интересно, что в этой работе клиническое улучшение коррелировало с увеличением уровня BDNF, одного из ключевых трофических факторов, участвующих в нейрогенезе и восстановлении поврежденной нервной ткани [46].
Активность трофических факторов и их значимость как прогностических маркеров восстановления активно изучаются в настоящее время. Существуют убедительные данные, свидетельствующие, что генетический полиморфизм BDNF, наследственно-детерминированная его активность могут позволить прогнозировать нейропластичность и возможности восстановления пациентов с инсультом. Так, используя функциональную МРТ, J. Fridriksson et al. (2018) показали, что наличие метионинового окончания в гене BDNF по сравнению с генотипом Val/Val способствует достоверно меньшей активации корковых отделов у пациентов с хронической афазией, что может косвенно говорить о более низкой функциональной перестройке поврежденного участка у лиц с атипичным генетическим полиморфизмом [47, 48]. По всей видимости, генетические предпосылки нейропластичности в дальнейшем будут играть значимую роль как возможные предикторы благоприятного и неблагоприятного исходов после перенесенного инсульта, однако подобных работ к настоящему времени довольно мало. Поэтому еще более оправданным видится использование препаратов, способных дополнительно увеличивать количество нейротрофических факторов, в частности Церебролизина, в комплексной реабилитации пациентов с инсультом. Интересно, что генетический полиморфизм BDNF показан как один из факторов, определяющий степень клинической эффективности транскраниальной стимуляции постоянным током (ТСПТ; немедикаментозный метод, активно использующийся в реабилитации при ПИА, будет обсуждаться далее). В 2018 г. было отмечено, что эффект ТСПТ достоверно лучше у пациентов с val/val-генотипом гена BDNF по сравнению с теми, у кого отмечен val/met-генотип [49]. Поскольку эффект ТСПТ, так же как и ТКМС (транскраниальная магнитная стимуляция), достигается за счет модуляции синаптической передачи и увеличения нейропластичности, уровень BDNF в этом случае может играть определяющую роль в достижении клинического ответа. Таким образом, можно предположить, что назначение ТСПТ и ТКМС параллельно с применением Церебролизина будет оказывать более значимый эффект, однако таких работ к настоящему моменту мы не нашли.
Другие препараты
Неожиданный эффект на афатический дефект был получен в ответ на назначение золпидема – агониста α1-субъединицы ГАМК-рецептора. Так, у пациентов с транскортикальной моторной афазией назначение золпидема приводило к улучшению спонтанной речи и называния. Эффект полностью исчезал при отмене препарата и возвращался при возобновлении его приема. Усиление кровотока в стратегически важных для речевой функции зонах по результатам однофотонной эмиссионной компьютерной томографии еще в большей степени позволяет удостовериться в положительном действии золпидема на речевую функцию, однако механизм пока остается недостаточно понятным [50]. С учетом единичных данных на настоящий момент это скорее удивительная находка, однако, основываясь на полученных положительных результатах, испытания золпидема продолжаются.
Бета-адреноблокатор пропранолол – еще один препарат, активно обсуждаемый как одна из возможных стратегий в терапии пациентов с ПИА. Назначение пропранолола пациентам с моторной и сенсорной ПИА приводило к улучшению называния и речевой активности, однако, данные ограничены единичными клиническими исследованиями [51]. По всей видимости, положительное действие β-адреноблокаторов основано на том, что эта группа препаратов может уменьшать выраженность тревоги и подавлять активность симпатической нервной системы. «Речевая или лингвистическая тревога» представляет собой отдельную форму тревожного расстройства, при котором сам речевой дефект, ожидаемые ошибки и их «видимость» служат непосредственным индуктором негативного аффекта [11, 52]. Перераспределение внимания на эмоциональный ответ приводит к усугублению выраженности речевых нарушений, что требует обязательной коррекции тревожных расстройств у пациентов с афазиями. Наряду с применением антидепрессантов группы СИОЗС пропранолол, по всей видимости, может оказывать дополнительный эффект, чем и объясняются положительные результаты его использования у пациентов с ПИА.
Немедикаментозные методы терапии постинсультной афазии
Речевая (логопедическая) терапия является «золотым» стандартом лечения ПИА и представляет собой комплекс упражнений, направленных на различные аспекты функции речи в зависимости от доминирующего дефекта. Успех речевого тренинга определяют системность, комплексность, а также динамичность нагрузки с учетом различной реакции речевых доменов на терапию, что требует постоянства логопедических занятий как минимум в первые полгода после перенесенной мозговой катастрофы.
Несмотря на то, что речевая терапия показана всем пациентам с ТИА и должна осуществляться на всех этапах реабилитационной помощи, доказательств ее эффективности достаточно мало. Во многом это объясняется отсутствием единого протокола клинических испытаний, вариабельностью методик и гетерогенностью пациентов, а также в принципе отсутствием возможности включения плацебо-группы в исследование.
В 2017 г. были опубликованы результаты работы C. Breitenstein et al., в которой после 3 недель речевой терапии по 10 часов в неделю была показана достоверная положительная динамика показателей речи [53]. Несмотря на то что к настоящему моменту не установлено временного стандарта занятий, систематизированные обзоры демонстрируют прямую зависимость прогноза восстановления от интенсивности тренинга, который должен включать не менее 100 часов логопедической терапии, что, к сожалению, не реализуется даже в развитых странах [11, 54]. Еще одной особенностью являются сроки ожидаемого восстановления. Для проведения речевой реабилитации наиболее значимы первые 3 месяца, когда отклик на проводимую терапию максимальный. Кроме того, в тот же период времени у пациента может отмечаться спонтанное ослабление афатического дефекта вследствие пластичности, а также компенсаторной перестройки зон головного мозга, участвующих в реализации функции речи. В последующем отклик на логопедическую терапию снижается, однако, по некоторым данным, при правильно проводимой реабилитации речевой функции эффект можно получить даже через несколько лет после перенесенного инсульта, что обусловливает необходимость активного внедрения речевой и языковой терапии не только в стационарных, но и в амбулаторных условиях [11, 54].
В последние годы появляется больше возможностей использовать различные современные технологии в речевой реабилитации. Сейчас имеется несколько приложений, которые включают различные речевые тренинги, направленные на уменьшение выраженности афазии и речевой апраксии после инсульта, и могут использоваться даже отдаленно – без привлечения специалиста. Пациентам предъявляются различные изображения и слова на экране, которые он может произносить самостоятельно либо параллельно с голосом, записанным в программе. По данным R. Varley et al., использование компьютерной речевой реабилитации способствовало улучшению показателей речевой функции, причем эффект был прямо пропорционален времени работы с приложением, что требовало регулярных и систематических занятий [55]. Минусом данных программ можно считать отсутствие контроля со стороны за выполнением задания, отсутствие обратной связи, что является огромным минусом по сравнению с занятиями непосредственно с логопедом или афазиологом. С учетом этого недостатка, C. Haldin. et al., в 2017 г. представили результаты терапии пациента с длительными речевыми нарушениями, где они использовали метод сенсомоторной обратной связи в процессе занятий. Наличие видеоряда, который демонстрирует пациенту движение его собственных языка и губ обеспечивало лучший контроль за артикуляцией, и тем самым улучшало произношение. Методами функциональной МРТ было показано, что в процессе данного тренинга происходила усиленная активация слуховой коры, а также «моторных зон языка», что коррелировало с клиническим эффектом. По результатам терапии у пациента улучшились называние, чтение, повторение слов и рифм, увеличилось использование гласных, что говорило об эффективности данного метода реабилитации и возможности более широкого его использования в терапии, однако более крупных исследований этих методик к настоящему моменту нет [56].
Транскраниальная стимуляция постоянным током
ТСПТ – метод физического воздействия на структуры головного мозга слабым электрическим током (не более 1–2 мА). Анодная стимуляция способствует усилению корковой активации, в то время как катодная дает противоположный эффект, что позволяет модулировать активность различных зон участвующих в реализации речевых процессов.
Исследование 2018 г. показало 70%-ную разницу между ТСПТ и плацебо-стимуляцией по улучшению различных показателей речи пациентов с длительно существующей ПИА (в среднем от момента инсульта до включения в исследование прошло 44 месяца). Наибольшего эффекта на фоне ТСПТ удалось достичь у пациентов с моторной афазией, что проявлялось в улучшении артикуляционных движений и показателей произвольной речи [57]. По результатам Кокрейновского обзора 2019 г. с участием 421 пациента, отмечена значимая динамика возможностей называния существительных, причем как в краткосрочный, так и в отдаленный период, правда, мета-анализ не выявил достоверного эффекта в отношении общего функционального исхода на фоне применения ТСПТ [58, 59].
Транскраниальная магнитная стимуляция
В 2013 г. на основании мета-анализа имеющихся данных ТКМС была рекомендована как эффективная методика восстановления речевой функции после инсульта. В 41% проведенных исследований отмечено достоверное уменьшение выраженности афатических нарушений не только в процессе лечения, но и в более отдаленном периоде наблюдения [11]. С учетом безопасности и показанной эффективности в 2013 г. был сделан предварительный вывод о целесообразности использования ТКМС у пациентов с ПИА. Систематизированный обзор 13 исследований (2017) позволил сделать вывод, согласно которому у пациентов с моторными афазиями ТКМС с высокой степенью доказательности может улучшить общий функциональный исход, что с учетом безопасности методики позволяет рекомендовать ее для более широкого применения. Причем низкочастотная ТКМС дает более значимый отсроченный эффект по восстановлению речевой функции при моторной афазии, чем стимуляция с высокой частотой, эффект которой оказался значимым только в краткосрочный период и почти полностью нивелировался при отдаленном наблюдении [60].
В 2020 г. были опубликованы результаты применения ТКМС у пациентов с сенсорной афазией, наименее перспективной в плане эффективности восстановления. На примере 12 пациентов авторы показали, что пульс-стимуляция зоны Вернике пораженного полушария достоверно улучшает способность слухового восприятия и понимания, правда, эффект был очень коротким с полным последующим регрессом [61].
Неоднозначность доказательной базы ТСПТ и ТКМС во многом продиктована ограниченной выборкой пациентов, вариативностью используемых протоколов, а также гетерогенностью больных как по срокам после инсульта, так и по типу афазии. Наибольшего эффекта можно ожидать при использовании ТКМС и ТСПТ как дополнительных методик в комплексной реабилитации в сочетании с речевой и языковой терапией, что позволит улучшить реабилитационный потенциал и возможности нейропластичности.
Другие нефармакологические методы реабилитации речевой функции
Идея использовать музыку как одну из реабилитационных стратегий для устранения афазии при инсульте родилась из-за разной представленности центров речи и музыкального восприятия в головном мозге. Так, если центры, отвечающие за восприятие и реализацию речевой функции у подавляющего большинства людей находятся в левом полушарии, то в восприятие мелодии, реализацию музыкальных способностей чаще вовлечено правое полушарие [62]. Гипотеза строилась на том, что музыкотерапию можно использовать для стимуляции контрлатерального по отношению к очагу полушария, тем самым увеличивая нейропластичность. Мелодико-интонационная терапия основана на попытках облегчить «проговаривание» слов за счет изменения просодики речевого высказывания: удлинения или сокращения гласных звуков, расставления акцентов либо голосом, либо путем отстукивания ритма здоровой рукой [63, 64]. Другим подходом служит пропевание фразы на какую-то знакомую мелодию: за счет дополнительной активации правого полушария, а также включения определенных «автоматических» механизмов это может позволить значительно облегчить артикуляционные трудности [63]. Методами функциональной МРТ установлено, что на фоне мелодико-интонационной терапии происходит двусторонняя активация с более значимым увеличением сигнала от правой лобной области, что говорит о более обширном вовлечении головного мозга в выполнение задачи, способствуя активной функциональной перестройке в обход поврежденного участка [65, 66]. C учетом абсолютной безопасности и показанной эффективности мелодико-интонационная терапия может быть рекомендована к практическому применению.
Кроме того, для улучшения коммуникативных способностей пациентам с тяжелой афазией предлагается более активно осваивать «язык жестов»: это может использоваться, во-первых, как компенсаторная стратегия, во-вторых, как способ дополнительной стимуляции моторной коры. В исследовании C. Vibrac et al. у троих пациентов с тяжелой хронической афазией после трехмесячного просмотра фильмов с участием Чарли Чаплина отмечено увеличение активности общения с сохранением хороших результатов даже в отсроченный период [67]. Более активная интеграция невербальных коммуникаций в восстановлении пациентов с афазиями видится перспективным направлением реабилитации.
Нарушение речи при нейродегенеративных заболеваниях
Нарушение речи при нейродегенеративной патологии представляет собой крайне сложную комплексную проблему, значимость которой явно недооценена. Чаще всего речевые нарушениях при дегенеративной патологии рассматривают в рамках первично прогрессирующей афазии (ППА), где афазия служит первичным облигатным и наиболее инвалидизирующим симптомом [68]. Для диагностики ППА как синдрома необходимо сочетание следующих клинических проявлений: прогрессирующий афатический дефект в течение 2 лет; относительная его «изолированность» (т.е. отсутствие других когнитивных нарушений); первичность речевого дефекта в ограничении повседневной активности и инвалидизации, а также исключение других возможных причин нарушения речи. Среди нозологических форм, которые могут проявляться развитием синдрома ППА, чаще всего рассматриваются лобно-височные дегенерации (ЛВД) и болезнь Альцгеймера.
В рамках ЛВД развиваются две основные формы ППА:
- Аграмматический вариант, который характеризуется «замедленностью» речи, запинками, формированием множественных фонематических парафазий, а также аграмматизмами, которые проявляются как в устной, так и в письменной речи; при этом понимание речи не страдает.
- Семантическая деменция – при которой при относительной сохранности беглости речи отмечаются трудности понимания семантических категорий, сложных речевых конструкций, нарушается «знание» об объектах и предметах. В речи появляются фонемические парафазии: человек может путать слова из одной категории (сын–дочь, холодильник–телевизор и т.д.), заменять их обобщенными понятиями (эти вещи, они и т.д.).
Третья форма ППА – логопеническая; вариант в 75% случаев объясняется патоморфологическими изменениями альцгеймеровского типа и рядом авторов даже признается атипичной (речевой) формой болезни Альцгеймера. Клинически логопеническая ППА характеризуется длинными паузами «поиска слов», нарушением повторения при относительной сохранности понимания и беглости речи [68].
Медикаментозная и немедикаментозная терапия ППА
К сожалению, к настоящему моменту практически не существует убедительных доказательств эффективности какой-либо группы препаратов в лечении пациентов с синдромом ППА.
В тех случаях когда патоморфологической основой развития ППА служит болезнь Альцгеймера, можно надеяться на эффект базисной противодементной терапии, ингибиторов холинэстеразы и мемантина, однако убедительных доказательств нет [69]. По данным систематизированного обзора, у пациентов с ЛВД на фоне назначения мемантина удавалось добиться общего клинического улучшения у пациентов с аграмматической ППА и семантической деменцией, однако динамика по речевым оценкам была весьма умеренной и не достигала степени клинической достоверности [70]. Наиболее перспективным видится применение СИОЗС, особенно с учетом частых поведенческих нарушений, сопутствующей тревоги и депрессии у пациентов с ППА, однако положительный эффект этой группы препаратов показан в ограниченном количестве исследований с включением небольшой группы больных [68, 69]. Нейротрофическое действие, доказанная эффективность при болезни Альцгеймера определили интерес к изучению возможности применения Церебролизина. В экспериментальных моделях показано, что его применение уменьшает гиперфосфорилирование тау-белка – одного из ключевых механизмов ППА в рамках ЛВД, что в итоге способствует замедлению прогрессирования заболевания, однако клинических подтверждений его эффективности к настоящему моменту пока нет [71].
Немедикаментозные методы лечения ППА имеют более убедительную доказательную базу. Было проведено несколько систематизированных обзоров эффективности различных методов когнитивно-лингвистической терапии. В 2019 г. Henry et al. представили результаты применения «каскадной обработки лексического поиска» в отношении пациентов с семантической деменцией и логопедической формой ППА. Идея заключалась в том, что в процессе терапии используются различные лингвистические уровни обработки языка: семантическая оценка, лексический этап, фонемная и морфемная обработки. В ходе всесторонней тренировки авторы показали достоверное улучшение называния как тех предметов, которые использовались в процессе терапии, так и различных объектов в целом, причем положительный эффект сохранялся более 6 месяцев [72]. Систематизированный обзор 25 нерандомизированных исследований когнитивно-лингвистической терапии пациентов с различными формами ППА свидетельствует о хорошем эффекте данного метода для пациентов с аграмматической и логопенической ППА, правда, без существенной динамики показателей речевой функции у лиц с семантической демен-цией [73].
Мета-анализ 7 исследований ТСПТ у пациентов с ППА, опубликованный в 2020 г., показал обнадеживающие результаты. Значимость эффекта равнялась 0,82 (95% доверительный интервал – 0,16–1,47), что было расценено как «значительный эффект», и это позволяет рекомендовать ТСПТ в комплексной терапии ППА, особенно с учетом недостаточной эффективности медикаментозной терапии [74]. По результатам еще одного систематизированного обзора с включением 43 исследований эффективности речевой терапии пациентов с ППА показано, что совместное применение логопедических занятий и ТСПТ может способствовать усилению положительного эффекта. Так, в случае применения только речевой и языковой терапии улучшение называния касалось только тех предметов, которые стали «частью» занятия, при сочетании методик отмечалось общее улучшение называния, в т.ч. и «нетренированных» предметов. Кроме того, сочетанное применение речевого тренинга и ТКМС позволяло добиваться более стойких результатов, сохранившихся и в отдаленный период времени [75].
Сложнее обстоит ситуация в тех случаях, когда речевой дефект развивается не первично, а является частью общего симптомокомплекса нейродегенеративного заболевания. Чаще всего «вторичная афазия» обсуждается в рамках болезни Альцгеймера, будучи одним из критериев диагностики. Однако афазия отмечена при кортико-базальной дегенерации, в части случаев прогрессирующего надъядерного паралича, деменции с тельцами Леви. Даже при болезни Паркинсона, при которой «облигатным» речевым расстройством является дизартрия, все больше публикаций посвящено корковым нарушениям речи, выходящим за пределы исключительно «мышечных» нарушений артикуляции и фонации. В рамках мультисистемного дегенеративного процесса практически не применимы классификации речевых расстройств, используемые при очаговом поражении. Сложности обусловлены тем, что афатический дефект в этих случаях часто комбинируется с различными вариантами дизартрии, в большом проценте случаев у этих пациентов можно встретить апраксию речи, кроме того, свое влияние оказывают когнитивные и двигательные симптомы, которые являются облигатным проявлением большинства дегенеративных процессов. Кроме того, за счет диффузности и многоуровневости поражения можно ожидать вовлечения в патологический процесс различных речевых центров и зон, что еще больше ограничивает выделение «чистых» форм афазии [76]. Недооценка значимости речевых нарушений и частое их «игнорирование» как клинического симптома неминуемо сказываются на качестве жизни пациента, потому что так или иначе это ограничивает возможность общения, нарушает социализацию и оказывает влияние не только на самого больного, но и на его окружение в целом. Отсутствие общепринятой классификации и методологии оценки привело к тому, что практически нет исследований, которые бы изучали возможности медикаментозной и немедикаментозной коррекции вторичных речевых расстройств. Наиболее обсуждаемой в этом плане является болезнь Паркинсона, по крайней мере здесь активно изучается эффект противопаркинсонической терапии и нейрохирургического лечения на речевую функцию, разрабатывается речевая терапия. Несмотря на отсутствие убедительных доказательств эффективности какой-либо группы препаратов, различные варианты немедикаментозной терапии хорошо себя зарекомендовали в коррекции речевых расстройств у пациентов с паркинсонизмом. Чаще всего используется метод голосовой терапии Ли Сильвермана (LSVT LOUD) [77]. Его суть заключается в том, что пациент за счет дополнительного когнитивного контроля может усиливать громкость голоса, как бы преодолевая явления гипокинезии.
Используется либо тренинг, направленный на согласование произношения с дыхательным циклом, что может улучшать фонацию, либо упражнения, направленные на «осознанность» артикуляционных движений, что приводит к дополнительному их контролю. Метод используется в процессе очных занятий, кроме того, разработаны различные приложения для компьютеров и смартфонов, позволяющие проводить терапию отдаленно. Однако необходимо отметить, что речевая терапия при болезни Паркинсона в первую очередь направлена на коррекцию дизартрии, при этом она не учитывает возможных корковых нарушений.
Нами была предложена отдельная классификация речевых нарушений при нейродегенеративных заболеваниях, учитывающая весь возможный спектр расстройств речи, которые могут отмечаться у этой категории больных.
Мы провели комплексную оценку речевой функции с использованием разработанной нами шкалы оценки нарушений речи (в основу которой легла Бостонская шкала афазии) 428 пациентов с различными формами нейродегенеративных заболеваний. Эта группа была отобрана из 1016 пациентов, у которых методом скрининговой оценки был выявлен речевой дефект, выходящий за пределы изолированной дизартрии. Методом многофакторного анализа нам удалось выделить 9 факторов, при которых число степеней свободы (SS) составило 13, Хи-квадрат=5,88, p value=0,951, что позволило сделать следующий вывод: с вероятностью 95,1% наша выборка из 428 пациентов может быть разделена на 9 основных групп. В качестве факторов мы предположили определенный тип нарушений речи, впоследствии обозначенный нами как дисфазия. Таким образом, нарушения речи при нейродегенеративных заболеваниях были разделены на девять подтипов: адинамический, аграмматический, апрактический, диспросодический, семантический, логопенический, аномический, деконструктивный и дизрегуляторный (статья в печати). Сопоставление клинических и нейровизуализационных данных позволило выделить наиболее облигатный для каждого типа дисфазии уровень поражения (см. рисунок).
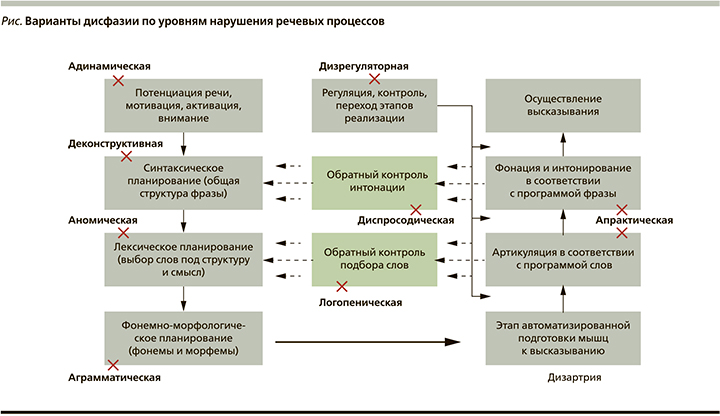
Подобный подход нам видится перспективным в плане дальнейшего более дифференцированного изучения эффективности различных групп препаратов. Кроме того, понимание того, на каком этапе происходит формирование того или иного типа дисфазии: планирования, программирования или реализации, а также уровня нарушений (синтаксический, лексический, фонемно-морфологический) позволит более прицельно разрабатывать программы речевой терапии, совершенствовать подходы когнитивно-лингвистической реабилитации этих пациентов и оптимизировать оказание помощи этим больным.
Заключение
Восстановление нарушений речи как при сосудистых, так и при нейродегенеративных заболеваниях требует комплексного использования не только фармакологических, но и немедикаментозных методов терапии, которые за счет усиления эффекта друг друга могут позволить добиваться наиболее значимой положительной динамики и улучшать качество жизни как самого пациента, так и его окружения.


