Введение
Достижения специалистов фундаментальной медицины последнего столетия позволили детально расшифровать клеточные и молекулярные механизмы, регулирующие процесс кислотопродукции в желудке, а также синтезировать лекарственные препараты, направленные на супрессию продукции соляной кислоты, необходимую для терапии ряда заболеваний [1, 2]. Внедрение в клиническую практику ингибиторов протонной помпы (ИПП) стало значимым этапом в фармакотерапии столь распространенных на сегодняшний день патологий, как гастроэзофагеальная рефлюксная болезнь (ГЭРБ), функциональная диспепсия (ФД), а также язвенная болезнь желудка и двенадцатиперстной кишки [2]. На сегодняшний день ИПП обладают самой большой доказательной базой в рамках терапии вышеназванных заболеваний, которая иллюстрирует их высокую эффективность и безопасность [3].
Эволюция антисекреторной терапии
Эпоха развития антисекреторной терапии начитывает несколько этапов, связанных с применением различных групп фармакологических препаратов (табл. 1) [1].

С целью лечения кислотозависимых заболеваний использовались неселективные и селективные М-холинолитики, H2-блокаторы, а также блокаторы гастриновых CCK-2 (CCK-В) рецепторов [1, 4]. Однако интеграция в клиническую практику в 1980-х гг. ИПП привела к революционному прорыву в лечении ряда заболеваний гастроэнтерологического профиля [4, 5]. Преимуществом ИПП служат быстрое подавление секреции соляной кислоты, отсутствие синдрома «рикошета» после окончания применения препарата, а также независимость от других механизмов (ацетилхолин, гистамин и гастрин), стимулирующих желудочную кислотопродукцию [4, 6]. Помимо этого высокая селективность ИПП в отношении париетальных клеток желудка обусловливает хороший профиль безопасности препаратов этого класса [1, 6].
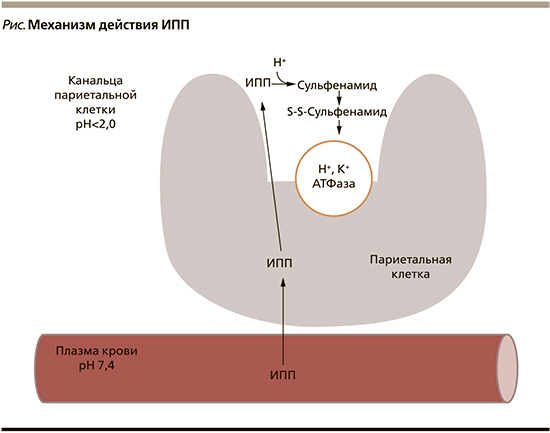
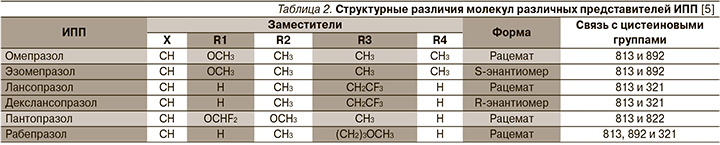
ИПП блокируют функциональную активность Н+-, К+-АТФазы путем взаимодействия с дисульфидными мостиками данного фермента, что в свою очередь приводит к снижению секреции соляной кислоты, как базальной, так и стимулированной [5, 7]. По химической природе все ИПП относятся к слабым основаниям, в этой форме они неактивны, однако, накапливаясь в кислой среде канальцев париетальных клеток, где происходит их протонирование, они преобразуются в активную форму – сульфенамид, блокирующий функцию Н+-, К+-АТФазы (см. рисунок) [4, 8]. По фармакологической структуре все ИПП являются производными бензимидазола, различающимися «надстройками» ядра (табл. 2) [5].
Доказательная база эффективности ИПП
На сегодняшний день ИПП являются «золотым» стандартом фармакотерапии ГЭРБ, что отражено в ряде последних согласительных документов и рекомендаций [9–12]. Главным успехом внедрения ИПП в клиническую практику в рамках лечения ГЭРБ стала достоверная возможность редукции кумулятивного риска развития неопластических изменений у пациентов на стадии пищевода Барретта при длительном применении этих препаратов (относительный риск [ОР]=0,21, 95% доверительный интервал [ДИ] – 0,07–0,66) [13]. В мета-анализе P.W. Weijenborg et al. (2012) терапия ИПП в течение 4 недель приводила к полному купированию изжоги у пациентов как с эрозивной формой заболевания (отношение шансов – ОШ=0,72; 95% ДИ – 0,69–0,74), так и с неэрозивной (ОШ=0,49; 95% ДИ – 0,44–0,55) [14].
Согласно последним рекомендациям, ИПП являются базисными препаратами лечения ФД [15–17]. Так, мета-анализ 7 работ, в общей сложности включивших 3725 пациентов с ФД, продемонстрировал достоверно более высокую результативность применения ИПП по сравнению с плацебо (соответственно 40,3 и 32,7%). При этом показатель NNT (Number Needed to Treat) составил 14,6 (95% ДИ – 8,7–57,1) [18]. Наилучшие результаты достигаются при лечении синдрома эпигастральной боли (фенотип ФД) и при сочетании ФД с ГЭРБ. Последний мета-анализ 16 исследований, опубликованный в 2017 г., также продемонстрировал, что терапия ИПП (курсами от 2 до 8 недель) эффективнее плацебо в рамках регресса симптоматики ФД (ОР=0,88; 95% ДИ – 0,82–0,94) с показателем NNT 13. При этом комбинация ИПП с прокинетиками эффективнее, чем монотерапия ИПП (ОР=0,85; 95% ДИ – 0,68–1,08) [19].
Антисекреторная терапия с применением ИПП – основная тактика лечения язвенной болезни желудка и двенадцатиперстной кишки, а также профилактики ее осложнений [20, 21]. Согласно одному из последних мета-анализов, ИПП достоверно эффективнее плацебо в рамках достижения рубцевания язвенного дефекта (ОШ=5,22; 95% ДИ – 4,00–6,80) и снижения риска повторного кровотечения при осложненном течении заболевания (ОШ=0,57; 95% ДИ – 0,44–0,73) [22]. Важно отметить, что большинство случаев язвенной болезни желудка и двенадцатиперстной кишки ассоциировано с инфекцией Helicobacter pylori, поэтому неотъемлемой частью лечения патологий этой группы является принцип применения эрадикационной терапии [23, 24]. Только такая тактика позволяет избегать рецидива язвенной болезни в долгосрочной перспективе после рубцевания язвенного дефекта [25]. В соответствии со всеми современными рекомендациями ИПП являются неотъемлемым компонентом всех схем эрадикационной терапии, т.к. во многом от адекватной кислотосупрессии зависит эффективность эрадикации H. pylori [24]. Согласно Кокрейновскому обзору и мета-анализу, эрадикационная терапия инфекции H. pylori у инфицированных пациентов снижает риск рецидива язвенной болезни двенадцатиперстной кишки (ОР=0,20; 95% ДИ – 0,15–0,26) и желудка (ОР=0,29; 95% ДИ – 0,20–0,42) по сравнению с плацебо [26]. В другом мета-анализе, обобщившем результаты 5 рандомизированных контролируемых исследований в популяции пациентов с язвенной болезнью, осложненной перфорацией, продемонстрировано, что эрадикационная терапия значительно снижает риск рецидива заболевания в течение года после ушивания дефекта (ОР=1,49; 95% ДИ – 1,10–2,03) [27].
На сегодняшний день ИПП являются препаратом выбора в рамках профилактики и лечения НПВС (нестероидные противовоспалительные средства)-индуцированных эрозивно-язвенных поражений слизистой оболочки желудка [28]. Для профилактики пептических язв при приеме НПВС обычно назначают ИПП длительными курсами, а после исчезновения эндоскопических признаков поражения слизистой оболочки применяется поддерживающая терапия ИПП в половинной дозе длительностью 6 месяцев [29, 30]. В недавнем мета-анализе M. Yang et al. (2017), обобщившем результаты 31 исследования, показано, что ИПП были значительно эффективней, чем плацебо, в снижении риска осложнений НПВС-индуцированных язв (ОШ=0,29; 95% ДИ – 0,20–0,42), а также их формировании (ОШ=0,27; 95% ДИ – 0,22–0,33) [31]. В другом независимом мета-анализе, обобщившем результаты 9 контролируемых исследований популяции пациентов, длительно принимавших аспирин, отмечено, что по сравнению с контролем прием ИПП значимо снижал риск развития язвенных поражений желудка (ОШ=0,24, 95% ДИ – 0,16–0,35), двенадцатиперстной кишки (ОШ=0,12, 95% ДИ – 0,05–0,29], а также ассоциированных кровотечений (ОШ=0,22, 95% ДИ – 0,10–0,51) [32].
Заключение
Таким образом, за последние десятилетия фармакотерапия кислотозависимых заболеваний существенно продвинулась вперед. Эпоха их лечения начитывает несколько этапов, связанных с применением различных групп фармакологических препаратов. Сегодня можно без сомнения сказать, что ИПП занимают передовое место в структуре антисекреторных препаратов и являются «золотым» стандартом терапии таких заболеваний, как ГЭРБ, ФД, язвенная болезнь желудка и двенадцатиперстной кишки.



