Эпидемиология нейроэндокринных опухолей
Нейроэндокринные опухоли (НЭО) часто характеризуют как редкие, однако, по данным США, за последние четыре десятилетия их частота заметно возросла. По данным регистра НЭО, частота встречаемости в США с 1973 по 2012 г. возросла в 6,4 раза: с 1,09 до 6,98 случая на 100 тыс. человек в год. Такой рост числа данного вида опухолей можно объяснить не только реальным ростом заболеваемости НЭО, но и повышенной настороженностью в отношении этих заболеваний и улучшением диагностических тактик, таких как, например, более частое использование эндоскопических методов для скрининга онкологических заболеваний, высокая чувствительность иммуногистохимических и лучевые диагностические методики обследования, а также оптимизация классификации НЭО [1].
В России до сегодняшнего дня нет четких статистических данных по заболеваемости НЭО. Однако с 2012 г. медицинским обществом по лечению НЭО (МОЛНЭО) начат регистр НЭО, в который к 2017 г. были включены 1232 пациента из 20 областей и регионов России.
По данным реестра SEER (Surveillance, Epidemiology, and End Results), в США заболеваемость НЭО на 1 января 2004 г. составила 5,25 случая на 100 тыс. населения. С учетом численности населения в нашей стране ежегодно должно регистрироваться 7350 больных НЭО (население России – 140 млн человек на 2012 г.).
Наиболее частая локализация НЭО (66%) – желудочно-кишечный тракт (ЖКТ); преобладающие места расположения – слепая кишка (17,1%), прямая кишка (16,3%). Около 30% НЭО встречаются в бронхопульмональной системе.
НЭО часто диагностируют на распространенной стадии. Так, по данным SEER, 50% больных на момент установления диагноза уже имеют локорегиональные или отдаленные метастазы [2].
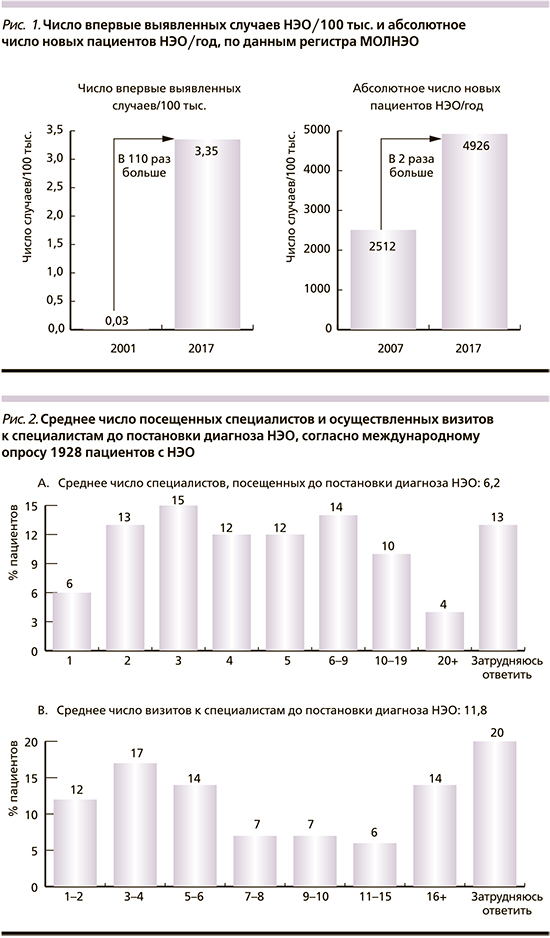
По имеющимся данным регистра МОЛНЭО, ежегодно контингент пациентов, состоящих на учете в онкологических диспансерах и имеющих подтвержденный диагноз «нейроэндокринная опухоль», увеличивался на 7,9%. Всего за период с 2007 по 2017 г. абсолютное число новых пациентов увеличилось на 115,2% (рис. 1) [3].
Вопросы диагностики нейроэндокринных опухолей
Несмотря на возрастающий интерес к проблеме НЭО в мире, проблема диагностики этой категории опухолей остается актуальной.
В 2014 г. в 12 странах, включая страны Европы, Азии и США, был проведен первый масштабный международный опрос пациентов с НЭО для понимания неудовлетворенных потребностей с целью повышения осведомленности о заболевании и его лечении.
Вопросы включали информацию о социодемографии, клинических характеристиках, диагностическом опыте, осведомленности о НЭО. В общей сложности в опросе приняли участие 1928 пациентов с НЭО. Диагноз оказывал отрицательное влияние на личную жизнь и карьеру пациентов. Пациенты рассказали о длительном диагностическом поиске и о том, что среднее время от проявления заболевания до постановки диагноза (по данным опроса пациентов) составило 52 месяца. При этом 29% пациентов потребовалось более 5 лет для постановки правильного диагноза, 58% пациентов на момент постановки диагноза имели метастазы. За это время в среднем пациенты посетили 6,2 специалиста здравоохранения и осуществили 11,8 визита к специалистам (рис. 2) [4].
Этот анализ еще раз подтвердил, что для осуществления своевременной качественной диагностики НЭО необходима полидисциплинарная команда, состоящая из патоморфолога, химиотерапевта, хирурга, радиолога, гастроэнтеролога, генетика, рентгенолога и эндокринолога. И все эти специалисты должны обладать современными знаниями по вопросам диагностики и лечения НЭО.
На последней конференции Европейского общества по нейроэндокринным опухолям (ENETS) в марте 2019 г. были анонсированы результаты создания экспертных центров по диагностике и лечению НЭО. Целью данного проекта было формирование полидисциплинарных команд, что способствовало улучшению диагностики НЭО и увеличению выявляемости таких пациентов, а также повышению качества оказания медицинской помощи. Число пациентов с НЭО, вовлеченных в программу, увеличивается с каждым годом. Всего с 2008 г. в Европе было создано 35 экспертных центров по диагностике НЭО, из них 27 центров – за период с 2014 по 2017 г.
В 2017 г. в программе участвовали 6072 новых пациента с НЭО, в результате направленных к более узким специалистам для решения вопроса о назначении лечения. В рамках программы вовлеченные региональные специалисты имеют возможность участвовать в обучающих мероприятиях и международных клинических исследованиях. Средняя выявляемость пациентов с НЭО в год в экспертных центрах возросла со 102 в 2014 г. до 135 пациентов в 2017-м [5].
Новые клинические рекомендации по диагностике и лечению нейроэндокринных опухолей
В Нижнем Новгороде 17–19 апреля 2019 г. состоялся X Съезд онкологов России. В рамках научной программы значительное внимание было уделено теме НЭО: были рассмотрены изменения в патоморфологической классификации НЭО, нюансы биохимической диагностики и терапии. Отдельное заседание было посвящено представлению проекта новых клинических рекомендаций Минздрава РФ 2019 г. по НЭО.
Новая патоморфологическая классификация НЭО
В новой версии клинических рекомендаций по НЭО, как и в предыдущей от 2017 г., представлена классификация и система градации панкреатических неоплазий ВОЗ.
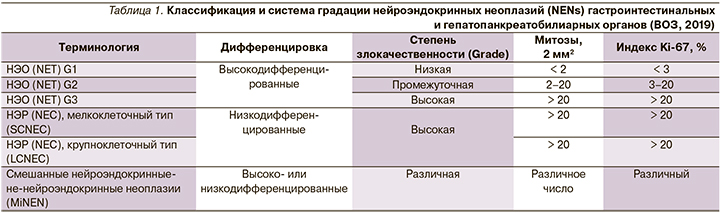
Индекс пролиферации Ki-67 для НЭО G1 поджелудочной железы (ПЖ) определен <3%, введена новая категория высокодифференцированных НЭО G3 с индексом пролиферации Ki-67 более 20%, в низкодифференцированном нейроэндокринном раке (НЭР) G3 выделены мелкоклеточный и крупноклеточный типы (табл. 1). Аналогичным образом будет изменена классификация желудочно-кишечных нейроэндокринных неоплазий, выход которой планируется в 2019 г.
В разделе «Гистологическое и иммуногистохимическое исследование» добавлена информация по диагностическим признакам нейроэндокринной дифференцировки опухоли, включившая органоидную модель роста, мелкогранулярный (salt and pepper) хроматин и экспрессию нескольких ключевых нейроэндокринных маркеров, выявляемую при иммуногистохимическом исследовании. В сложных диагностических случаях при исследовании метастазов без выявленного первичного очага рекомендовано использовать транскрипционные факторы кишечной, легочной и панкреатической дифференцировки (CDX-2, TTF-1, PDX-1).
Ключевым этапом иммуногистохимического исследования НЭО служит определение уровня пролиферативной активности клеток опухоли и/или метастаза с учетом индекса Ki-67, который коррелирует с агрессивностью процесса и важен для оценки лекарственной чувствительности новообразования. Данный показатель важно определять не только в первичной опухоли, но и в процессе опухолевого прогрессирования при повторных биопсиях метастазов в печени. Дополнительные генетические мутационные маркеры помогают при дифференциальной диагностике высокодифференцированных (DAXX/ATAX) и низкодифференцированных (TP53, RB1) НЭН.
Изменения в клинических рекомендациях по биохимической и радионуклидной диагностике
В новых клинических рекомендациях по НЭО Минздрава РФ 2019 г. расширен раздел по биохимической диагностике НЭО. Биохимические маркеры при первичном обследовании позволяют подтверждать заболевание, определять биологическую активность опухоли, выявлять специфические осложнения. Для этих целей используются универсальные маркеры и ассоциированные с гиперфункциональными синдромами специфические маркеры. Универсальные маркеры: хромогранин А (ХгА) в сыворотке крови при всех типах НЭО; панкреатический полипептид (ПП) в плазме крови при НЭО ПЖ; нейроспецифическая енолаза (НСЕ) в сыворотке крови при НЭО легких и тимуса. В соответствии со стандартами диагноз функционирующей опухоли требует обязательного подтверждения гиперфункционального синдрома на основе исследования панели биохимических маркеров НЭО. В табл. 2 представлены обобщенные рекомендации по использованию биохимических маркеров с учетом имеющихся клинических признаков, синдромов и типа НЭО.

На этапе наблюдения и во время лечения рекомендуется анализ следующих биохимических маркеров НЭО: ХгА, НСЕ (НЭО легких и тимуса), ПП (НЭО ПЖ), а также специфических маркеров в зависимости от функциональной активности опухоли: серотонина, 5-ГИУК, гастрина, глюкагона, инсулина, ВИП, соматостатина, кальцитонина, АКТГ, кортизола.
Определение биохимических маркеров, базальные уровни которых были повышены, следует проводить каждые 3 месяца, а также в случае усиления специфической симптоматики, появления новых симптомов или при подозрении на прогрессирование заболевания (рис. 3).
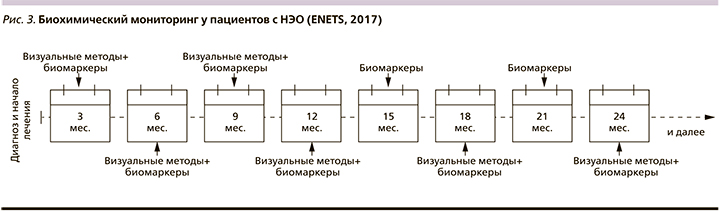
В ряде случаев маркеры НЭО могут служить ранним признаком рецидива или прогрессирования, помогая выявлять изменения за несколько месяцев до появления рентгенологических и клинических признаков. В целом сроки наблюдения зависят от локализации, типа и статуса опухоли. Сокращение интервала между обследованиями рекомендовано при высокой степени злокачественности опухоли, большом размере опухоли, распространенности процесса (поражении печени более 30%, метастазах в легких и костях), агрессивном течении с прогрессированием за последние несколько месяцев, при тяжелых неконтролируемых эндокринных симптомах, потере массы тела, а также при уровнях ХгА, превышающих верхнюю границу нормы более чем в 10 раз.
Пациентам с карциноидным синдромом, с повышенным уровнем серотонина и 5-ГИУК рекомендуется определение предсердного натрийуретического пропептида (pro-BNP) как раннего маркера кардиофиброза, которое должно проводиться ежегодно в целях своевременного выявления карциноидной болезни сердца. Уровень pro-BNP выше порогового служит основанием для назначения эхокардиографического исследования.
В разделе «Радионуклидная диагностика нейроэндокринных опухолей» рекомендованы специфическая визуализация (123I-MIBG, 18F-FDA [6-[18F] флюородопамин]), рецепторная визуализация (111In-октреотид, 68Ga-DOTA-TOC, DOTA-NOC, DOTA-TATE [DOTA конъюгаты рецепторов соматостатина]), другие РФЛП (18F-FDG, 18F-DOPA [18F-фтор-L дигидроксифенилаланин]), а также радионуклидная терапия 131I-MIBG для лечения распространенных злокачественных феохромоцитом, параганглиом и пептидная рецепторная радионуклидная терапия (ППРТ) 90Y-DOTA-TOC; 177Lu-DOTA-TATЕ для терапии неоперабельных и метастатических высокодифференцированных (G1 и G2) НЭО, обладающих гиперэкспрессией рецепторов соматостатина (преимущественно 2-го и 5-го подтипов). Пептидная рецепторная радионуклидная терапия в отдельных ситуациях может применяться в неоадъювантном режиме для достижения операбельности опухолевых очагов.
Лекарственная терапия НЭО: основные изменения в клинических рекомендациях
Основные изменения в лекарственной терапии относительно предыдущей версии клинических рекомендаций по НЭО отражены ниже.
Для терапии высоко- и умереннодифференцированных НЭО (G1-G2, Кi-67 до 20%) рекомендуется применение аналогов соматостатина. При этом рекомендуемая доза ланреотида (Соматулин Аутожель) составляет 120 мг 1 раз в 28 дней, октреотида 20–30 мг 1 разв 28 дней. В случае прогрессирования возможна эскалация дозы аналогов соматостатина путем сокращения интервалов введения до 1 раза в 3 недели (для ланреотида) или повышение дозы до 40–60 мг 1 раз в 28 дней (для октреотида). При прогрессировании опухолевого процесса или непереносимости октреотид может быть заменен на ланреотид, и наоборот.
В качестве таргетной терапии, как и в предыдущей версии клинических рекомендаций, рекомендован эверолимус 10 мг/сут совместно с октреотидом – LAR 30 мг при всех локализациях НЭО и сунитиниб 37,5 мг/сут при НЭО ПЖ совместно с октреотидом – LAR 30 мг. В отсутствие дозировки сунитиниба 37,5 мг (25 мг и 12,5 мг) возможно применение режима 4 недели по 50 мг, 2 недели перерыв.
В качестве химиотерапии при НЭО G2 рекомендуется использовать режимы, не содержащие цисплатин и карбоплатин (табл. 3).
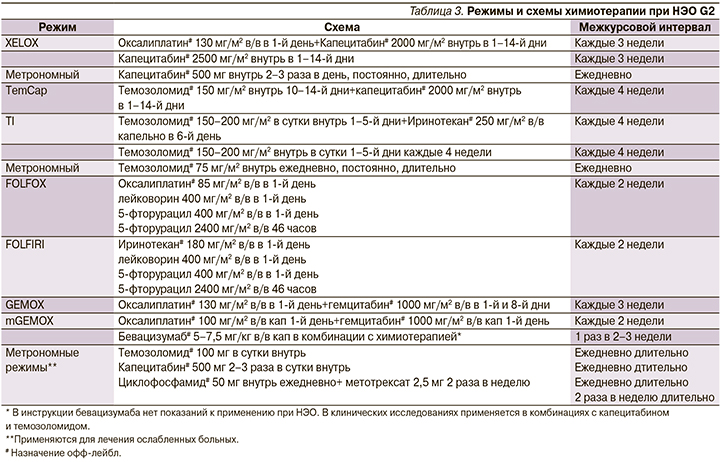
В терапии высокодифференцированных НЭО (G3, Кi-67>20%) аналоги соматостатина пролонгированного действия и интерфероны-α используются для контроля симптомов в дополнение к химиотерапии при наличии карциноидного синдрома и при положительном статусе рецепторов соматостатина 2А- или 5-го типов в опухоли. Используются те же схемы и режимы химиотерапии, как и при НЭО G2 (см. табл. 3), дополнительно могут быть использованы схемы химиотерапии, включающие платиновые производные – цис- и карбоплатин (табл. 4):

Для лечения НЭО G3 c индексом пролиферации Ki-67 более 55% схемы лечения такие же, как при НЭР.
В случае низкодифферецированных НЭР (НЭН NEC) G3 химиотерапия является первой линией терапии, в качестве 2-й и последующих линий могут быть использованы комбинации (см. режимы для G3 НЭО ЖКТ и ПЖ, табл. 5). Аналоги соматостатина пролонгированного действия и интерфероны-α при НЭР G3 используются для контроля симптомов в дополнение к химиотерапии при наличии карциноидного синдрома либо при положительном статуте рецепторов соматостатина 2А или 5-го типа в опухоли.

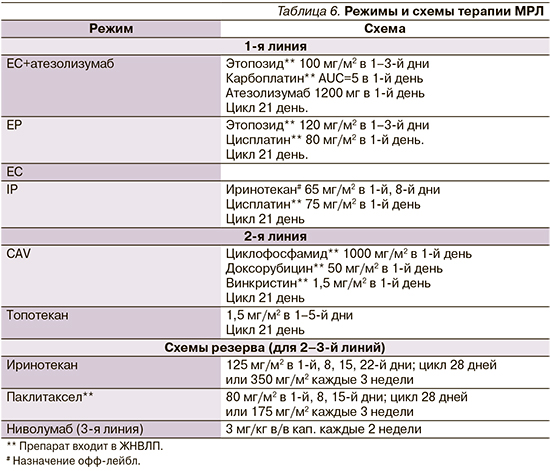
В 2019 г. появилась новая опция терапии для пациентов с мелкоклеточным раком легкого (МРЛ). Она включает добавление к стандарной химиотерапии по схеме EC моноклонального антитела атезолизумаба, который связывается с лигандом рецептора программируемой клеточной смерти 1-PD-L1 и блокирует его, приводя к уменьшению опухолевого роста.
По результатам исследования III фазы IMpower 133 добавление атезолизумаба к химиотерапии привело к значимому увеличению общей выживаемости (ОВ): 12-месячная ОВ составила 51,7% при лечении атезолизумабом и 38,2% – без него; медианы ОВ составили 12,3 и 10,3 месяца соответственно (p=0,0069) [7]. Режим химио- и иммунотерапии показан в качестве предпочтительной 1-й линии химиотерапии МРЛ с дальнейшей поддерживающей терапией атезолизумабом, а для 3-й линии рекомендуется моноиммунотерапия ниволумабом (табл. 6) [8].
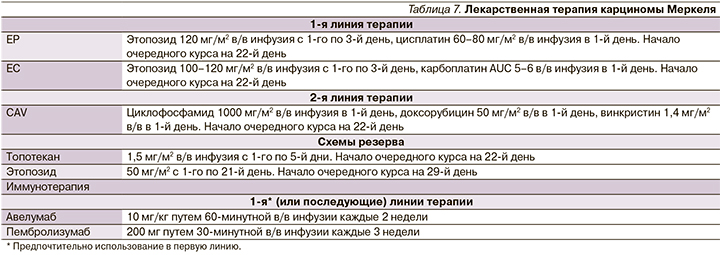
В новых клинических рекомендациях Минздрава РФ по НЭО 2019 г. появились разделы, посвященные лекарственной терапии карциномы Меркеля, феохромоцитомы и медуллярного рака щитовидной железы [6]. Примечательно, что для лечения карциномы Меркеля – высокозлокачественной опухоли кожи – также появилась новая возможность в качестве иммунотерапии моноклональными антителами авелумабом или пембролизумабом (табл. 7).
Для терапии медуллярного рака щитовидной железы с 2011 г. используется таргетный препарат тирозинкиназный ингибитор вандетаниб.
Заключение
Таким образом, в связи со значительным ростом заболеваемости тема НЭО становится с каждым годом все более актуальной. Именно поэтому сейчас так необходимы обновления стандартов и рекомендаций по патоморфологической, биохимической, радионуклидной диагностике и терапии пациентов с НЭО. Для осуществления этой задачи важен шаг создания полидисциплинарных команд в экспертных центрах, специализирующихся на диагностике и лечении НЭО.



