Введение
Рак яичника (РЯ) занимает 7-е место в структуре онкологических заболеваний у женщин и 4-е место среди опухолей репродуктивной системы после рака молочной железы, тела и шейки матки. Несмотря на внедрение современных методов терапии, по-прежнему результаты лечения пациентов остаются неудовлетворительными, РЯ занимает лидирующую позицию по показателям смертности среди онкогинекологической патологии, что в первую очередь обусловлено прогрессированием заболевания. В течение первых двух лет рецидивы диагностируют у 75–80% больных [1–3].
В последние годы научные исследования направлены на индивидуализацию лекарственного лечения на основании выявления молекулярных маркеров – предикторов эффективности терапии. Наследственный РЯ занимает особое место в структуре онкогинекологических заболеваний, характеризуясь уникальной чувствительностью к ряду химиопрепаратов. При инактивации генов BRCA нарушается механизм репарации двуцепочечных разрывов ДНК, что является ключевым событием в развитии хромосомной нестабильности и трансформации клеток, определяющим высокозлокачественный фенотип опухоли. Недостаточные функциональные возможности систем репарации ДНК в клетке опухоли предоставляют универсальное «терапевтическое окно» для лечения платиносодержащими препаратами и другими ДНК-повреждающими агентами.
Выбор схем лекарственной терапии для лечения рецидивов заболевания основывается на продолжительности бесплатинового интервала. Алгоритмы лечения платиночувствительных рецидивов наследственного РЯ аналогичны таковым при спорадической форме заболевания. Однако у больных BRCA-ассоциированным РЯ понятие платинорезистентности (длительность бесплатинового интервала <6 месяцев) неоднозначно, т.к. в этот период опухоль продолжает демонстрировать чувствительность к платиносодержащей химиотерапии (ПСХТ). В исследовании K. Alsop et al. (2012) показано, что 80% пациенток (8 из 10 больных) с рецидивом заболевания в срок <6 месяцев от последнего введения платиносодержащей схемы ответили на ПСХТ [4]. Некоторые авторы рекомендуют продлевать бесплатиновый интервал у пациентов с платинорезистентным рецидивом в классическом значении для повышения чувствительности к препаратам на основе платины в последующее время. Возможной опцией является назначение пегилированного липосомального доксорубицина [5] или еженедельного введения паклитаксела с бевазицумабом или без него на основании данных исследования AURELIA [6, 7].
Паклитаксел является эффективным химиопрепаратом для лечения больных РЯ в первой линии терапии и при рецидивах заболевания. Однако в контексте лечения BRCA-ассоциированного РЯ в некоторых исследованиях показана более низкая чувствительность опухоли к антимикротрубочковым агентам [8–10].
В то же время опубликованы противоположные данные, в которых показано отсутствие влияния носительства мутации в гене BRCA на эффективность терапии паклитакселом. В своей работе К. Leunen et al. (2009) продемонстрировали 100%-ный ответ (75%-ный частичный регресс, 25%-ный полный регресс) на терапию 6 больных РЯ по поводу платиночувствительного рецидива dose-dense-режимом «паклитаксел и карбоплатин» [11].
В исследованиях D.P. Tan et al. (2013) 26 пациенток при рецидиве РЯ получали монотерапию паклитакселом, общий ответ составил 46% (у 12 из 26 пациентов) [12]. Интересно, что объективный ответ на лечение был выше у больных с платиночувствительным рецидивом заболевания (80 против 36%, р=0,04) [12]. Также в исследовании показано, что у больных с платиночувствительным рецидивом время до прогрессирования было значимо выше (42 против 21 недели, р=0,003) [12]. Кроме того, эффект противомикротрубочковых препаратов оказался не зависимым от функции гена BRCA2 [13, 14].
В ретроспективном исследовании, проведенном Т. Safra et al. (2014), не получено статистически значимых различий во времени до прогрессирования после монотерапии паклитакселом у больных BRCA-ассоциированным РЯ по сравнению со спорадической формой заболевания (p=0,572) [15].
В целом данные свидетельствуют о том, что эквивалентная эффективность паклитаксела наблюдалась в обеих группах пациентов независимо от статуса гена BRCA.
В исследовании D.M. Hyman et al. (2011) показано отсутствие ответа на лечение топотеканом, ингибитором топоизомеразы I, у 9 больных РЯ – носителей мутации в гене BRCA в качестве терапии 2-й линии. Авторы исследовали эффективность топотекана при лечении рецидива РЯ у носителей мутации и у пациенток со спорадическим РЯ. Общий ответ в первой группе составил 0%, во второй – 27%. Медиана безрецидивного периода в первой группе составила 1,7 месяца, во второй – 2,5 (p=0,057) [16]. T. Safra et al. (2014) не выявили статистически значимой разницы в выживаемости без прогрессирования (ее медиана составила в группах сравнения 4,0 месяца) у пациенток – носителей мутации в гене BRCA и у пациенток без мутации при терапии топотеканом. Остается неизвестным факт, по какой причине результаты лечения больных BRCA-ассоциированным РЯ ингибиторами топоизомеразы II оказываются выше по сравнению с ингибиторами топоизомеразы I. Возможное объяснение заключается в дополнительном цитотоксическом эффекте при терапии доксорубицином. Кроме ингибирования топоизомеразы II цитостатик интерколлируется в ДНК, приводит к дополнительным двуцепочечным разрывам нитей, подавляет синтез ДНК, повышает образование свободных радикалов в клетке [17]. Дополнительным эффектом пегилированного липосомального доксорубицина является стимуляция Т-клеточного иммунитета, направленного на опухолевую ткань [18].
Митомицин с 1980-х гг. применяли для лечения эпителиального РЯ как в монорежиме, так и в составе комбинированной ХТ. В пилотном исследовании V.М. Moiseyenko et al. (2014) у 12 больных BRCA-ассоциированным РЯ, получавших многочисленные курсы ХТ по поводу рецидивов заболевания, исследована эффективность монотерапии препаратом митомицин. Полный клинический регресс зафиксирован у 1 пациентки (8%), у 2 (17%) – частичный, у 6 (50%) – стабилизация заболевания [19].
В исследованиях показана высокая эффективность ХТ по схеме цисплатин и митомицин в неоадъювантном режиме у больных BRCA1-ассоциированным РЯ [20, 21]. Про-должается поиск эффективных схем лекарственной терапии при прогрессировании РЯ у носителей мутации в гене BRCA1.
Цель настоящей работы: оценка клинической эффективности ПСХТ в комбинации с митомицином при лечении рецидивов BRCA1-ассоциированного РЯ.
Методы
В исследование были включены 12 больных с рецидивом BRCA-ассоциированного РЯ, проходивших лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России в период с 2015 по 2017 г.
Пациентки были тестированы на носительство мутаций в генах BRCA1 с.5266dupC, BRCA1 с.4034delA, BRCA1 с.68_69delAG методом аллель-специфической ПЦР, в отсутствие повторяющихся мутаций выполнено секвенирование экзонов и примыкающих участков интронов гена BRCA1. Мутация BRCA1 c.5266dupC определена у 9/12 (75%) женщин, BRCA1 c.68_69delAG – у 1/12 (8,33%), BRCA1 c.4034delA – у 1/12 (8,33%), BRCA1 c.1961delA – у 1/12 (8,33%).
Средний возраст на момент регистрации рецидива составил 51,8±4,2 года (диапазон от 44 до 59 лет). Согласно классификации FIGO-2014, больные были распределены по стадиям следующим образом: IC-стадия диагностирована у 1/12 (8,33%) пациентки, IIВ – у 1/12 (8,33%), IIIC – у 9/12 (75%), IVB – у 1/12 (8,33%).
Первичный этап лечения 5/12 (41,67%) больных заключался в выполнении циторедуктивной операции с последующей адъювантной химиотерапией, 7/12 (58,33%) больных получили предоперационную ХТ с последующим хирургическим лечением и адъювантной ХТ. У 3/12 (25%) пациенток в анамнезе – комбинированное лечение по поводу первично-множественных опухолей. В среднем больные получили 1,6±1,2 линии ХТ (диапазон от 1 до 5). У 9/12 (75%) больных развился палтиночувствительный рецидив заболевания, у 3/12 (25%) – платинорезистентный. При анализе характера рецидивов канцероматоз брюшины выявлен у 5/12 (41,67%) больных, сочетание канцероматоза брюшины и метастатического поражения печени – у 2/12 (16,67%), сочетание канцероматоза брюшины и метастатического поражения лимфатических узлов – у 1/12 (8,33%), поражение лимфатических узлов – у 3/12 (25%), множественные метастатические очаги в головном мозге и шейном отделе спинного мозга – у 1/12 (8,33%). Общее онкологическое состояние исследуемых пациенток по шкале ВОЗ-ECOG соответствовало 0-й и 1-й степени. Общая характеристика больных представлена в табл. 1.

Пациентки получали ХТ по схеме «МР» – цисплатин (100 мг/м2) и митомицин (10 мг/м2) – каждые 21–28 дней. Препараты вводили на фоне корригирующей терапии, суммарной дозы гидратационной нагрузки 4–4,5 литра. В течение 3 дней после ХТ проводили профилактику высокой эметогенной токсичности. В связи со снижением скорости клубочковой фильтрации <60 мл до начала лечения одна пациентка получила комбинацию карбоплатина (AUC6) с митомицином (10 мг/м2). Клиническую эффективность терапии оценивали в соответствии с критериями RECIST1.1 и GCIG. Токсичность оценивали по шкале NCI CTC AE v.4.0. Очередной цикл ХТ проводили при нормализации показателей клинического и биохимического анализов крови: тромбоциты >100×109/л, лейкоциты >4,0×109/л, креатинин <1,5×ВГН (верхняя граница нормы) мкмоль/л, АЛТ, АСТ, ЩФ, ЛДГ <2,5 ВГН ЕД, билирубин <1,5×ВГН мкмоль/л.
Все пациентки подписали информированное добровольное согласие на участие в исследовании и публикацию данных. Протокол исследования одобрен этическим комитетом ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России (протокол № 15 от 17.12.2015).
Результаты
В зависимости от ответа на проводимую терапию в среднем пациентки получили 6,3±1,4 цикла (диапазон от 5 до 10 циклов) комбинированной ПСХТ с митомицином (табл. 2).
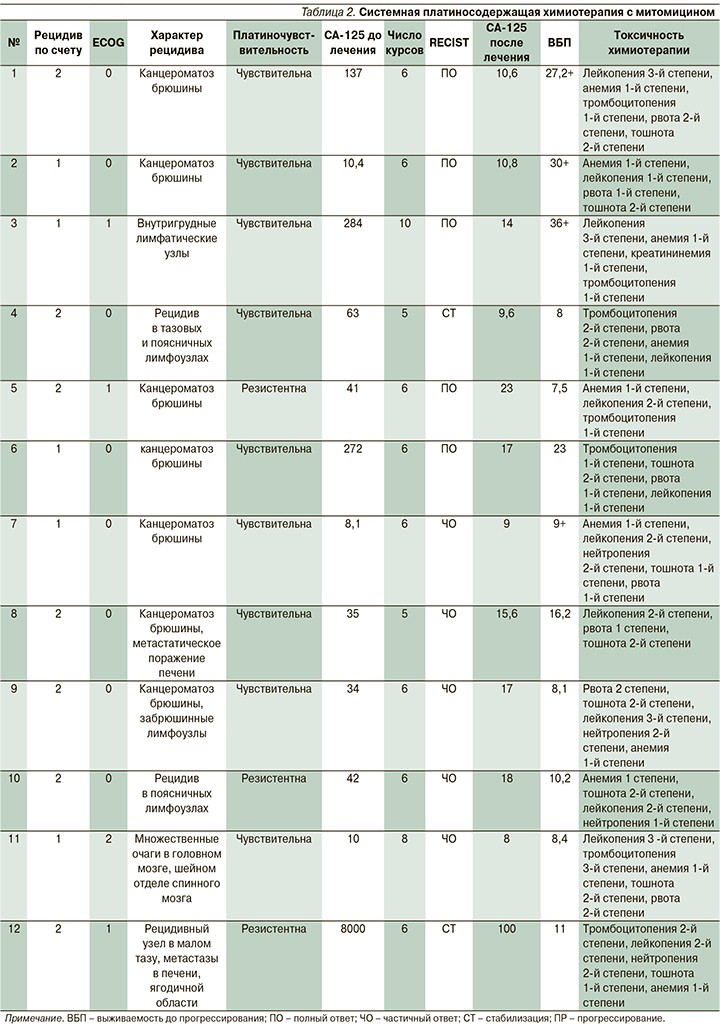
При оценке клинической эффективности терапии объективный ответ зарегистрирован у 12/12 (100%) пациенток, случаев прогрессирования заболевания на фоне лечения не выявлено. Полный клинический регресс наблюдался у 5/12 (41,67%) больных, частичный – у 5/12 (41,67%), стабилизация заболевания – у 2/12 (16,67%) пациенток. У всех больных на фоне лечения наблюдалось снижение уровня онкомаркера СА-125, средний уровень СА-125 после завершения терапии составил 21,05±25,2 ЕД/мл (диапазон от 8 до 100 Ед/мл).
Проанализированы показатели выживаемости до прогрессирования. Медиана наблюдения за больными составила 9,3 месяца (диапазон от 7,5 до 36 месяцев). Медиана выживаемости без прогрессирования составила 11,5 месяцев.
Токсичность 3–4-й степеней, согласно критериям NCI CТC, наблюдалась у 4/12 (33,33%) больных. У 1/12 (8%) больной развилась тромбоцитопения 3-й степени. Применение гранулоцитарно-макрофагального колониестимулирующего фактора потребовалось 4/12 (33,33%) пациенткам в связи с развитием лейкопении 3-й и нейтропении 4-й степеней.
Обсуждение
В настоящее время доклинические и клинические исследования ясно указывают на то, что генетический фон приобретает новую роль в индивидуализации лечения больных РЯ.
Ретроспективные исследования демонстрируют более высокие показатели клинической эффективности, улучшенный прогноз заболевания при применении платиносодержащих схем терапии у больных BRCA-ассоциированным РЯ. Исследование новых схем ХТ является перспективным направлением для повышения показателей выживаемости больных.
Результаты исследования демонстрируют высокую эффективность ПСХТ с митомицином для лечения больных с рецидивом BRCA1-ассоциированного РЯ и в то же время приемлемый уровень токсичности. Изучаемая комбинация цитостатиков показала эффективность для лечения больных как с платиночувствительным рецидивом, так и с платинорезистентным. При оценке клинической эффективности терапии объективный ответ зарегистрирован у всех пациенток, включенных в исследование; случаев прогрессирования заболевания на фоне лечения не выявлено. У всех больных наблюдалось снижение уровня онкомаркера Са-125. Медиана выживаемости без прогрессирования составила 11,5 месяцев. Согласно критериям NCI CТC, токсичность 3–4-й степеней наблюдалась в 33,33% случаев.
Результаты исследования могут служить основанием для планирования рандомизированного проспективного исследования по изучению эффективности и токсичности комбинированной ПСХТ с митомицином при рецидивах BRCA1-ассоциированных РЯ для получения данных с более высоким уровнем доказательности и последующей индивидуализацией лечения.
Заключение
В литературе представлены разрозненные данные об эффективности схем лекарственной терапии при рецидивах наследственного РЯ, что обусловлено недостаточным объемом данных, редкостью встречаемой патологии. Выбор оптимальной схемы лекарственной терапии рецидивов BRCA1-ассоциированного рака яичника остается актуальной задачей современной клинической онкологии.
Результаты нашего исследования демонстрируют эффективность сочетания платиновых дуплетов с митомицином для лечения рецидивов BRCA1-ассоциированного РЯ.
Научные данные свидетельствуют, что «генетический портрет» опухоли имеет предиктивное значение в определении чувствительности к лекарственной терапии.



