Введение
Диссеминированный тройной негативный рак молочной железы (РМЖ) остается наиболее прогностически неблагоприятным вариантом. В то время как современная терапия с включением различных анти-HER2-препаратов при метастатическом HER2-положительном подтипе позволяет сегодня обеспечить медиану продолжительности жизни, близкую к 5 годам, при тройном негативном подтипе данный показатель не превышает 1,5 лет. Основным методом лечения диссеминированного тройного негативного РМЖ остается химиотерапия, и, к сожалению, эффективность каждой последующей линии терапии стремительно снижается. Так, медиана длительности 1-й линии терапии составляет 12 недель, 2-й линии – 9 недель и всего 4 недели – 3-й линии терапии [1]. В то время как стандартом лечения других подтипов РМЖ является последовательная монохимиотерапия, при симптомном быстропрогрессирующем тройном негативном РМЖ стоит думать об использовании комбинации химиопрепаратов. На первых этапах лечения традиционно используются комбинации на основе таксанов и антрациклинов. Перечень препаратов для последующих линий представляет собой ограниченный набор цитотоксических агентов, включающий гемцитабин, препараты платины, капецитабин, эрибулин. Таким образом, остро стоит вопрос о поиске новых эффективных препаратов и комбинаций.
В последнее десятилетие появился новый класс препаратов – эпотилоны, представителем которого является иксабепилон. Механизм действия препаратов данного класса состоит в стабилизации микротрубочек, что приводит к нарушению клеточного деления и как следствие – апоптозу опухолевых клеток. В исследованиях на клеточных линиях РМЖ, резистентных к таксанам и антрациклинам, было показано, что молекула иксабепилона в меньшей степени подвержена выведению из опухолевой клетки при помощи Р-гликопротеина и других механизмов обратного транспорта.
В исследовании II фазы было показано, что при применении монотерапии иксабепилоном (40 мг/м2, 21-дневный курс) у пациенток с резистентностью к терапии таксанами и антрациклинами частота объективных ответов составила 11,5% [2]. При добавлении иксабепилона к капецитабину частота объективных ответов составила 34,7% по сравнению с 14,3% для монотерапии капецитабином. Комбинация капецитабина и иксабепилона, согласно результатам исследования III фазы, позволяет увеличить медиану времени до прогрессирования (ВДП) до 5,8 месяца по сравнению с 4,2 месяца для терапии капецитабином в монорежиме (р=0,0003) [3]. При исследовании данной комбинации у пациенток с тройными негативными опухолями молочной железы, резистентными к терапии таксанами и антрациклинами, также было показано преимущество комбинации капецитабина и иксабепилона по сравнении с монотерапией капецитабином: медианы ВДП составили 4,2 и 1,7 месяца соответственно [4].
Применение комбинации иксабепилона и капецитабина характеризовалось приемлемым и управляемым профилем токсичности. Наиболее распространенным осложнением была сенсорная полинейропатия (67%), при этом частота сенсорной полинейропатии 3–4-й ст. не превысила 21%, что сопоставимо с аналогичным показателем на фоне терапии наб-паклитакселом или еженедельной терапии паклитакселом. Медиана времени до разрешения выраженности симптомов полинейропатии до 1-й ст. составила 6 недель на фоне редукции дозы иксабепилона на 20%. В работе V. Valero et al. на материале двух исследований III фазы была оценена эффективность терапии иксабепилоном в редуцированной дозе. Было показано, что редукция дозы иксабепилона на 20% в течение первых четырех курсов терапии не приводит к снижению частоты объективных ответов либо снижению медианы ВДП по сравнению с проведением терапии в полных дозах, либо редукции доз после четырех курсов терапии [5].
В спектре негематологической токсичности отмечалось развитие миалгии (33%), артралгии (20%) и астении (24%). Частота случаев ладонно-подошвенного синдрома для комбинации препаратов существенно не отличалась от таковой в группе монотерапии капецитабином (64%) [2].
Мы представляем собственные результаты применения иксабепилона в режимах комбинированной химиотерапии в реальной клинической практике.
Методы
С ноября 2018 по июль 2019 г. терапия иксабепилоном была проведена 13 пациенткам с диссеминированным тройным негативным РМЖ после прогрессирования на фоне терапии таксанами и антрациклинами. Медиана возраста составила 50 (37–56) лет. В 11 случаях проводилась терапия по схеме иксабепилон 40 мг/м2 в/в капельно 1 раз в 21 день+капецитабин 2000 мг/м2/сут. внутрь в 1–14-й дни 21 дневного цикла. Двум пациенткам, которые ранее получали терапию капецитабином по поводу метастатического РМЖ, проводилась терапия по схеме: иксабепилон 25 мг/м2 в/в в 1-й и 8-й дни+ карбоплатин в/в в 1-й день 21-дневного цикла терапии.
Проведение терапии иксабепилоном не требует премедикации HT3-антагонистами и дексаметазоном. Препарат вводится в виде 3-часовой инфузии с использованием флаконов и инфузионной системы без содержания ПВХ. За 30 минут до начала инфузии проводится премедикация Н1- и H2-блокаторами. Перед введением раствора иксабепилона требуется подготовка инфузионного раствора: рН раствора должен находиться в диапазоне от 6,0 до 9,0.
Характеристика группы больных, получавших терапию с включением иксабепилона, представлена в табл. 1. Медиана количества линий терапии, проведенных ранее по поводу метастатической болезни, составила 1 (1–4). Всем пациенткам ранее была проведена таксан-содержащая химиотерапия по поводу метастатической болезни, в 12 случаях пациенткам ранее была проведена терапия с включением антрациклинов.

Все больные на момент начала лечения находились в удовлетворительном общем состоянии (ECOG 0 – 1).
Ни у одной из пациенток не было зафиксировано неврологических симптомов перед началом лечения, исследование головного мозга перед началом терапии рутинно не проводилось. Лечение проводилось до прогрессирования заболевания или достижения непереносимой токсичности.
Результаты
В общей сложности 13 больным было проведено 65 курсов химиотерапии. Медиана количества курсов терапии составила 6 (2–8). Частота объективных ответов составила 53,8% (7/13). Медиана ВДП во всей группе больных составила 4,1 месяца (1,5–9,8 месяца). Причиной завершения терапии послужили прогрессирование заболевания – 61,5% (8/13), а также развитие дозолимитирующей полинейропатии – 21,3% (3/13). Две пациентки в настоящее время находятся в процессе терапии иксабепилоном и капецитабином и получили 6 и 7 курсов терапии соответственно с нарастающей частичной регрессией.
Из 3 пациенток, которым терапия иксабепилоном была прекращена досрочно в связи с полинейропатией, ни у одной не было выявлено признаков прогрессирования в течение 3 месяцев после завершения терапии. Одной пациентке была продолжена монотерапия капецитабином.
Частота редукции дозы иксабепилона составила 53,8% (7/13), доза иксабепилона была редуцирована в связи с дозолимитирующей гематологической токсичностью – 1 случай тромбоцитопении 3-й ст., 2 случая нейтропении 3-й ст.; в 4 случаях редукция дозы была связана с прогрессированием полинейропатии. Частота редукции дозы капецитабина в связи с кожной токсичностью и кардиалгией составила 30,8% (4/13). В трех случаях редукция дозы иксабепилона была проведена после 1 курса терапии, при этом, несмотря на редукцию дозы препарата, у данных пациенток наблюдался объективный ответ.
Наиболее распространенным видом гематологической токсичности являлась нейтропения – все степени 76,9% (10/13), нейтропения 3-й ст. – 53,8% (7/13) случаев. Несмотря на высокую частоту глубокой нейтропении, нами был зафиксирован только один случай фебрильной нейтропении. Частота тромбоцитопении составила 30,8% (4/13), тромбоцитопения 3–4-й ст. была выявлена в 21,3% (3/13) случаев. Важно заметить, что в двух из трех случаев тромбоцитопения 3–4-й ст. развилась у пациенток, получавших комбинацию иксабепилона и карбоплатина, и вероятнее всего, была связана с введением карбоплатина (табл. 2).
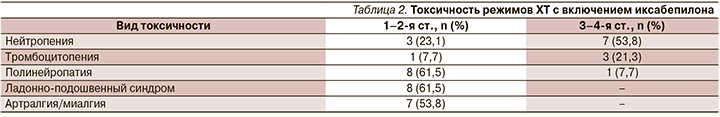
Среди негематологической токсичности наиболее часто отмечалось развитие полинейропатии – 69,3% (9/13). При этом в одном случае проявления полинейропатии достигли 3-й ст., а в трех случаях симптомы полинейропатии послужили причиной досрочного завершения терапии иксабепилоном. В четырех случаях развитие полинейропатии потребовало редукции дозы иксабепилона на 20%, после чего во всех случаях было отмечено замедление прогрессирования полинейропатии (табл. 2).
В 61,5% (8/13) случаев лечение осложнилось развитием артралгии и миалгии 1–2-й ст. В двух случаях терапия сопровождалась развитием тошноты 2-й ст. и рвоты 1-й ст. В 53,8% случаев отмечено развитие ладонно-подошвенного синдрома, более вероятно связанного с терапией капецитабином. В одном случае отмечено развитие ладонно-подошвенного синдрома 3-й ст., что потребовало отмены капецитабина. У двух пациенток отмечено развитие кардиалгии 2-й ст. на фоне приема капецитабина (табл. 2).
Обсуждение
Нами представлены первые результаты применения комбинаций на основе иксабепилона при диссеминированном тройном негативном РМЖ после прогрессирования на фоне терапии таксанами и антрациклинами. Помимо известной по исследованиям III фазы комбинации иксабепилона и капецитабина нами описан опыт применения комбинации иксабепилона и карбоплатина, которая была назначена больным, получавшим ранее терапию капецитабином по поводу метастатического процесса.
Медиана ВДП в реальной клинической практике нашего центра оказалась сопоставимой с таковой в крупных исследованиях, посвященных изучению эффективности иксабепилона при тройном негативном РМЖ. При этом частота объективных ответов оказалась значительно выше, чем в исследовании E.A. Perez et al., и составила 53,8% по сравнении с 31%, что может быть объяснено малым размером выборки, а также тем, что половина пациенток ранее получали только одну линию терапии [4].
Токсичность комбинации капецитабина и иксабепилона в нашей популяции больных оказалась сопоставимой с таковой в исследованиях III фазы. Важно отметить, что у пациенток, которым была проведена редукции дозы иксабепилона на 1-дозовый уровень, сохранялись объективные ответы при дальнейших контрольных обследованиях. Кроме того, у пациенток, у которых доза иксабепилона была редуцирована в связи с развитием полинейропатии, дальнейшего усугубления явлений полинейропатии отмечено не было.
Комбинация иксабепилона и карбоплатина характеризовалась высокой гематологической токсичностью: у 2 пациенток было отмечено развитие нейтропении 3–4-й ст., а также тромбоцитопении 3–4-й ст., что обусловлено в большей степени применением карбоплатина. У пациенток, получавших данную комбинацию, не было зафиксировано объективных ответов, что может быть связано с задержками лечения в связи с токсичностью, а также с тем, что данный вариант терапии проводился более предлеченным больных.
Заключение
На основании результатов применения иксабепилона в реальной клинической практике можно сделать вывод о сравнительно высокой эффективности комбинаций на его основе в прогностически неблагоприятной группе больных диссеминированным тройным негативным РМЖ после прогрессирования на фоне терапии таксанами и антрациклинами. Описанные комбинации терапии характеризуются приемлемым и управляемым профилем токсичности.


