Введение
Бронхиальная астма (БА) относится к одному из самых распространенных хронических заболеваний человека, ее распространенность варьируется от 1 до 18% популяции в зависимости от региона мира [1]. БА может развиться в любом возрасте, но чаще – у детей и подростков, особенно в случае аллергической астмы. Степень тяжести течения заболевания не зависит от пола или возраста пациентов, и абсолютное большинство имеют благополучное течение БА в результате традиционной фармакотерапии при условии соблюдения оптимальной приверженности лечению и адекватной техники ингаляции. Однако 3–10% больных имеют тяжелую БА [1–3]. Для этих пациентов унифицированный принцип лечения не приносит должной пользы. Они, как правило, рефрактерны к традиционной терапии, у них отмечается высокая частота обострений БА, незапланированных визитов к врачу и обращений за неотложной медицинской помощью, госпитализаций. Именно тяжелая БА поглощает 50% всех экономических затрат, предназначенных на заболевание в целом [1–3].
Долгое время для этих пациентов единственной возможностью было применение пероральных глюкокортикостероидов (ГКС) для поддерживающей терапии и избегания обострений БА. Однако в настоящее время ситуация кардинальным образом изменилась, ибо появились генно-инженерные биологические препараты (ГИБП) для лечения тяжелой БА. В настоящее время в мире, в т.ч. в нашей стране уже зарегистрировано пять ГИБП для лечения тяжелой БА: омализумаб, меполизумаб, реслизумаб, бенрализумаб и дупилумаб. Однако применение этих таргетных препаратов требует строгого отбора пациентов, чтобы получить оптимальный ответ на лечение.
Омализумаб, представляющий собой гуманизированное рекомбинантное моноклональное антитело к иммуноглобулину E (IgE), является первым зарегистрированным представителем этого нового класса препаратов для лечения БА. В настоящее время в мире накоплен большой опыт применения омализумаба в реальной клинической практике [4–6]. Препарат зарегистрирован в 90 странах и более 12 лет назначается для лечения больных тяжелой неконтролируемой аллергической БА, имеются публикации о его эффективности и безопасности при длительном применении в течение 9 лет [7]. В настоящее время в мире более 200 тыс. пациентов лечатся омализумабом. Большинство пациентов получают данную терапию в амбулаторных условиях. Следует отметить, что в лечебных учреждениях России лечение омализумабом получили в общей сложности около 1000 пациентов с тяжелой атопической БА, однако по-прежнему локальный клинический опыт использования препарата вызывает интерес. Настоящая статья посвящена опыту применения омализумаба двумя молодыми пациентами с тяжелой аллергической БА.
БА – гетерогенное заболевание в отношении фенотипов и эндотипов. Эксперты Российского респираторного общества (РРО) и Российской ассоциации аллергологов и клинических иммунологов (РААКИ), так же как и эксперты GINA (Global Initiative for Asthma), выделяют следующие основные фенотипы БА [1, 8]:
Аллергическая БА – наиболее легко распознаваемый фенотип, при котором БА обычно начинается в детстве, связана с наличием других аллергических заболеваний (атопический дерматит, аллергический ринит, пищевая аллергия) у пациента или родственников. Для этого фенотипа характерно эозинофильное воспаление дыхательных путей. Пациенты с аллергической БА обычно хорошо отвечают на терапию ингаляционными ГКС (ИГКС).
Неаллергическая БА встречается у взрослых, не связана с аллергией. Профиль воспаления дыхательных путей у больных БА с данным фенотипом может быть эозинофильным, нейтрофильным, смешанным или малогранулоцитарным. В зависимости от характера воспаления пациенты с неаллергической астмой могут не отвечать на терапию ИГКС.
БА с поздним дебютом – у некоторых пациентов, особенно у женщин, астма развивается впервые уже во взрослом возрасте. Эти больные чаще не имеют аллергии и, как правило, являются относительно рефрактерными к терапии ГКС или им требуются более высокие дозы ИГКС.
БА с фиксированной обструкцией дыхательных путей – у некоторых пациентов с длительным анамнезом БА, по-видимому, вследствие ремоделирования бронхиальной стенки развивается фиксированная обструкция дыхательных путей.
БА у лиц с ожирением – пациенты с ожирением и БА часто имеют выраженные респираторные симптомы, не связанные с эозинофильным воспалением.
Трудная для лечения БА – это астма, которая не контролируется, несмотря на лечение на ступенях 4 или 5 по GINA (например, ИГКС в средней или высокой дозе со вторым контроллером – ДДБА [длительно действующие β2-агонисты] или АЛТР [антагонисты лейкотриеновых рецепторов], поддерживающая терапия пероральными ГКС), или для которой требуется такое лечение для поддержания хорошего контроля симптомов и уменьшения риска обострений. Во многих случаях БА может быть трудной для лечения из-за модифицируемых факторов, таких как неправильная техника ингаляции, плохая приверженность лечению, курение или сопутствующие заболевания, или из-за неправильного диагноза.
Тяжелая БА (ТБА) входит в подгруппу трудноподдающейся лечению астмы и является астмой, которая остается неконтролируемои, несмотря на приверженность максимально оптимизированной терапии и лечению сопутствующих заболевании, или ухудшается, когда высокие дозы ГКС уменьшаются. Бóльшая часть больных ТБА относятся к T2-эндотипу БА и имеют эозинофильное воспаление в слизистой оболочке нижних дыхательных путей, в формировании которого участвуют Th2-лимфоциты (преимущественно при аллергической БА, обусловленной специфическими IgE) и врожденные лимфоидные клетки 2-го типа (ILC2), генерирующие цитокины Т2-профиля: интерлейкин-4 (ИЛ-4), -5, -13.
ТБА также гетерогенна, и идентификация фенотипов БА с помощью кластерного анализа, проведенная в ряде исследований, позволяет выделить несколько фенотипов ТБА [9–11], например:
- ранняя атопическая БА, характеризующаяся тяжелым течением изначально;
- поздняя БА с выраженным эозинофильным воспалением и высоким риском развития тяжелых обострений;
- поздняя БА, ассоциированная с ожирением.
Как свидетельствуют исследования, бóльшая часть больных ТБА относятся к аллергическому фенотипу. Так, по данным отечественных исследователей, у 77% больных ТБА присутствует фенотип атопической БА, ассоциированный с эозинофильным воспалением дыхательных путей [12]. Пациенты с аллергическим фенотипом БА часто встречаются в клинической практике. Как правило, это люди трудоспособного, социально активного возраста, и таким пациентам с помощью современных методов терапии можно дать шанс на восстановление контроля заболевания.
Роль IgE и анти-IgE при аллергической БА
При аллергическом фенотипе БА ключевую роль в реализации воспаления и ремоделировании бронхов играют антитела класса IgE. Наследственная предрасположенность к атопии, складывающаяся из участия более 50 генов и воздействия факторов внешней среды (аллергены, аэрополлютанты, вирусы), приводит к девиации иммунного ответа в сторону преобладания Тh2-ответа и гиперпродукции IgE-антител против известных и возможно неизвестных аэроаллергенов. Аллерген-специфические IgE-антитела фиксируются на высокоаффинных (FcεRI) рецепторах к ним, расположенных на тучных клетках слизистой оболочки дыхательных путей, приводя к сенсибилизации. Последующий контакт и перекрестное связывание двух фиксированных на клетке молекул IgE с аллергеном запускают аллергическую реакцию, характеризующуюся ранней (секреция гистамина, триптазы, кининов; образование и высвобождение простагландинов и лейкотриенов) и поздней (привлечение в зону воспаления эозинофилов, лимфоцитов, нейтрофилов) фазами ответа, опосредующей в конечном итоге всю гамму воспалительных изменений в нижних дыхательных путях, что приводит к формированию бронхиальной гиперреактивности [13]. IgE-антитела не только запускают и поддерживают воспаление в слизистой оболочке дыхательных путей, но и участвуют в ремоделировании бронхиальной стенки при БА. IgE дозозависимо повышает депозицию экстрацеллюлярного матрикса (ЭЦМ) и общего коллагена (особенно значимо коллагена I и III типов), что было продемонстрировано на гладкомышечных клетках, выделенных из биопсийного материала стенки бронхов больных БА, по сравнению с контролем (здоровые субъекты) [14]. При этом предварительная (30 минут) обработка клеток анти-IgE-антителами (омализумаб) предотвращала депозицию ЭЦМ и коллагена [14].
IgE имеет самый короткий период полужизни (в свободном состоянии около 2,5 дней) и самое низкое содержание в крови. Пределы концентраций IgE в сыворотке крови здоровых лиц варьируются от 0 до 100 МЕ/мл. IgE, связываясь с высокоаффинными рецепторами на тучных клетках, базофилах, клетках Лангерганса, может персистировать в течение нескольких месяцев. Он регулирует экспрессию FcεRI на клетках: высокий уровень IgE в сыворотке крови приводит к высокой экспрессии рецепторов и активации клеток в ответ даже на небольшой антигенный стимул. Даже при низкой свободной концентрации IgE в сыворотке крови его биологическая активность в ответ на специфический аллерген может быть очень высокой. Результаты эпидемиологических, экспериментальных и клинических исследований свидетельствуют о центральной роли IgE в формировании и персистенции астматических симптомов в ответ на воздействие аллергенов, что обусловливает целесообразность и эффективность стратегий терапии астмы, направленных на модуляцию IgE-ответа: элиминация аллергена; иммунотерапия аллергенами и анти-IgE-терапия с помощью моноклональных антител (омализумаб). Развитие эры биологической терапии БА началось именно с препарата, направленного на модификацию аллергического воспаления по IgE-зависимому типу. Омализумаб стал первым биологическим препаратом для лечения тяжелых пациентов с атопическим фенотипом БА.
Препарат омализумаб (Ксолар) представляет собой гуманизированные моноклональные антитела к FcεRI- (Сε3)-связывающему домену человеческих IgE (рис. 1).
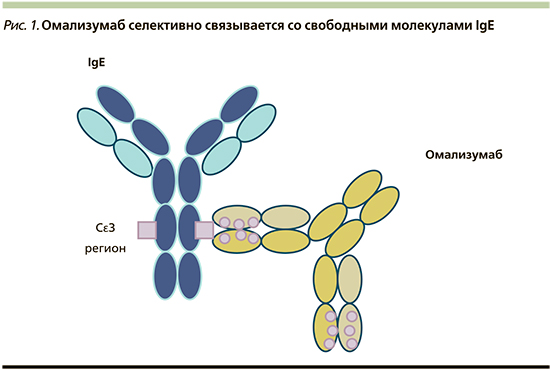
Механизм действия омализумаба состоит в селективном связывании со свободными молекулами IgE, тем самым препарат препятствует их связи со специфическими рецепторами, прежде всего с высокоаффинными рецепторами (FcεRI) на тучных клетках и базофильных лейкоцитах. Это приводит к снижению экспрессии указанных рецепторов на клетках и в конечном итоге к уменьшению секреции медиаторов аллергического воспаления и редукции самого воспаления. Молекула омализумаба не связывается с IgE, уже фиксированными на клетках. В ранних исследованиях продемонстрировано подавление ранней и поздней фаз аллергической реакции при незначительном снижении (менее чем на 5%) свободного IgE в сыворотке [15]. Омализумаб способен подавлять синтез новых молекул IgE-антител. Предотвращая связывание IgE с высокоаффинными рецепторами на дендритных клетках, омализумаб угнетает презентацию антигена Т-лимфоцитам [16]. Важным эффектом препарата является способность угнетать эозинофильное воспаление [17, 18].
Омализумаб нашел широкое применение в клинической практике. Он стал настоящим прорывом и открыл окно в новую эру таргетной терапии пациентов с БА. Одним из самых важных моментов в получении хорошего ответа на применение препарата является правильный выбор пациента.
В руководстве GINA по трудной и тяжелой БА [19] эксперты следующим образом отвечают на вопрос: подходит ли пациент для анти-IgE-терапии ТБА?
- Наличие сенсибилизации по данным кожных прик-тестов или специфических IgE.
- Уровень общего IgE и масса тела пациента находятся в рамках возможного режима дозирования (расчет дозы омализумаба осуществляется с учетом массы тела пациента и уровня IgE).
- Обострения за предшествовавший год.
При этом следующие факторы помогут предвидеть хороший ответ на анти-IgE:
- эозинофилы крови >260 кл/мкл ++;
- FeNO>20ppb +;
- связь симптомов астмы с аллергеном +;
- начало астмы в детском возрасте +.
Довольно часто в категорию пациентов, которым показано и будет высокоэффективным лечение омализумабом, попадают молодые пациенты с тяжелой атопической БА. Ниже мы приводим два клинических случая успешного применения омализумаба молодыми пациентами с тяжелой аллергической БА.
Клинический случай 1
Пациентка К. 18 лет обратилась на кафедру аллергологии и иммунологии РМАНПО в связи с частыми приступами удушья, снижением переносимости физической нагрузки, кашлем, ночными пробуждениями (частота приступов не менее 1–2 раз в неделю). Из анамнеза: страдает БА с 2002 г., когда впервые появились приступы затрудненного дыхания. Диагноз БА был установлен в 2003 г. Неоднократные госпитализации с частотой не менее 2 раз в год в связи с обострением БА. При аллергологическом обследовании, тестировании на наличие специфических IgE (последнее проводилось в 2018 г.) диагностирована сенсибилизация к бытовым аллергенам (клещ домашней пыли). В качестве базисной терапии применялась фиксированная комбинация ИГКС/ДДБА флутиказон фуроат/сальмотерол 500/50 мкг 2 раза в сутки, сальбутамол – для купирования симптомов БА. В связи с неконтролируемым течением БА, несмотря на базисную терапию, до 3 раз в год получала курсы преднизолона перорально по 5–7 дней, а также 3–4 раза в год терапию с использованием раствора будесонида и сальбутамола через небулайзер. Пациентка не курит и никогда не курила, какой-либо дополнительной терапии не использует.
При обращении на кафедру аллергологии и иммунологии проведено комплексное обследование с исследованием показателей крови, в т.ч. общий и биохимический анализы крови, наличие антител к ВИЧ, гепатитам В и С, проведена рентгенография придаточных пазух носа и органов грудной клетки, электрокардиография (ЭКГ), тест на беременность. Клинически значимых отклонений от нормы не получено.
При обследовании обращало на себя внимание повышение уровня общего IgЕ до 257 МЕ/мл, эозинофилия крови – 25% (2100 кл/мкл).
При осмотре состояние пациентки соответствовало неконтролируемой тяжелой аллергической БА. Одышка в покое (до 19 дыхательных движений в минуту), при небольшой физической нагрузке (подъем на один лестничный пролет) отмечалось усиление одышки до 23–25 дыхательных движений в минуту. При аускультации дыхание в легких жестокое, ослаблено в нижних отделах, сухие свистящие хрипы. Сатурация кислорода – 96% (по пульсоксиметру). При проведении спирографии показатель ОФВ1 (объем форсированного выдоха за первую секунду) составил 49% (1,99 л) от должного, что свидетельствует о выраженном нарушении бронхиальной проходимости, после ингаляции β2-агониста (вентолин) прирост ОФВ1 составил 200 мл. Согласно опроснику ACQ-5 (Asthma Control Questionnaire), уровень контроля – 1,8 балла. Пациентке установлен диагноз: бронхиальная астма, атопическая форма, тяжелое неконтролируемое течение. ДН0. Аллергический ринит, персистирующее течение, аллергический конъюнктивит. Сенсибилизация к клещу домашней пыли.
Решено начать терапию омализумабом с учетом массы тела пациентки (66 кг) в дозе 450 мг 1 раз в месяц.
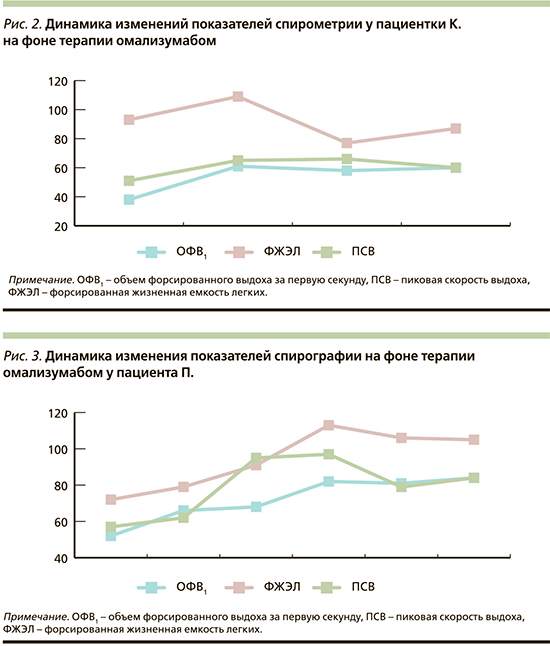
Пациентке проведен мониторинг показателей ОФВ1 на фоне получаемой терапии. Уже в первый месяц терапии пациентка отметила уменьшение частоты приступов удушья, отсутствие ночных пробуждений, улучшилась переносимость физической нагрузки. Через месяц после введения первой дозы препараты показатели ОФВ1 составили 62%. Спустя 4 месяца от начала терапии омализумабом показатели ОФВ1 несколько снизились и составили 58%, но клиническое улучшение сохранялось. Через 10 месяцев терапии ОФВ1 – 60% со значимым клиническим эффектом.
За 12-месячный период терапии омализумабом случаев госпитализации в связи с обострением БА не было, наблюдался один эпизод обострения астмы, связанный с острой респираторной вирусной инфекцией, который потребовал применения раствора будесонида через небулайзер в течение 3 дней. Преднизолон в течение года не применяла. Пациентка отмечает значительное улучшение качества жизни: увеличение времени общения с друзьями, улучшение показателей успеваемости в университете (окончание учебного года с отличием), возобновила занятия в хоре.
Показатели общего анализа крови: проведен контроль показателей через 4 месяца лечения, отмечается снижение уровня эозинофилов крови с 25% (2100 кл/мкл) до 14,7% (1100 кл/мкл). Уровень контроля, согласно опроснику ACQ-5, – 0,8 балла.
В настоящий момент пациентка продолжает получать терапию омализумабом в дозе 450 мг 1 раз в месяц.
Таким образом, дополнительная терапия омализумабом пациентки с тяжелой аллергической БА, неконтролируемой на высоких дозах ИГКС/ДДБА, привела к выраженному клиническому улучшению течения БА: уменьшению симптомов, редукции обострений и улучшению функции легких, снижению эозинофилии крови.
Клинический случай 2
Пациент П. 28 лет наблюдается на кафедре аллергологии и иммунологии РМАНПО в связи с тяжелой неконтролируемой БА. Приступы удушья беспокоят не менее 2–3 раз в неделю, отмечаются снижение переносимости физической нагрузки, ограничения в повседневной жизни. Из анамнеза известно: диагноз БА установлен в 1998 г., с того времени получал ИГКС, затем в связи с малой эффективностью терапии получал комбинированный препарат ИГКС/ДДБА.
В течение последних трех лет получает комбинацию будесонид/формотерол 160/4,5 мкг по 2 вдоха 2 раза в день и дополнительно для купирования приступов удушья использует тот же препарат (режим единого ингалятора). Проводилось обследование на наличие сенсибилизации методом определения специфических IgЕ, последнее тестирование в 2017 г. Выявлена сенсибилизация к бытовыми (клещ домашней пыли), эпидермальным (кошка, собака) аллергенам. Обострения БА не менее 2 раз в год, использование системных ГКС по крайней мере 1 раз в год, последний эпизод весной 2018 г.
Пациент испытывает значительные ограничения в социальной сфере, вынужденно ограничивает физические нагрузки из-за БА. Не курит, никогда не курил. Дополнительной терапии не использует. При обращении на кафедру аллергологии и иммунологии проведено комплексное обследование с исследованием показателей крови, в т.ч. общий и биохимический анализы крови, наличие антител к ВИЧ, гепатиту В, гепатиту С, проведена рентгенография придаточных пазух носа и органов грудной клетки, ЭКГ. Клинически значимых отклонений от нормы не получено. При обследовани уровень общего IgЕ – 109 МЕ/мл, эозинофилы крови – 4,7% (250 кл/мкл).
При осмотре состояние пациента удовлетворительное. При аускультации дыхание жесткое, сухие свистящие хрипы в нижних отделах легких, усиливающиеся при форсированном дыхании. При проведении спирографии: ОФВ1 составил 52% от должного (2,41 л), что свидетельствует о выраженном нарушении бронхиальной проходимости, бронхолитический тест положительный, прирост ОФВ1 составил 880 мл, контроль уровня симптмов астмы, согласно опроснику ACQ-5, – 1,6 балла. Пациенту установлен диагноз: бронхиальная астма, атопическая форма, тяжелое неконтролируемое течение. ДН0. Аллергический ринит, персистирующее течение. Аллергический конъюнктивит. Сенсибилизация к клещу домашней пыли, эпидермальным аллергенам (кошка, собака). Решено начать терапию омализумабом с учетом массы тела пациента (77 кг) в дозе 300 мг 1 раз в месяц.
Уже после первой инъекции омализумаба пациент отметил существенное клиническое улучшение, выразившееся в уменьшении симптомов и потребности в дополнительных ингаляциях будесонид/формотерол. Через месяц показатель ОФВ1 достиг 66%, а уже через 4 месяца лечения – 82%.
В контрольном анализе крови спустя 6 месяцев терапии наблюдалось снижение уровня эозинофилов до 2,3% (150 кл/мкл), уровень контроля симптомов, согласно опроснику ACQ-5, составил 0,4 балла.
За 12-месячный период лечения омализумабом у пациента обострений БА отмечено не было. Отмечено значительное улучшение качества жизни: пациент увеличил свою физическую активность: 1 раз в неделю играет в футбол, 2 раза в неделю посещает тренажерный зал. В апреле 2019 г. участвовал в групповом спортивном соревновании «Гонка Героев», где требовалась хорошая физическая подготовка и выносливость.
Пациент продолжает терапию омализумабом в дозе 300 мг 1 раз в месяц.
Таким образом, дополнительная терапия омализумабом пациента с тяжелой аллергической БА, неконтролируемой на высоких дозах ИГКС/ДДБА, привела к выраженному клиническому улучшению течения БА: уменьшению симптомов, редукции обострений, улучшению функции легких, а также снижению числа эозинофилов в периферической крови.
Заключение
Молодые пациенты с тяжелой атопической БА, по нашим наблюдениям, демонстрируют быстрый и явный ответ уже после первого введения омализумаба, который сохраняется на протяжении всего периода лечения. Главное достижение от биологической терапии этих пациентов – это отсутствие или значимое уменьшение частоты обострений, а стало быть, отсутствие потребности в системных ГКС. От молодых пациентов удается получить выраженное улучшение функции легких, также отмечается значительное улучшение качества жизни. Пациенты сохраняют высокую приверженность терапии, что позволяет им вносить разнообразие в повседневную активность и расширять возможности в рабочей и личной сферах деятельности, что является для больных этой категории первоочередным. По мнению пациентов, начало применения омализумаба стало поворотной точкой в их отношениях с БА и привело к пониманию, что контроля заболевания можно достичь и БА больше не является приговором.


