Введение
Гиперсекреция вязкой бронхиальной слизи (БС) характерна для ряда хронических заболеваний органов дыхания, таких как хронический бронхит (ХБ), хроническая обструктивная болезнь легких (ХОБЛ), муковисцидоз, первичная цилиарная дискинезия и бронхоэктазия без муковисцидоза. Характерными симптомами всех этих заболеваний являются кашель, экспекторация мокроты и эпизодические обострения, которые, как правило, дают основание для диагностики ХБ. Для этих заболеваний типичны развитие обструкции дыхательных путей (ДП) слизистыми пробками (мукостаз), выпячивания (эктазии) стенок ДП, хроническое воспаление слизистых оболочек и бактериальные инфекции. К общим признакам, объединяющим все эти заболевания, относится раннее его проявление в мелких ДП – бронхиолах, что подтверждается результатами патологоанатомических вскрытий, исследований функции внешнего дыхания и микрокомпьютерной томографии.
Патогенез развития нарушений мукоцилиарного клиренса
В норме у практически здоровых людей на поверхности слизистой оболочки ДП находится слой БС, передвигающийся по ее поверхности от дистальных отделов ДП к проксимальным, от бронхиол к трахее со скоростью 50 мкм/с. При развитии ХБ/ХОБЛ возникающие дефекты слизистой оболочки ДП способствуют нарушению водно-электролитного транспорта, повышенной секреции муцинов и/или их комбинации, что приводит к гиперсекреции БС с выраженными нарушениями ее реологических свойств (повышение вязкости, адгезивности и снижение эластичности). В результате нарушается мукоцилиарный клиренс (МЦК), замедляется продвижение БС. Слизь, которая накапливается в трахее и бронхах, может откашливаться и выделяться в виде мокроты (мокрота – это БС, в полости рта смешанная со слюной). В то же время БС, накапливающаяся в мелких ДП, не имеющих рецепторов кашлевого рефлекса, не может быть экспекторирована и образует очаг мукостаза, т.е. создает предпосылки к развитию обструкции ДП, инфекции и воспаления [1].
БС в ДП человека представляет собой гидрогель, состоящий примерно из 98% воды, 0,9% солей, 0,8% белков (глобулинов) и 0,3% высокомолекулярных полимеров муцина. Секретируемые полимеры муцина переплетаются, образуя сетчатые гели с размерами ячеек, зависящими от вязкости БС (рис. 1). Чем выше вязкость БС, тем меньших размеров формируются ячейки [1].
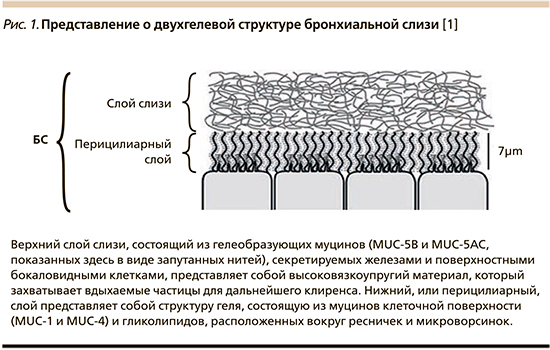
В составе БС преобладают 2 класса дыхательных муцинов – MUC-5B и MUC-5AC [2]. В норме поверхностный эпителий ДП человека секретирует оба муцина, а дополнительно MUC-5B секретируются подслизистыми железами [3].
Вдыхание инородных частиц, раздражающих газов и иных аэрополлютантов, способствует экспрессии клеток поверхностного эпителия ДП, синтезирующего как MUC-5AC, так и MUC-5B [4]. Оба муцина имеют много общих особенностей, включая их длину (от 0,2 до 10 мкм), полимерную организацию и высокое содержание углеводов (приблизительно 75% от общей массы). В то же время существуют значительные различия в регуляции транскрипции и функций MUC-5B и MUC-5AC.
MUC-5В необходим для осуществления базального МЦК, тогда как секреция MUC-5АС увеличивается в ответ на внешние воздействия. Подтверждением является и то, что в ДП здорового человека уровень MUC-5B выше, чем MUC-5AC, а их соотношение составляет 10:1.[5]. Их участие в патогенезе ХБ/ХОБЛ подтверждает и аномальное повышение концентрации обоих муцинов. В случае развития заболеваний доминирующим муцином является MUC-5B, хотя уровень MUC-5AC также повышен и может поддерживать МЦК на удовлетворительном уровне [5].
Классическая модель МЦК включает БС, а также клетки, секретирующие ее, и реснитчатые клетки, осуществляющие продвижение БС по ДП. БС имеет два слоя – гель и золь. Ранее считалось, что перицилиарный слой представляет собой жидкую субстанцию золь, в которой свободно двигаются реснички цилиарных клеток [5, 6]. В настоящее время перицилиарный слой БС идентифицируется как плотный гель, который состоит из гликополимеров, включающих муцины MUC-1, -4 и -16, привязанных к поверхности эпителиальных клеток и ресничкам. Важная концепция, которая возникла из этого положения, заключается не только в том, что аппарат МКЦ состоит из двух полимерных гидрогелей, но и в том, что они конкурируют за гидратацию БС. Сила, которая опосредует гидратацию полимера-геля, т.е. сила вытягивания воды, описывается как осмотическое давление гидрогеля. Экспериментальные измерения показали, что осмотическое давление нормального слоя слизи, состоящего из 2% твердых веществ, составляет приблизительно 100 Па [4, 6], тогда как перицилиарный слой является более концентрированным с осмотическим давлением приблизительно 500 Па [6]. Более высокое осмотическое давление перицилиарного слоя у здоровых людей определяет его хорошую гидратацию, обеспечивая соответствующую «смазку», необходимую для активности реснитчатых клеток и транспорта вышележащего слоя слизи [6]. Таким образом, была сформулирована двухгелевая модель БС, которая позволяет количественно предсказывать взаимодействие между концентрацией слоя слизи (гидратацией) и эффективностью мукоцилиарного транспорта.
У здоровых людей эпителий ДП может секретировать или поглощать ионы и воду, вероятно, делая то и другое одновременно [7]. Поддержание нормальной гидратации поверхности ДП обеспечивается реснитчатыми клетками концентрации слизистого слоя и за счет тонкой настройки скорости транспорта ионов и жидкости через активацию пуриноцепторов [8, 9].
В хорошо гидратированном нормальном состоянии (2% твердых веществ и 98% воды) слой слизи действует как жидкий буфер для обеспечения эффективного транспорта БС. Однако при ХБ/ХОБЛ аномальное всасывание эпителиальной жидкости уменьшает гидратацию, увеличивает концентрацию слизи и повышает осмотическое давление в слое БС до уровней, превышающих таковые в перицилиарном слое. Умеренно гиперконцентрированная слизь, связанная с заболеванием, сдавливает реснички и замедляет транспорт БС, в то время как гиперконцентрация сглаживает реснички, вызывая застой и адгезию слизи. Таким образом, двухгелевая композиция определяет связь скорости мукоцилиарного транспорта с концентрацией слизи и объясняет, почему относительно небольшие изменения в состоянии гидратации БС (2 против 8% твердых веществ и 98 против 92% воды) вызывают заболевание [10].
Физические свойства БС (реологию) определяют не только хорошо изученные вязкоупругие свойства слизи, но и другие ключевые биофизические свойства, включающие осмотическое давление слизи, адгезивность, эластичность и т.д. [6]. Было показано, что даже относительно небольшие изменения реологии оказывают значительное влияние на биофизические и транспортные свойства БС [6]. Когда МЦК терпит неудачу, кашель становится резервным механизмом клиренса ДП [1, 11].
ДП защищены от инфекции как антимикробными белками и пептидами (IgA, интерфероны, лактоферрин и лизоцим), которые секретируются эпителиальными клетками ДП, так и МЦК [12]. Способность антимикробных молекул и антител подавлять репликацию бактериальной инфекции кратковременна и отчасти связана с замедлением МЦК. Однако одного лишь замедления МЦК, вероятно, недостаточно для возникновения заболевания. Исследования на экспериментальных моделях животных показали, что полный спектр ХБ/ХОБЛ, включая обструкцию воздушного потока, воспаление и интермиттирующую инфекцию, наблюдается при образовании бляшек и пробок, зависящих прежде всего от концентрации слизи, в меньшей степени – от замедления МЦК [13].
Образование слизистых бляшек или пробок в ДП отражает увеличение секреции муцина, часто стимулируемое вирусными инфекциями или аспирацией, в сочетании с плохой эпителиальной гидратацией вновь секретируемых муцинов. При образовании гиперконцентрированных статичных слизистых бляшек инициируется «порочный» слизисто-воспалительный круг [10]. В конечном итоге тяжелая или стойкая слизистая обструкция, обычно связанная с повышенным уровнем эластазы нейтрофилов в ДП, приводит к прогрессированию поражения ДП от бронхитического до бронхоэктатического или бронхиолоэктатического, типичного для ХБ/ХОБЛ [10].
Слизистые бляшки и пробки, образовавшиеся в ДП, служат и основным очагом бактериальной инфекции при ХБ/ХОБЛ. Ограничение диффузии кислорода через слизистые бляшки к нижележащим активно метаболизирующимся эпителиальным клеткам приводит к возникновению областей гипоксии внутри слизистых бляшек. При анализе микробиомных данных, полученных от пациентов с ХБ/ХОБЛ, установлено, что первыми бактериальными патогенами в слизистой оболочке ДП являются оральные анаэробы. Таким образом, наличие гастроэзофагеального рефлюкса объясняет бактериальное заражение гипоксических бляшек [14, 15]. Анаэробные бактерии могут «использовать» гипоксическую слизистую среду для содействия инвазии классическими патогенами (например, Pseudomonas aeruginosa), которые реагируют на зависящее от концентрации слизи создание агрегатов или биопленок, необходимых для их жизнедеятельности [16].
Обострения ХБ/ХОБЛ связаны с дальнейшим распространением патологического процесса, захватывающего ранее незатронутые зоны ДП [17]. Главным триггером его распространения являются вирусы, аспирированные из верхних ДП в легкие. Общая скорость прогрессирования тяжести заболевания (нарушения функции легких) в значительной степени зависит от частоты и тяжести обострений – предикторов развития будущих обострений [18].
Роль нарушений МЦК в патогенезе ХОБЛ
ХОБЛ развивается в ответ на вдыхаемые раздражители. Сигаретный дым, так же как и другие аэрополлютанты, вызывает развитие оксидативного стресса, который инактивирует различные антипротеазы, в т.ч. и α1-антитрипсин [19]. Секретообразующие элементы слизистой оболочки ДП начинают продуцировать массу липкой, вязкой слизи. Возрастание содержания нейтральных мукопротеинов в БС приводит к повышению ее вязкоэластических свойств и адгезивности. Ухудшение реологии БС, развитие оксидативного стресса, непосредственное воздействие аэрополлютантов на реснитчатые клетки слизистой оболочки (метаплазия эпителиальных клеток) нарушают эффективность МЦК, блокируя его очистительную функцию, способствуя фиксации, более глубокому проникновению и колонизации респираторных микроорганизмов в толщу слизистой оболочки. Оксидативный стресс провоцирует и поддерживает воспалительный процесс в ДП. С повышением вязкости БС скорость ее движения замедляется (на 10–55%) или движение прекращается вовсе, причем в ночное время вязкость БС у больных ХОБЛ значительно выше, чем днем. Гиперпродукция и гиперконцентрация слизи в сочетании с мукоцилиарной дисфункцией при прогрессировании заболевания могут нарушать дренажную функцию бронхов и влиять на бронхиальную проходимость [20].
Гиперконцентрация муцинов в БС коррелирует как с тяжестью заболевания, так и с выраженной обструкцией воздушного потока, склонностью к инфекциям и более частым обострениям [10, 21] (рис. 2).
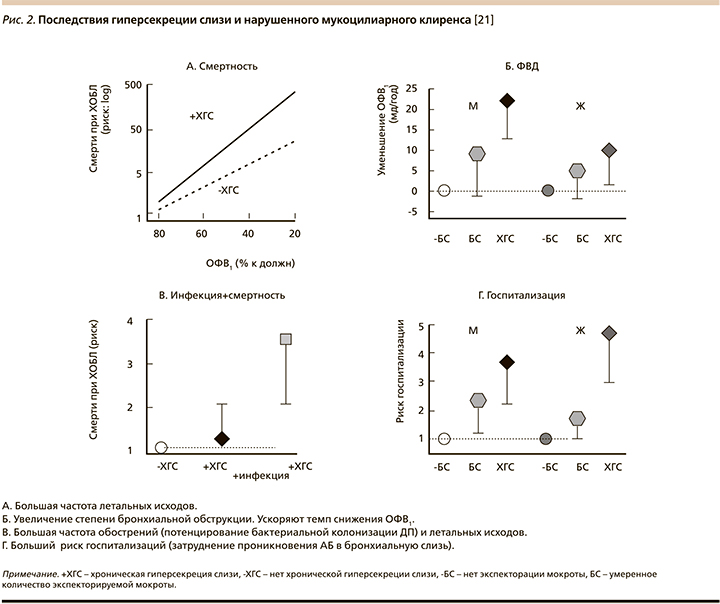
Подтверждением вышесказанного могут служить данные исследования P.R. Burgel et al. (2007), в котором 433 больных ХОБЛ были разделены на 2 группы: с жалобами на продуктивный влажный кашель (n=321) и без кашля (n=112) [22]. Частые обострения (≥2 за 1 год) достоверно чаще отмечались у больных с признаками ХБ: 55 против 22% в группе пациентов без кашля и мокроты (p<0,0001) [5, 18, 20].
В ряде эпидемиологических исследований была показана довольно сильная взаимосвязь между повышенной продукцией мокроты и неблагоприятными исходами для больных ХОБЛ. В исследовании по изучению летальности от ХОБЛ в шести американских городах респираторные симптомы (в т.ч. продукция мокроты) оказались значимым предиктором смертности больных, не зависимым от их легочной функции [23]. В исследовании Copenhagen City Heart Study хроническая гиперпродукция бронхиального секрета имела достоверную и значимую взаимосвязь как с ускоренным снижением легочной функции, так и с повышенным риском развития обострений и госпитализаций больных ХОБЛ [24, 25].

Место мукоактивных препаратов в программе лечения ХОБЛ
При лечении больных, страдающих от кашля с нарушениями экспекторации мокроты, применяют мукоактивные препараты (МАП). При эмпирическом назначении МАП, как правило, наблюдается хороший эффект от такой терапии. Учитывая заметный вклад гиперсекреции вязкой БС и последующего развития мукостаза в патогенез ХОБЛ, развитие обострений и летальных исходов, возникает предположение о необходимости применения МАП в программе лечения ХБ/ХОБЛ. В настоящее время имеется достаточно большое количество МАП – препаратов, активно воздействующих на структуру БС (см. таблицу) [26].
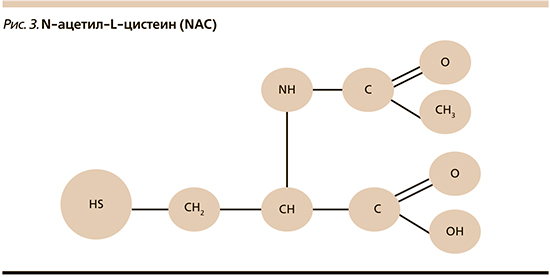
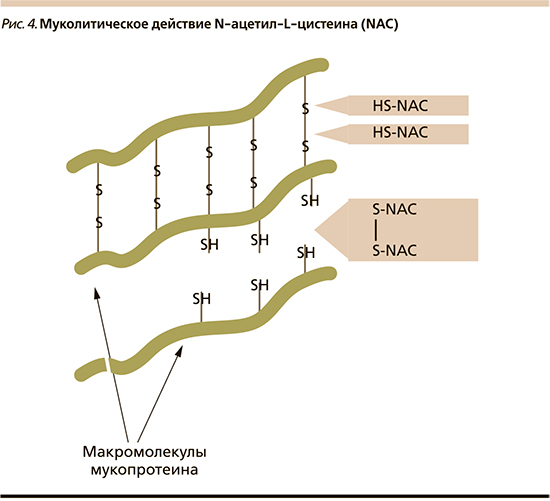
Важным этапом в лечении ХБ/ХОБЛ стало появление в 1963 г. прямого муколитика N-ацетил-L-цистеина (NAC; рис. 3), производного L-цистеина, относящегося к группе тиолов. Содержащиеся в его молекуле реактивные тиоловые (сульфгидрильные) SH-группы разрывают дисульфидные связи мукополисахаридов БС, оказывая прямое муколитическое действие (рис. 4). В результате деполимеризации макромолекул БС, в т.ч. и гнойной, становится менее вязкой и адгезивной. К разжижению БС приводит и стимуляция мукозных клеток, секрет которых способен лизировать фибрин, кровяные сгустки, гной.
NAC как активный муколитический агент широко использовался в клинике с середины 1960-х гг., особенно при лечении больных ХБ/ХОБЛ. Пероральный NAC быстро абсорбируется из желудочно-кишечного тракта и быстро превращается в активную форму в легочной ткани и бронхиальном секрете. Муколитический эффект проявляется уже через несколько часов после приема per os. Препарат хорошо переносится, за исключением редких случаев желудочно-кишечных побочных эффектов [27].
В 1989 г. O.T. Aruoma et al. обнаружили неспецифическую активность NAC, направленную на нейтрализацию различных свободнорадикальных групп. Нужно отметить, что в ряду муколитических средств NAC – единственный на сегодняшний день МАП, сочетающий свойства прямого и непрямого антиоксиданта, оказывающего действие даже в очень низких концентрациях [28].
Прямое антиоксидантное действие препарата обусловлено наличием свободной тиольной группы, взаимодействующей с электрофильными группами свободных радикалов и реактивных кислородных метаболитов, ответственных за развитие острого и хронического воспаления легочной ткани и ДП. Препарат инактивирует практически все разновидности активных метаболитов кислорода, в т.ч. наиболее реакционноспособные формы. Одним из благоприятных последствий этого эффекта является защита антипротеаз (α1-антитрипсина и др.) от разрушительного воздействия свободных радикалов, появляющихся в большом количестве при развитии оксидативного стресса, благодаря чему происходит замедление эластолитической деструкции легочной ткани, развития и прогрессирования эмфиземы легких.
Непрямое антиоксидантное действие препарата обусловлено тем, что за счет аминокислоты цистеина (образующейся при распаде NAC) он является предшественником глутатиона, принимающего участие в процессах детоксикации организма, защиты слизистых ДП от внешних и внутренних повреждающих воздействий. Таким образом, NAC увеличивает синтез глутатиона. Это свойство NAC широко используется при лечении передозировки парацетамола.
Антиоксидантное действие NAC косвенно влияет на уменьшение продукции БС, т.е. оказывает мукорегуляторный эффект. Но самым важным результатом прямого антиоксидантного действия NAC является отчетливый противовоспалительный эффект. Именно с антиоксидантной активностью NAC связываются перспективы длительного применения препарата больными ХОБЛ с целью предотвращения обострений заболевания. Начиная с первых редакций [29] экспертами GOLD указывалось, что, «несмотря на улучшение состояния у некоторых пациентов с вязкой мокротой, в целом эффективность муколитиков невелика и, следовательно, широкое использование этих препаратов не может быть рекомендовано на основе существующих доказательств (уровень доказательности Д)». Однако в GOLD есть и рекомендация по применению антиоксидантов, особенно NAC, которые снижают частоту обострений ХОБЛ и могут иметь значение в лечении пациентов с частыми обострениями (уровень доказательности В) [1]. Подтверждением служат результаты ряда исследований, проведенных еще в конце прошлого века [28, 30–32].
Так, например, в 1999 г. в исследовании R. Pela et al. [32] больные (n=169) были рандомизированы для лечения пероральным NAC в дозе 600 мг 2 раза в день либо плацебо. Основной конечной точкой была частота обострений ХОБЛ, которая снизилась на 41% в группе NAC по сравнению с группой плацебо. При назначении препарата уменьшилось число больных, переносивших многочисленные обострения, а легочная функция в этой группе немного, но достоверно улучшилась.
В 2003 г. получены доказательства того, что длительный прием NAC в течение 3 лет (исследование BRONCUS – Bronchitis Randomized On NAC Cost Utility Study) обусловливает уменьшение тяжести обострений заболевания, продолжительности антибактериальной терапии, а также демонстрирует отчетливое положительное влияние на величину ОФВ1 [33]. Было установлено, что в группе пациентов, не принимавших ингаляционных глюкокортикостероидов, уменьшилось и количество обострений.
В самом крупном на сегодняшний день исследовании J.P. Zheng et al. [34] больные (n=1006) получали пероральный NAC в дозе 600 мг 2 раза в день или плацебо. Это крупное рандомизированное многоцентровое проспективное плацебо-контролируемое исследование в параллельных группах выполнено в Китае. По спирометрическим показателям в него были включены больные среднетяжелой и тяжелой ХОБЛ в возрасте от 40 до 80 лет, перенесшие ≥2 обострений в предшествовавшие 2 года. Пациенты также были подразделены по использованию ингаляционных глюкокортикостероидов. Частота обострений в группе NAC составила 1,16 против 1,49 в группе плацебо (отношение шансов – 0,78 в пользу NAC). Время до 1-го обострения не различалось между группами NAC и плацебо, но время до 2-го и 3-го обострений в группе плацебо было меньше. NAC оказался эффективнее при ХОБЛ II стадии (GOLD), чем при III стадии, поскольку время до 1-го обострения у больных ХОБЛ II стадии было продолжительнее, чем при ХОБЛ III стадии. Частота побочных эффектов терапии не различалась между группами NAC и плацебо.
Заключение
По объединенным результатам многочисленных исследований выявлено снижение частоты обострений ХОБЛ, связанное с приемом NAC (относительный риск – 0,61; 95% доверительный интервал – 0,37–0,99). Но только ли антиоксидантный эффект NAC способствует урежению частоты обострений? Известно, что частота развития обострений коррелирует с более или менее выраженным бронхитическим фенотипом ХОБЛ [1]. В то же время практически все исследования проводились без учета фенотипов ХОБЛ и «случаев улучшения состояния у некоторых больных с вязкой мокротой» [29]. В 2012 г. испанские пульмонологи, оценив гетерогенность ХОБЛ, выделили несколько фенотипов, в т.ч. «обострение с хроническим бронхитом», что дало возможность включения в программу лечения МАП не только в качестве антиоксидантов, а именно как мукоактивных препаратов [35]. На то же указывает и руководство американских и канадских пульмонологов: «для предотвращения обострений у больных среднетяжелой и тяжелой ХОБЛ с >2 обострений за предшествовавшие 2 года рекомендуется терапия пероральным NAC (класс рекомендаций 2В)» [36]. Ну и наконец, в последней редакции GOLD определено новое место NAC: в разделе противовоспалительной терапии при стабильной ХОБЛ отмечено, что «регулярное лечение муколитиками уменьшает риск обострений в избранных популяциях [37].



